许氏平鲉卵巢发育的周年变化研究*
2011-01-08温海深杨艳平
史 丹,温海深,杨艳平
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
许氏平鲉卵巢发育的周年变化研究*
史 丹,温海深**,杨艳平
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
利用石蜡切片技术对卵胎生许氏平鲉(Sebastes sch legeli Hilgendorf)的卵巢发育期、卵母细胞发育时相进行了划分,并对性腺成熟系数、肝重指数和肥满度的年周变化进行了研究。结果表明,许氏平鲉卵巢发育可以分为7个期,卵母细胞分为6个时相;以Ⅲ期卵巢越冬,翌年5月进入分娩期,7~11月上旬卵巢保持在重复发育Ⅱ期。许氏平鲉卵巢平均成熟系数波动在0.33~19.82之间,平均肝重指数波动在0.33~3.10之间,平均肥满度波动在2.51~3.20之间。分娩期之前,肝重指数与性腺成熟系数基本呈正相关,产仔期后肝重指数显著下降。该鱼1年成熟1次,属于一次性生殖类型。
许氏平鲉;卵巢;发育;组织学
我国学者基于对“四大家鱼”繁殖生理研究,提出了以鱼类卵巢本身的组织学成分为基础,结合卵母细胞各个发育阶段的细胞形态学和生理学特征进行卵巢发育时期划分[1],该分期方法被大多数学者接受。但是,关于卵胎生鱼类繁殖生理仅见对褐昌鲉(Sebastiscusm arm oratus)的研究报道[2],性腺发育组织学分期尚无统一标准。
许氏平鲉(Sebastes schlegeli Hilgendo rf)原名黑鲪,隶属于鲉形目(Scorpaeniformes)鲉科(Scorpaenidae)平鲉属(Sebastes),营卵胎生繁殖[3]。它广泛分布于北半球温带水域,是我国黄渤海常见的经济鱼类[4]。该鱼生存温度范围较广,洄游范围小,一般栖息于浅海岩礁或海藻丛中,易于利用人工鱼礁增殖或进行网箱养殖[5-6]。由于其肉质鲜美,营养丰富,生长快速且抗病能力强,成为北方沿海人工养殖的重要品种[7]。目前,已有国内外学者对许氏平鲉的生物学、胚胎发育及养殖技术等方面做过一些研究[6,8-12],但关于性腺发育的系统研究未见报道。本文以黄海网箱养殖的许氏平鲉为对象,侧重卵巢发育组织学和性成熟系数周年变动,研究结果在理论上丰富硬骨鱼类繁殖生理学内容,在实践上为建立许氏平鲉全人工繁殖技术提供科学依据。
1 材料与方法
1.1 实验鱼来源
2008年11月~2009年9月,共采集山东沿海网箱养殖许氏平鲉雌性成鱼58尾,并收集养殖区水温资料。在实验室海水养殖水槽内暂养2~3 d后,经麻醉后解剖,收集组织学样品,同时测定生物学指标,包括体长、体质量、卵巢质量、肝脏质量等(见表1)。计算性腺成熟系数[GSI]=性腺质量/去内脏质量×100、肝质量指数[HSI]=肝质量/去内脏质量×100、肥满度[CF]=体质量/体长3×100。
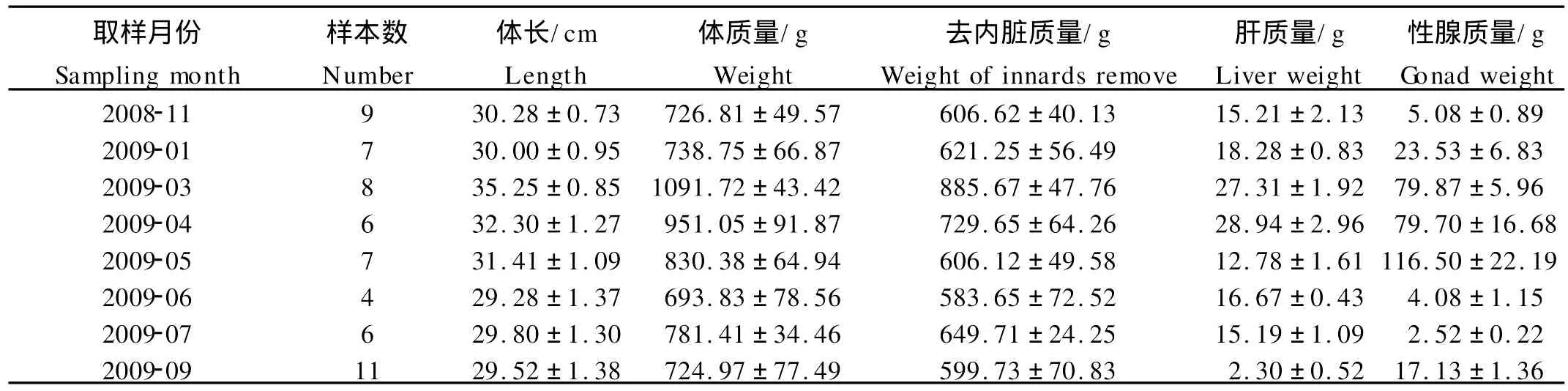
表1 雌性许氏平鲉的各项生物学指标Table 1 The biological indicators in female Sebastesschlegeli
1.2 组织切片
将卵巢不同部位切成小块,用Bouins试剂固定24 h后,经梯度酒精脱水,二甲苯透明,石蜡包埋,LEICA-RM 2016切片机连续切片,切片厚度为6~8μm,苏木精-伊红染色(H.E染色),中性树脂封片,至O-lympus显微镜下观察并拍照。对于成熟多卵粒卵巢采用Smith氏液暗处固定24~48 h,每6 h更换一次新固定液,固定后流水冲洗6~12 h,常规梯度酒精脱水,苯透明,其他同前。取活体分娩期许氏平鲉,轻压鱼腹,取出部分受精卵,滴加海水鱼生理盐水,在显微镜下观察胚胎发育情况。卵巢分期的划分参照卵胎生褐菖鲉卵巢划分分期标准[2],细胞大小以显微测微尺计算。
1.3 数据统计
实验所得数据均表示为平均数±标准误(M ean±SE),采用SPSS13.0统计软件中的Duncan’s法进行数据处理和检验分析,当P<0.05时认为差异显著。
2 结果
2.1 卵巢发育的形态学和组织学分期
卵巢位于肾脏和尿囊的腹面,呈长囊状,左右两瓣大小略微不同。卵巢前端各由1条较粗的含有明显血管的卵巢系膜固定,后端于一较短生殖道处汇合,经生殖孔开口体外。
许氏平鲉的卵巢发育可以划分为7个期,卵母细胞的发育分为6个时相。
Ⅰ期卵巢 为幼鱼的卵巢,本文侧重研究成鱼期卵巢发育,没有采集幼体标本。
Ⅱ期卵巢 性未成熟及重复发育的卵巢,卵巢呈细长囊状,长度为1.5~4.0 cm;性未成熟卵巢外观呈橘黄色(见图版Ⅰ,1-1),颜色鲜亮;重复发育的Ⅱ期卵巢略显肉红色(见图版Ⅰ,1-6),颜色暗着。该期卵巢处于小生长期阶段,卵母细胞主要为2时相。2时相早期卵母细胞形态不规则,卵径为36.2~72.3μm。胞质呈强嗜碱性反应,核内通常包含1~2个较大的核仁和4~9个零散的小核仁,核径为4.3~12.1μm。中后期卵母细胞体积略微增大且近圆球形,卵径为72.3~156.6μm,着色较早期嗜碱性弱,皮质部出现细小的液泡,围核区开始聚集油滴(见图版Ⅱ,2-1);细胞核数量增多且体积偏小,核质均匀且着色较浅;细胞外由一层滤泡细胞包围。间质细胞充斥在卵母细胞外,且富含毛细血管。
Ⅲ期卵巢 卵巢体积逐渐增大,呈中间粗两端细的囊袋状(见图版Ⅰ,1-2),长度为3.5~4.5 cm。卵巢颜色逐渐变浅,接近黄色,肉眼可见性腺内卵粒。此时期是初级卵母细胞由小生长期向大生长期过渡的阶段,以3时相卵母细胞为主。3时相卵母细胞体积较2时相显著增大,呈圆球形,卵径为197.2~276.1μm。少数2时相卵母细胞夹杂期间(见图版Ⅱ,2-2)。H.E染色较2时相卵母细胞着色浅,呈紫红色。核膜呈波浪状,近圆球形的细胞核散落在其内缘,核径为2.4~7.2μm。核膜周围出现不规则带状细丝构成的网状细胞质。卵母细胞皮质部分出现体积大于皮层小泡的油球,以后油球数目逐渐增多。3时相晚期,油球基本充满整个细胞质,靠近质膜的油滴间出现细小的卵黄颗粒。卵母细胞的滤泡细胞已由2时相的1层发展成为2层,在滤泡膜中可清楚的看到被染成深紫色的长梭型细胞核。同时,在滤泡细胞和质膜之间开始形成一薄层非细胞结构的被染成亮粉色的放射膜。

图版Ⅰ 许氏平鲉的卵巢形态学PlateⅠ The morphology of gonad in female Sebastes sch legeli
Ⅳ期卵巢 随着营养物质的不断合成与积累,卵巢逐渐成熟,体积迅速增大,长度为5.5~9.0 cm。卵巢颜色呈淡黄色(见图版Ⅰ,1-3),透过卵巢壁可以看到卵母细胞。4时相卵母细胞体积继续增大,进入卵黄颗粒充满时期。根据卵细胞大小、卵黄颗粒积累情况、细胞核的位置,可以把4时相卵母细胞分为早期(Ⅳ+)、中期(Ⅳ++)和末期(Ⅳ+++)。早期卵母细胞的卵黄颗粒数量迅速增多,卵黄颗粒体积迅速增大,但靠近细胞核的皮质部分还未充满卵黄颗粒。细胞核处于中位,核周仍可看到网状细胞质,厚度为36.2~72.3μm。另外,卵母细胞膜内缘也有一薄层细胞质在此集中。中期(Ⅳ++)卵母细胞质已基本被油球和染成亮粉色的卵黄颗粒充满,皮质部分仍有许多细小的卵黄颗粒生成,粒径为3.6~9.6μm;细胞核位于中央,核膜呈波浪状,核仁分布于核膜周边,此时核径为1.2~4.8μm;同时,亮粉色的放射膜清晰可见(见图版Ⅱ,2-4)。末期(Ⅳ+++)卵母细胞的细胞核发生偏位(见版图Ⅱ,2-3),饱满的卵黄颗粒充满核外空间,部分细小的卵黄颗粒融合成为较大的卵黄球,球径达到16.9~26.5μm。卵黄颗粒间油球分布均匀,皮层小泡不易辨认。
Ⅴ期卵巢 此时卵巢达到成熟,粗大、饱满,黄色加深,卵巢壁极薄,可以清楚看到大小均匀的卵母细胞。5时相卵母细胞已充分发育,细胞完全被成熟卵黄颗粒充斥,部分卵黄颗粒开始融合;卵母细胞出现动物胚极(见图版Ⅱ,2-5);核膜消失,只剩下一团偏向动物极的核质。
Ⅵ期卵巢 怀孕期卵巢充满整个体腔(见图版Ⅰ,1-4),长度为9.0~11.0 cm。此时的卵巢松软膨大,卵巢壁极薄,其上附有丰富的毛细血管。卵巢受其内发育胚胎影响呈现出黄褐色,后期颜色变深。卵巢腔内充满粘稠的卵巢液,受精卵在腔内完成胚胎发育;怀孕期鱼类,轻按鱼腹便有受精卵流出。取部分受精卵在显微镜下观察,可清晰辨认出环绕着卵黄囊的胚体(见图版Ⅱ,2-8)。由HE染色可以看出孵化期胚体为嗜碱性,外胚层为嗜酸性,头部杯视内出现点状黑色素,胚体背部也有零星黑色素分布(见图版Ⅱ,2-7)。
Ⅶ期卵巢 产后卵巢迅速萎缩(见图版Ⅰ,1-6),长度为4.0~5.0 cm。卵巢壁增厚,呈颜色暗着的肉红色囊状。其内残留少部分2时相卵细胞,间质细胞凌乱且有大量血管分布,个别6时相卵母细胞参杂其间。6时相卵母细胞发生变形,油球、卵黄液化成块状(见图版Ⅱ,2-6),卵膜及滤泡膜增厚。
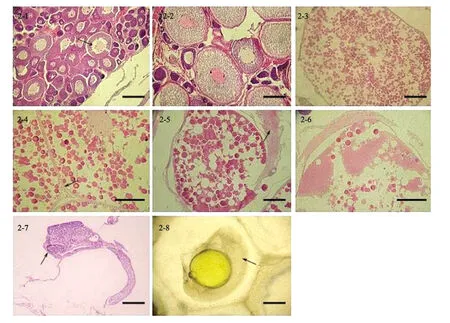
图版Ⅱ 许氏平鲉的卵巢组织学PlateⅡ The ovarian histology of Sebastes sch legeli
2.2 卵巢成熟系数、肝质量指数和肥满度的周年变化
许氏平鲉卵巢的全年平均成熟系数(GSI)波动在0.33~19.82之间,表现出明显的年周期季节性变化(见图1)。雌性许氏平鲉的肝质量指数(HSI)也呈现出一定的年周期性变化规律,但肥满度(CF)周年变化不大(见图2)。11月大部分Ⅱ期卵巢开始进入第Ⅲ期,卵巢平均GSI为0.79,翌年1月,部分雌鱼卵巢发育进入Ⅳ期,卵巢平均GSI开始增加,达到2.87,3月卵巢发育进入旺盛时期,以Ⅳ期卵巢为主,卵巢平均GSI为9.09,较1月显著增加(P<0.05),4月(平均水温12.9℃)卵巢仍以Ⅳ期为主,部分卵巢达到Ⅴ期或怀孕期,卵巢平均GSI略有上升至10.67,5月(平均水温17.2℃)卵巢进入怀孕期(Ⅵ期),个别出现Ⅶ期卵巢,卵巢平均GSI达到全年最高值19.82,6月(平均水温24.2℃)下旬平均GSI明显回落到0.64,7月(平均水温25.1℃)至11月(平均水温14.8℃)上旬许氏平鲉的卵巢始终停留在重复发育Ⅱ期,卵巢平均成熟系数明显下降到0.33~0.39之间,结果见图1。由此可见,雌性许氏平鲉繁殖期较短,以Ⅲ期卵巢越冬,4~5个月都处于Ⅱ期卵巢。雌性许氏平鲉11月的平均HSI为2.47,1月均值增加至3.03,3月略有上升到3.10,4月显著增加至3.97(P<0.05),5月怀孕期时显著下降到2.12,6月平均HSI略有回升至2.50,7月降至2.33,9月均值显著降低至全年最低值0.33(P<0.05),结果见图2。雌性许氏平鲉的CF周年无显著性差异,均值在2.51~3.20之间波动,结果见图2。

图1 雌性许氏平鲉GSI周年变化及养殖区水温的变化Fig.1 The annual change of GSIin female Sebastes schlegeli and the variation of water temperature in culture area

图2 雌性许氏平鲉HSI和CF的周年变化Fig.2 The annual change of HSIand CF in female Sebastes schlegeli
3 讨论
3.1 许氏平鲉卵母细胞的发育特点
许氏平鲉2时相卵母细胞发育早期,细胞核随机散布在致密网状结构的核质之中,这可能与核内DNA复制有关,与大多数海水鱼类相似。胞质嗜碱性,成细颗粒状分布,与龚启祥等对香鱼(Plecog lossus altivelis T.et S.)卵巢的研究结果一致[13]。在许氏平鲉2时相早期卵母细胞中未见有卵黄核的出现,在2时相中后期,胞质内出现小液泡,随后围核区出现油滴并逐渐累积,这与同属的褐菖鲉和鲥鱼(Tenualosa reevesii)研究结果基本一致[2,14]。部分海水鱼类,如黑鲷(Sparusm acrocephalus)、小黄鱼(Pseudosciaena polyactis)等[15-16],油球在3时相卵母细胞中才出现,推测3时相皮质部的油球是围核区小油滴逐渐累积,由内向外不断增多并发生部分融合导致的,这有待于今后进一步深入研究。3时相卵母细胞围核区出现的网状细胞质,在褐菖鲉[2]、东海银鲳(Strom ateoides argenteus)[17]、黄颡鱼(Pelteobagrus fu lvidraco)[18]中也有过描述,一般称为生长环,有类似卵黄核的功能,可能与营养物质的积累有关。到4时相中后期,网状细胞质消失,卵黄颗粒和油球充满整个皮质,进入5时相后卵黄颗粒和油球发生部分融合。卵母细胞内卵黄物质的来源被认为具有内源性途径和外源性途径[19]。内源性途径主要发生在内质网上,在高尔基体中加工[20]。外源性途径被认为是在17β-雌二醇(E2)的刺激下由肝脏合成卵黄蛋白原(V tg)[21],V tg经血液运输至卵巢后,经胞饮作用被卵母细胞吸收[22],进而发生卵黄物质的积累。因此,卵母细胞的成熟与肝脏合成V tg的水平具有密切关系。而且Lam bert和Dutil认为,肝重指数是肝脏能量的标志[23]。
3.2 卵巢成熟系数与肝重指数、肥满度、水温的关系
9~11月,是许氏平鲉卵巢内的初级卵母细胞逐渐步入大生长期的阶段,卵母细胞内开始有卵黄物质的积累。此后至翌年4月中下旬,初级卵母细胞逐步完成卵黄物质的生成作用,由图1可以看出,性腺成熟系数随采集月份的推移显著增高(P<0.05)。该阶段需要肝脏大量合成卵黄蛋白原,按照生理机能与器官结构一致性观点,此时肝脏功能得到强化,肝脏体积会迅速增大。对雌性许氏平鲉肝质量指数的统计结果(见图2)也显示出9月至翌年4月肝质量指数发生了2次显著性增长,由0.33增加至3.10。朱成德对雌性大银鱼(Protosalanx hyalocranius(Abbott))的研究中也发现了2个指数增长的同步性[24]。但宋海霞在研究牙鲆(Paralichthys olivaceus)性腺成熟系数与肝质量指数的关系时却发现它们呈负相关性,并指出牙鲆生长的部分能量可能来源于肝脏[25]。5月的许氏平鲉进入怀孕期,卵巢成熟系数继续显著性增大,但肝质量指数却显著性降低(P<0.05)。本文认为,许氏平鲉以Ⅲ期卵巢越冬,是肝脏迅速积累营养物质的阶段,到卵母细胞完成卵黄物质的积累并完成体内受精之后,卵巢进入怀孕期,肝脏可能由于合成卵磷脂的活性下降而迅速减小。叶泽雄等对高背鲫(Carassius auratus gibelio(Bloch))的研究表明[26],肝脏的快速缩小是由于需要供给卵巢发育所需的大量营养物质所致,即卵巢发育的能量部分来自于肝脏。6月肝质量指数的回升是由于排卵后鱼体消瘦所致,此后逐渐回复到全年最低值。许多外国研究者就大西洋鳕鱼(Gadus morhua L.)肝脏大小与精卵巢季节变化之间的关系进行了研究[27-28],发现肝脏大小除了与产卵期雌性鳕鱼发育状况有关外[29-30],与雌雄鱼性腺发育季节没有直接的关联性。这些研究结果的不同,可能与物种差异、生态习性有关,或是与肝脏的多种综合功能有关。肥满度周年变化不大,说明许氏平鲉肥满度与卵巢的成熟程度无明显关系。温度是影响鱼类卵巢发育和排卵的重要生态因子之一[31]。冯东岳等认为[6],春秋两季是许氏平鲉适温生长期,水温高于22℃时鱼体生长缓慢,由图1可以看出,水温从17.2℃上升到24.2℃过程中鱼体完成了产仔,24.2~25.1℃范围内许氏平鲉卵巢逐渐进入并保持在重复发育Ⅱ期,可见鱼体性腺发育在一定程度上受水体温度的影响。
3.3 产卵类型
硬骨鱼类的产卵类型一般分为一次性产卵类型和多次性产卵类型[1]。通过HE染色和对生物学指标的统计可以看出,采集到的各月份的许氏平鲉,除2时相卵母细胞始终在一年之中出现外,其他符合Ⅱ→Ⅲ→Ⅳ→Ⅴ→Ⅵ→Ⅶ期卵巢的发育规律。重复发育Ⅱ期卵巢内偶尔发现个别3时相和6时相的卵母细胞,但Ⅳ期卵巢内除含2时相卵母细胞外其他均处于4时相,说明随着卵巢的进一步发育,卵母细胞的发育也趋于同步,尤其是到了Ⅳ期卵巢中后期;1周年内,卵巢成熟系数只在繁殖季节出现一次高峰。以上研究结果表明,许氏平鲉是一次性生殖类型鱼类。
[1] 刘筠.中国养殖鱼类繁殖生理学[M].北京:中国农业出版社,1993:23-25.
[2] 林丹军,尤永隆.卵胎生硬骨鱼褐菖鲉卵巢的周年发育研究[J].动物学研究,2000,21(4):269-274.
[3] 冯昭信.鱼类学[M].2版.北京:中国农业出版社,2003:191.
[4] 朱龙,隋风美.许氏平鲉的生物学特征及其人工养殖[J].现代渔业信息,1999,14(4):21-25.
[5] 陈勇,刘晓丹,吴晓郁,等.不同结构模型礁对许氏平鲉幼鱼的诱集效果[J].大连水产学院学报,2006,21(2):153-157.
[6] 冯东岳,刘云,唐学玺.许氏平鲉的网箱养殖试验[J].齐鲁渔业,2004,21(6):11-15.
[7] 严全根,解绶启,累武,等.许氏平鲉幼鱼的氨基酸需求量[J].水生生物学报,2006,30(4):459-465.
[8] 万景瑞,陈瑞盛.黑鲪的生殖习性及早期形态[J].海洋水产研究,1988,9:213-220.
[9] 王雪梅,孙玉忠,朱景友,等.许氏平鲉人工育苗技术研究[J].齐鲁渔业,2008,25(4):22-23.
[10] 吴立新,王岩,秦克静.许氏平鲉人工鱼苗的初步试验[J].水产科学,1994,13(4):7-9.
[11] 林克忠,罗少军.黑鲪筏式笼养技术试验[J].齐鲁渔业,1993,10(3):26-27.
[12] 张波,唐启升.密度对黑鲪生长及能量分配模式的影响[J].海洋水产研究,2002,23(2):33-37.
[13] 龚启祥,操克驹,曾嶒.香鱼卵巢发育的组织学研究[J].水产学报,1982,6(3):221-234.
[14] 王汗平,魏开金,姚红,等.养殖鲥鱼性腺发育的研究[J].动物学报,1998,44(3):314-321.
[15] 施兆鸿.盐度对黑鲷卵巢发育的影响[J].水产学报,1996,20(4):357-360.
[16] 吴佩秋.小黄鱼卵母细胞的形态特征和季节变化[J].动物学报,1980,26(4):337-345.
[17] 龚启祥,倪海儿,李伦平,等.东海银鲳卵巢周年变化的组织学观察[J].水产学报,1989,13(4):316-325.
[18] 刘文彬,张轩杰.黄颡鱼的卵巢发育和周年变化[J].湖南师范大学学报:自然科学版,2003,26(2):73-78.
[19] 徐革锋,陈松波,牟振波.细鳞鱼的卵黄发生[J].中国水产科学,2007,14(3):377-382.
[20]Pfannenstiel H D,Grünig C.Yolk formation in an annelid(Ophryotrocha puerilis,polychaeta)[J].Tissue Cell,1982,14(4):669-680.
[21] 李云,李英文,王友慧,等.瓦氏黄颡鱼血清卵黄蛋白原和钙离子以及肝脏RNA的变化与性腺发育的关系[C].重庆:中国动物学会第十四届年会论文集,1999:17-20.
[22] Wiegand M D,Idler D R.Failure of antibody to carbohydraterich gonadtropin to inhibit rapid ovarian grow th in land locked atlantic salmon[J].Gen Comp Endocrinal,1984,55:260-268.
[23] Lambert Y,Dutil J D.Can simple condition indices be used to monitor and quantify seasonal changes in the energy reserves of A tlantic cod(Gadusmorhus)[J].Can J Fish Aquat Sci,1997,54:104-112.
[24] 朱成德.大银鱼肝指数及其与卵巢发育的关系[J].淡水渔业,1984,5:19-21.
[25] 宋海霞.养殖牙鲆垂体-性腺轴的生理功能及其调控研究:[D].青岛:中国海洋大学,2005.
[26] 叶泽雄,叶林,王正印,等.高背鲫性腺与肝脏发育关系试验[J].水产科技,2003,4:25-26.
[27] Schwalme K,Chouinard G A.Seasonal dynamics in feeding,organ weights,and reproductivematuration of A tlantic cod(Gadus morhua)in the southern Gulf of St.Law rence[J].ICES J Mar Sci.1999,56:303-319.
[28] Hansen T,Karlsen“,Taranger GL,et al.Grow th,gonadal development and spaw ning time of A tlantic cod(Gadus morhua)reared under different photoperiods[J].Aquaculture,2001,203:51-67.
[29] Kjesbu O S,Klungs yr J,Kryvi H,et al.Fecundity,atresia,and egg sizeof captive A tlantic cod(Gadusmorhua)in relation to p roximate body composition[J].Can J Fish Aquat Sci,1991,48:2333-2343.
[30] Roy Dahle,Geir L,Taranger,et al.Gonadal development and associated changes in liver size and sexual steroids during the reproductive cycle of captive male and female Atlantic cod(Gadus morhua L.)[J].Comp Biochem Physiol A,2003,136(3):641-653.
[31] 温海深,林浩然.环境因子对硬骨鱼类性腺发育成熟及其排卵和产卵的调控[J].应用生态学报,2001,12(1):151-155.
The Annual Change of Ovarian Development in Female Sebastes schlegeli
SH IDan,WEN Hai-Shen,YANG Yan-Ping
(The Key Labo ratory of Mariculture,M inistry of Education,Ocean University of China,Qingdao 266003,China)
This paper revealed the annual changes of the ovary stage fo r development and developmental phase of oocytes by means of microscope observation of ovarian olefin slice,aswell as the relationship among gonadosomatic index,hepatosomatic index and condition facto r of female ovoviviparous Sebastes schlegeli.According to themorphological and histological features,the ovarian development could be divided into seven stages and the grow th of oocytes could be divided into six phases.The ovary was in stageⅢin w inter,gravid in May,and developed into stageⅡfrom middle July,then rested on the stageⅡuntil Novem ber.The average gonadosomatic index of female Sebastesschlegeli during a year w as betw een 0.33 and 19.82,the hepatosomatic index w as between 0.33 and 3.10,and the condition factor was between 2.51 and 3.20.The relationship between gonadosomatic index and hepatosomatic index was basically positive correlation before parturition,and then hepatosomatic index dropped significantly.The results of this paper indicate that this fish spaw n only once a year.
Sebastes sch legeli;ovary;development;histology
S945.4;S955.486
A
1672-5174(2011)09-025-06
山东省自然科学基金重点课题(Z2008D03)资助
2010-04-16;
2010-09-13
史 丹(1985-),女,硕士生,研究方向:鱼类繁殖生理。E-mail:double_sd0713@hotmail.com
**通讯作者:E-mail:wenhaishen@ouc.edu.cn
责任编辑 王 莉
