仔猪水肿病大肠杆菌的分离鉴定及其毒力基因的检测
2011-01-06张少峰
张少峰,候 博,王 东,周 霞
(石河子大学动物科技学院,石河子832003)
仔猪水肿病大肠杆菌的分离鉴定及其毒力基因的检测
张少峰,候 博,王 东,周 霞
(石河子大学动物科技学院,石河子832003)
为了确定新疆石河子地区部分猪场断奶仔猪发病及死亡原因,本研究以疑似仔猪水肿病的病料为研究对象,从中分离得到3株细菌,通过形态特点、培养特性、生化特性等观察确定为大肠杆菌。3株分离菌血清型均为O139,且均能使人工感染小鼠死亡。药敏实验结果表明,分离株对部分抗生素有不同程度的耐药性。PCR检测结果显示,3株菌均携带黏附素(Fed A)和类志贺毒素(SLT-2e)基因。由此可以确定可离的3株细菌是本次仔猪感染死亡的病原。
仔猪水肿病;大肠杆菌;毒力基因
仔猪水肿病是由产志贺毒素大肠杆菌(STEC)引起的断奶仔猪的一种急性传染病[1]。该病首先报道的时间是1938年,随后许多国家均有发病报道[2-3]。仔猪水肿病发病急、死亡快,而且多发于生长快、营养好、外观健康肥壮、断乳后1-2周的仔猪。具体表现为胃壁、脸部、眼睑、结膜等处皮下水肿,发病仔猪四肢麻痹,步态蹒跚,痉挛和昏迷等症状。发病率为10%~30%,但病死率高达80%~100%,给养猪业带来极大危害[4]。仔猪水肿病的发生除了与饲养管理及猪的免疫状态发生改变等有关外,某些毒力因子也发挥着关键性的作用,如类志贺氏毒素(SLT-2e)、大肠杆菌的黏附素(Fed A)[5]以及某些肠毒素(热稳定性肠毒素ST1和热不稳定性肠毒素LT1)[4]等。
笔者从新疆石河子地区部分猪场疑似仔猪水肿病的猪场病例中先后分离到3株细菌,通过形态特性、培养特性、生化特性、血清学鉴定以及动物试验等一系列方法和手段进行鉴定,同时采用PCR技术对主要毒力因子基因SLT-2e、Fed A、ST1及LT1进行检测,以期为该病的有效防制提供依据。
1 材料与方法
1.1 材料
1.1.1 病料
病料来自于2008年10-11月新疆石河子地区部分猪场疑似仔猪水肿病病例。采集部位为胃大弯水肿液、胃小弯水肿液、胃淋巴结、肠系膜病变淋巴结。
1.1.2 主要试剂
麦康凯、甲基红、维培、靛基质、枸橼酸盐等试验用培养基参照文献[6]配制。Taq DNA聚合酶、d NTP和GM-335 mar k均购于上海生工生物工程技术服务有限公司。
1.2.3 试验动物
试验小鼠由石河子大学实验动物繁殖中心提供。
1.2 方法
1.2.1 细菌的分离与鉴定
1.2.1.1 细菌的分离 无菌采取病料接种于麦康凯琼脂平板,37℃培养24 h,挑取红色中等大小光滑菌落,接种于普通肉汤增菌,再划线于麦康凯琼脂平板上,挑取单个菌落涂片、染色、镜检。
1.2.1.2 细菌培养特性观察 将分离菌接种于普通琼脂平板、麦康凯琼脂平板、巧克力琼脂、鲜血琼脂平板、普通肉汤等培养基中37℃培养,观察其生长特性。
1.2.1.3 形态结构观察 挑取单个菌落涂片进行革兰氏染色,显微镜下观察。
1.2.1.4 生化特性观察 将所分离的细菌分别接种于不同的培养基,分别进行糖发酵试验、甲基红和维培试验、吲哚试验、尿酶试验、枸橼酸盐利用试验。
1.2.2 血清型鉴定
将从疑似仔猪水肿病病例中分离得到的大肠杆菌菌株由中国兽药监察所进行大肠杆菌血清型的鉴定。
1.2.3 小鼠人工感染试验
将所分离的细菌接种于普通营养肉汤,于37℃恒温培养箱中培养18 h,计数。每株细菌腹腔注射5只小鼠(3×108CFU/mL),对照组注射等体积的无菌肉汤。注射后的小鼠隔离饲养,观察其发病及死亡情况。死亡的立即剖检,无菌采取肝脏、脾脏、心血,进行细菌分离培养。同时观察其病理变化。
1.2.4 药敏实验
按K-B纸片法操作及标准进行判定。抗生素包括卡那霉素、链霉素、庆大霉素、青霉素G、诺氟沙星、复方新诺敏、头孢氨苄、四环素药敏纸片。
1.2.5 毒力基因扩增
1.2.5.1 引物设计 根据Genbank中公布的大肠杆菌的SLT-2e、Fed A、ST1及LT1基因的碱基序列,参照文献[7]分别设计了上游引物P1和下游引物P2。引物由上海生物工程公司合成。引物序列见表1。
1.2.5.2 PCR反应体系及反应条件 PCR反应采用20μL体系,终浓度为40 mmol/L上下游引物各1.0μL,DNTP(2 mmol/L)1.0μL,10×PCR反应缓冲液1.0μL,Mg(25 mmol)1.6μL,DNA 模板1.0 μL,Taq酶2.0μL最后加双蒸水到20μL。反应条件参照文献[8]中的方法进行。离到3株菌,分别命名为SM1、SM2和SM7。显微镜下对其进行观察,分离菌为中等大小的革兰氏阴性杆菌,两端略圆,多数单个存在,也有成双或聚集成团。

表1 毒力基因的PCR扩增引物Tab.1 The primers of virulence gene amplified with PCR
2.2 培养特性
2 结果与分析
2.1 细菌的分离及形态特点
从发病猪胃大弯水肿液和胃、肠淋巴结中共分
将分离的细菌接种于普通肉汤,37℃恒温培养24 h时,肉汤均匀浑浊,可见管壁有沉淀环,管底有灰白色沉淀。在鲜血平板上培养后可见3株菌均产生明显的β溶血。在麦康凯琼脂平板上形成中等大小、圆形、表面光滑、湿润、边缘整齐的红色小菌落。在普通琼脂平板上长成圆形、表面光滑、边缘整齐、灰白色、半透明的中等大小菌落。在巧克力琼脂平板形成中等大小、圆形、表面光滑、湿润、边缘整齐的白色菌落。
2.3 三株细菌生化反应结果
通过与肠杆菌科细菌生化特点表进行对照,均符合大肠杆菌埃希菌属的生化特征(表2)。

表2 三株细菌生化反应结果Tab.2 The results biochemical characteristics of 3 isolates
2.4 血清型鉴定结果
SM1、SM2和SM7 3株大肠杆菌血清型均为O139。
2.5 药敏试验结果
3株细菌均对头孢氨苄、庆大霉素、诺氟沙星、复方新诺敏敏感;对青霉素G、链霉素耐药;其中SM2菌对卡那霉素耐药,但对四环素敏感;SM1和SM7菌对卡那霉素耐药,而对四环素中度敏感。
2.6 小鼠人工感染试验结果
腹腔注射肉汤培养物12 h后,试验组小鼠开始发病死亡,48 h后全部死亡。小鼠在死亡前四肢呈游泳状,并伴发有共济失调的神经症状。
剖检死亡小鼠可见肝脏、脾脏、肾脏表面有明显的出血点,胃大弯和小肠有明显的水肿,并有胶冻样物质,尤其在十二指肠和回肠段比较明显(图1)。
无菌采取心血、肝脏、脾脏、肾脏分别接种于无菌肉汤,培养18 h后涂片、镜检,可以看到革兰氏阴性杆菌,通过生化鉴定后确定为被接种大肠杆菌,对照组小鼠未见异常。

图2 Fed A基因PCR扩增结果Fig.2 PCR Products of Fed A gene
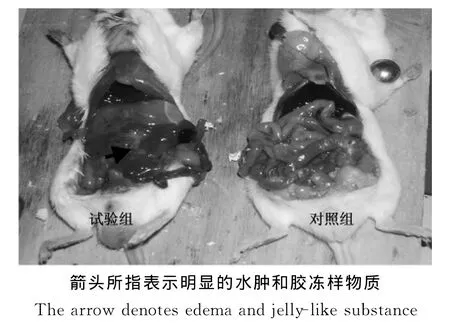
图1 人工感染小鼠部分眼观病理变化Fig.1 Some pathological changes in infected mice
2.7 毒力因子扩增
将PCR扩增产物于0.8%的琼脂糖凝胶进行电泳分析,结果(图2、图3和表3)显示:在SM1、SM2、SM7株菌中均扩增出了与Fed A预计大小一致的510 bp的片段;3株细菌也扩增到与SLT-2e预计大小基本一致的230 bp片段;3株菌均未扩增出LT1和ST1基因。
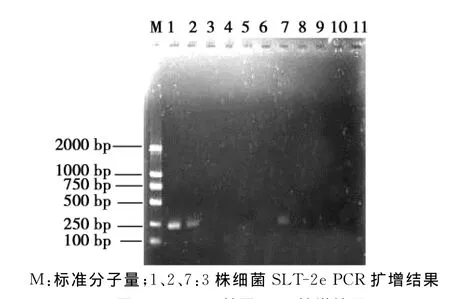
图3 SLT-2e基因PCR扩增结果Fig.3 PCR Products of Fed A gene

表3 毒力基因扩增结果Tab.3 The results of virulence genes amplified
3 讨论
3.1 大肠杆菌埃希菌属是革兰氏阴性杆菌
存在人和动物肠道内的菌群多为正常菌群,但少数具有致病性特殊血清型的菌群,会给养殖业带来了较大损失。有研究表明致仔猪水肿病主要的血清型有 O139、O138、O141、O45、O8[9]。这次所分离的细菌属于O1393株细菌血清型均为O139,与Oanh等[3]等报道的46株菌中有21株为血清O139的结果一致。分离的菌株出现了β溶血现象,同时小鼠人工感染后全部死亡,均符合致病性大肠杆菌的特性。
研究表明,母源抗体下降,饲料中的蛋白质含量过高,粗纤维不足,饲料成分急剧改变,过饱、缺硒、气候改变及个体易感性等均与此病有关。同时人们发现SLT-2e是引起水肿病发生的关键物质。因此还有人利用SLT-2e B亚基决定特异性的特点制备单克隆抗体,开展了猪水肿病特异性诊断方法的研究[10]。而F18菌毛有助于大肠杆菌粘附在肠上皮细胞上。F18菌毛主要亚单位Fed A编码170个氨基酸,可黏附于小肠粘膜上皮细胞,实现细菌在小肠的定居[11]。SLT-2e是一种血管毒素,可改变血管的通透性,导致水肿病的发生[5,12]。由本实验结果看出,分离得到的3株致仔猪水肿病的大肠杆菌可导致全部试验小鼠死亡,且小鼠胃大弯和小肠出现明显的水肿,尤其在十二指肠和回肠水肿明显。毒力因子基因检测结果表明,该大肠杆菌携带有SLT-2e和粘附性菌毛基因Fed A,而LT 1、ST1均为阴性。因此,此次分离鉴定的结果显示,石河子地区流行菌株致猪水肿病的主要致病因子为SLT-2e及F18,O139为优势血清型。这与文献[7]的报道相似。
3.2 致病性的大肠杆菌具有天然耐药性和获得性耐药性的特性
大肠杆菌的耐药性已成为兽医临床治疗大肠杆菌病最为棘手的问题之一[13]。从本次药敏试验结果可以看出,分离株对部分抗生素有不同程度的耐药性,且具有多重耐药的特点。因而,规模化猪场应该建立细菌耐药性检测制度,根据药敏的动态变化情况随时选择高敏药物进行治疗,采用联合用药、交叉用药等方法尽可能避免新的耐药菌株的产生。由于仔猪水肿病病程短,死亡迅速,往往同窝生长快且膘情好的仔猪在尚未出现任何症状时会突然死亡,这给该病的治疗带来了极大困难。因此,除了加强饲养管理,应更加重视疫苗的免疫预防在仔猪水肿病中的作用。由于大肠杆菌有众多血清型,建议各猪场应该根据其自身大肠杆菌的流行情况和主要血清型制备疫苗,才能有效控制水肿病的发生。
[1]Qadri S M,Yali S.Terohemorr hagic Escherichia coli,a dangerous food-borne pathogen[J].Pastgrad Med,1998,103(2):179-180,185-187.
[2]Ryoko U,Asuo S,Iki N,et al.Anti mier obia susceptibi of Echerichia coli isolatesfro m with toxin-pr oducing pigs Shiga edemadiseasein in Japan[J].Mic mbiol Immunol,2003,47:57-61.
[3]Oanh T K,Nguyen V K,Do T N,et al.Escherichia coli strains causing edema disease in northern Vietnam share an identical verotoxin 2e[J].Tr op Anim Health Prod,2010,42(8):1797-1804.
[4]刘国平,胡利群,金升藻,等.猪水肿病研究进展[J].养殖与饲料,2010(4):31-33.
[5]周宏超,索占伟,范光丽,等.苓酸对SLT-Ⅱe诱导的大鼠肠黏膜微血管内皮细胞分泌P-选凝素、si CAM-1及TNF-α的影响[J].中国兽医学报,2009,29(5):628-633.
[6]廖延雄.兽医微生物实验诊断手册[M].北京:中国农业大学出版社,1995:80-114.
[7]刘国平,武斌,刘梦元,等.致仔猪水肿病大肠杆菌的分离、鉴定及生物学特性[J].中国兽医学报,2005,25(1):31-33.
[8]Wood war d J,Carroll P J,Wray C.Detect ion of entero and verocyto-toxin genes in Escherichia colifrom diarrhoeal disease inanimals using the polymerase chain reaction[J].Vet Microbiol,1992,31:251-261.
[9]曹永国,刘育华,蔺涛,等.仔猪水肿病病原菌的分离鉴定[J].中国畜牧兽医,2008,5(11):111-114.
[10]丁琳,师东方,付海兵,等.贺样毒素Ⅱ型变异体B亚基单克隆抗体的制备[J].中国预防兽医学报,2009,31(3):222-225.
[11]Smeds A,Pertovaara M,Timonen T,et al.Mapping the binding do main of the F18 fimbrial adhesin[J].Infect Immun,2003,71(4):2163-2172.
[12]Macleod D L,Gyles C L,Wilcock B P.Repr oduction of edema disease of swine with purified shiga-like toxin-II variant[J].Vet Pathol,1991,28:6-73.
[13]赵静,杨汉春.规模化猪场大肠杆菌耐药性检测[J].中国兽医杂志,1998,24(11):12-13.
Identification of Escherichia coli Inducing Edema Disease of Pig and Detection of Virulence Genes
ZHANG Shaofeng,HOU Bo,WANG Dong,ZHOU Xia
(College of Animal Science and Technology,Shihezi University,Shihezi 832003,China)
Three bacteria were isolated fro m edema disease in piglets in so me far ms fr om Shihezi,Xinjiang.Those isolates were comfirmerd to be E.coli through morphological characteristic,culture characteristic,biochemical characteristic.They were serotype O139 and caused the death of mice in artificial experiment.The results of drug sensitivity test indicated that the 3 isolates had resistance to some antibiotic in varying degrees.The 3 isolates had virulence genes of Fed A and SLT-2e with PCR.The 3 isolates were pathogen inducing edema disease of piglets.
edema disease of swine;Escherichia coli.;virulence gene
S858.315.1
A
1007-7383(2011)05-0579-04
2011-01-29
人力资源和社会保障部留学回国人员科技活动项目(2010LX007)
张少峰(1986-),男,本科生,兽医专业。
周霞(1968-),女,副教授,从事兽医微生物与免疫学的研究;email:zhouxia0993@yahoo.com.cn。
