响应面法优化γ-聚谷氨酸发酵条件
2011-01-06刘青芝苏移山朱希强郭学平
刘青芝,李 霞,苏移山,朱希强,郭学平,
(1.山东大学药学院,山东 济南 250012;2.山东省生物药物研究院,山东 济南 250101)
响应面法优化γ-聚谷氨酸发酵条件
刘青芝1,李 霞2,苏移山2,朱希强2,郭学平1,2
(1.山东大学药学院,山东 济南 250012;2.山东省生物药物研究院,山东 济南 250101)
目的 优化菌株Bacillus subtilis S18产γ-聚谷氨酸(γ-PGA)的发酵条件,提高发酵水平。方法 用Plackett-Burman(PB)设计对影响γ-PGA发酵的8个因素进行效应评价,最陡爬坡法选取逼近最佳响应面区域的发酵条件,通过中心组合实验法及响应面分析,确定最优发酵条件,并验证实验模型。结果 PB设计筛选出3个对γ-PGA发酵有显著影响的因素:谷氨酸钠、酵母粉和MgSO4,用最陡爬坡法确定中心水平后,中心组合实验法分析出其最佳浓度分别为谷氨酸钠76.92 g/L、酵母粉27.20 g/L、MgSO40.26 g/L,优化后 γ-PGA 水平提高到 56.9 g/L。结论 在优化培养条件下,γ-PGA的水平比优化前提高了93.5%。
γ-聚谷氨酸;发酵;Plackett-Burman设计;响应面分析;Bacillus subtilis S18
γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)是由谷氨酸通过γ-酰胺键结合形成的聚氨基酸。γ-PGA溶于水,可食用,可降解,对人体和环境无毒性,是一种很有潜力的阴离子聚合物,在医药、食品、化妆品、环保、农业等领域均有广泛的应用前景[1-3]。γ-PGA于1937年在细菌荚膜中被发现,自然界中可以由芽孢杆属细菌合成,生产菌株主要有枯草芽孢杆菌[4-5]、地衣芽孢杆菌[1]、炭疽芽孢杆菌[6]等。
目前,日本等国家已经采用发酵法实现γ-PGA的工业化生产,发酵水平在25~50 g/L之间[7]。由于γ-PGA发酵液黏度较高,严重影响发酵液的溶氧水平,进而影响菌株的生长及γ-PGA水平的进一步提高,因此,如何提高菌株的摄氧能力是目前亟待解决的主要问题。
透明颤菌血红蛋白(Vitreoscilla hemoglobin,VHb)是一种原核生物的血红蛋白,它能够从分子水平上提高菌体自身对溶氧的利用能力,使之适应较低的溶氧水平,从而促进菌体的生长和一些代谢产物的合成[8]。本实验室从豆制品中筛选1株能够生产γ-PGA的菌株Bacillus subtilis 18-3,然后将VHb的基因整合到该菌株的基因组中,得到能够表达VHb的菌株Bacillus subtilis S18,提高了该菌株的摄氧能力。本研究采用响应面法对工程菌株Bacillus subtilis S18产γ-PGA的发酵培养条件进行了优化,以期进一步提高发酵水平。
1 材料
Bacillus Subtilis S18菌株,山东省生物药物研究院保藏。γ-PGA对照品(含量≥99%,HPLC面积归一法测定),山东省生物药物研究院提供;其他试剂均为国产或进口分析纯。
固体培养基:葡萄糖10 g/L,酵母粉5 g/L,谷氨酸钠5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.1 g/L,琼脂20 g/L。
种子培养基:葡萄糖20 g/L,酵母粉5 g/L,谷氨酸钠 10 g/L,K2HPO4·3H2O 2 g/L,MgSO4·7H2O 0.25 g/L,pH 7.0。
发酵培养基:蔗糖50 g/L,酵母粉20 g/L,谷氨酸钠 60 g/L,K2HPO4·3H2O 2 g/L,MgSO4·7H2O 0.25 g/L,NaCl 5 g/L,pH 7.5。
HZQ-Q型恒温培养箱,中国哈尔滨东联电子技术开发有限公司;Waters 600E型高效液相色谱仪,美国Waters公司。
2 方法
2.1 培养条件
挑取斜面培养的Bacillus subtilis S18至装有一级种子培养基25 mL的100 mL锥形瓶中,37℃,200 r/min,振荡培养8 h。从一级种子培养基中取2.5 mL接入到装有二级种子培养基50 mL的250 mL锥形瓶中,37 ℃,200 r/min振荡培养8 h,再从二级种子培养基中取2.5 mL接入到装有发酵培养基50 mL的250 mL锥形瓶中,37℃,200 r/min振荡培养72 h。
2.2 发酵液中γ-PGA浓度测定
2.2.1 色谱条件 用凝胶色谱法测定γ-PGA浓度。色谱柱:Waters Ulttrahydrogel 1000色谱柱(7.8 mm×300 mm);柱温:35℃;检测波长:220 nm;流动相:10 mmol/L Na2HPO4和15 mmol/L KH2PO4混合缓冲液;流速:1.0 mL/min;进样量:20 μL。
2.2.2 样品测定 取发酵液2 mL,加水稀释50倍,12 000 r/min离心10 min,取上清液分析。用外标法以峰面积定量,γ-PGA对照品的浓度为1 g/L。
2.3 培养基的优化设计
2.3.1 Plackett-Burman(PB)设计 根据前期实验结果,本实验采用n=12的PB设计,选取发酵条件的8个主要影响因素(A:谷氨酸钠的浓度,B:酵母粉的浓度,C:蔗糖的浓度,D:K2HPO4的浓度,E:MgSO4的浓度,F:NaCl的浓度,G:培养液的初始pH,H:接种量)进行考察,每个因素分别取高低2个水平(-1,1),并余 3 个空项(J,K,L)作误差分析,用Design expert 7.0软件进行实验设计(见表1),根据所得结果分析各因素对γ-PGA水平的效应,并进行显著性(P<0.05)评价,从而获得对γ-PGA水平有显著影响的因素。
2.3.2 最陡爬坡实验设计 由于响应面拟合方程旨在反映紧接最大值的邻域的近似真实情形,因此,利用最陡爬坡法尽可能逼近最大产γ-PGA区域后,才能建立有效的响应面拟合方程。最陡爬坡法的爬坡方向和变化步长由PB实验结果得到的各变量系数决定,如果系数为负,则该因素水平应为递减,反之递增,找出峰值,从而快速的接近最大响应区域。
2.3.3 中心组合设计和响应面分析 根据相应的实验表进行实验后,对数据进行二次回归拟合,得到二次方程,分析各因素的主效应和交互效应,最后在一定的水平范围内求出最佳值,即最大产γ-PGA量对应的发酵条件。3 结果与讨论
3.1 PB设计实验结果及分析
PB设计的实验结果见表1。对结果进行方差分析,结果见表2。从各变量的系数可看出谷氨酸钠浓度、酵母粉浓度、蔗糖浓度及接种量对γ-PGA水平显示正效应,K2HPO4、MgSO4、NaCl的浓度和培养液的初始pH均显示负效应。PB设计结果的方差分析表明酵母粉、谷氨酸钠和MgSO4的浓度的效应最大,且在置信区间95%之中,是影响γ-PGA水平的显著因素。所以将酵母粉、谷氨酸钠和MgSO4的浓度进一步采用响应面法进行优化,以确定最佳发酵条件。
3.2 最陡爬坡法的实验结果
由PB实验结果可知,谷氨酸钠和酵母粉浓度对γ-PGA水平有正效应、MgSO4浓度有负效应,要提高γ-PGA水平应适当提高培养基中谷氨酸钠和酵母粉浓度,降低MgSO4浓度,其他因素影响不显著,维持在中等水平。最陡爬坡实验(见表3)选取谷氨酸钠、酵母粉、MgSO4浓度的变化幅度依次为8,1.5,0.04 g/L,进行优化实验,选取逼近产 γ-PGA的最大区域的组合。结果显示3号实验条件下γ-PGA水平达到44.8 g/L,γ-PGA水平随浓度变化均有下降,因此选取3号实验组合作为中心组合实验的中心点。
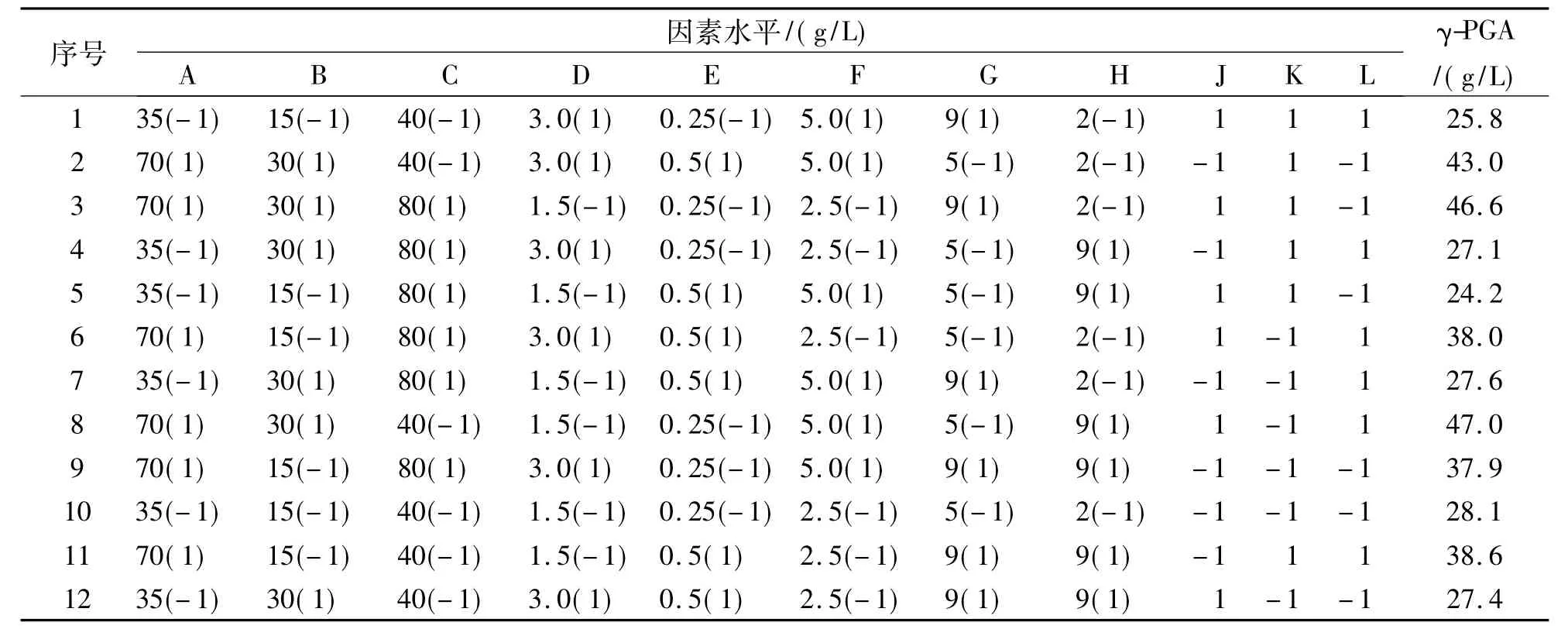
表1 Plackett-Burman实验设计及结果Tab.1 The design and result of Plackett-Burman experiments
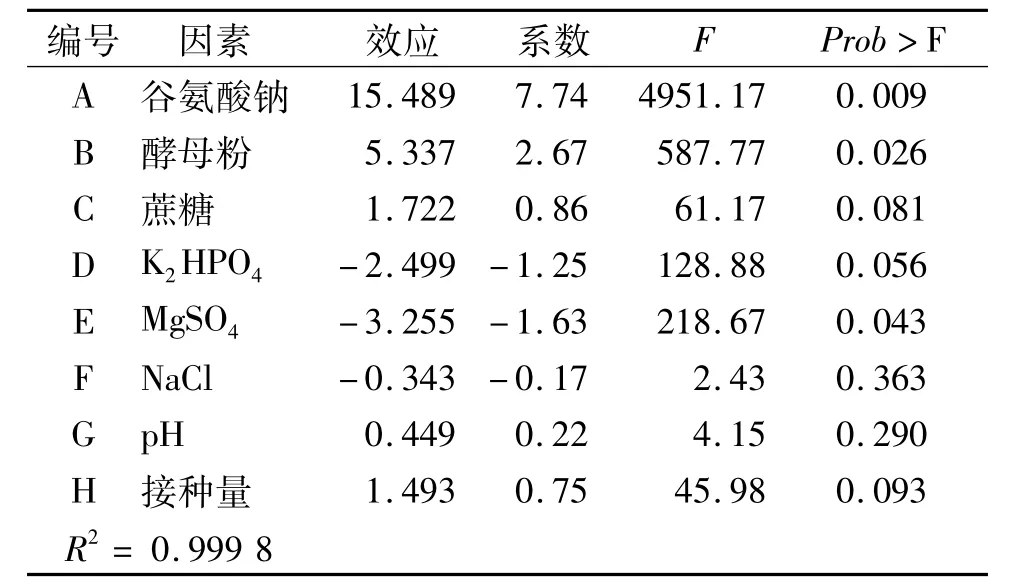
表2 Plackett-Burman实验结果的方差分析Tab.2 The analysis of variance of Plackett-Burman experimental results
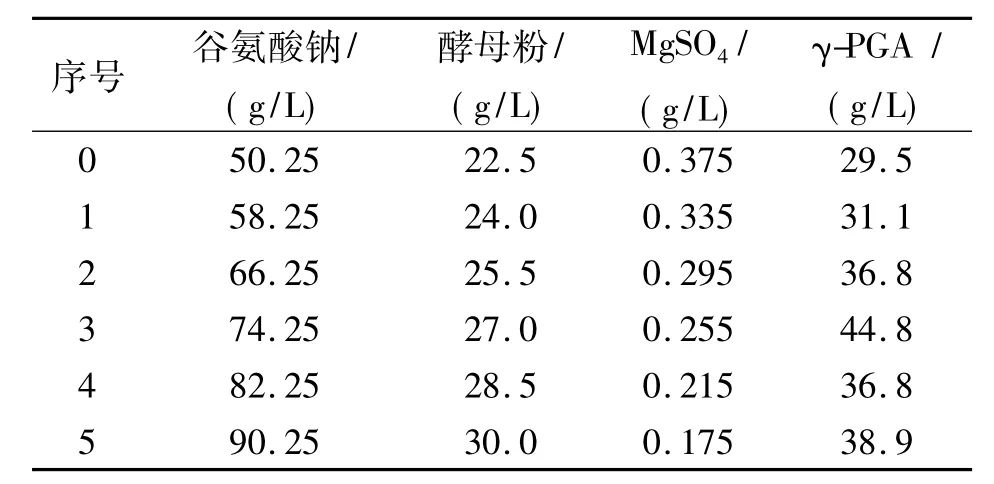
表3 最陡爬坡实验设计及结果Tab.3 Design and results of the path of steepest ascent experiment
3.3 中心组合实验设计及结果
根据PB实验确定的因素,以及最陡爬坡实验得到的中心点,本实验用Design expert 7.0软件中的中心组合设计法设计3因素(X1-谷氨酸钠、X2-酵母粉、X3-MgSO4)的中心组合实验,以γ-PGA的水平为响应值,取 5 种水平,以(-1.68,-1,0,1,1.68)编码,选择中心点实验重复实验数为6,设计20组实验(见表4),实验重复3次。
由Design expert 7.0软件对实验结果(见表4)进行回归分析,拟合出一个二次方程:

表4 中心组合实验的设计及结果Tab.4 The design and result of center composite experiments
对模型进行方差分析,结果见表5,模型在置信区间99%之中,置信度为99.99%,回归方程显著,说明此方程有较好的拟合度,方程与实际情况比较相符,并能作出相对准确的预测。如果P<0.05,则说明模型中项的影响是显著的。在这个模型中,X1、X1X3、系数的置信度均在95%水平以上,说明它们都为模型的显著项。
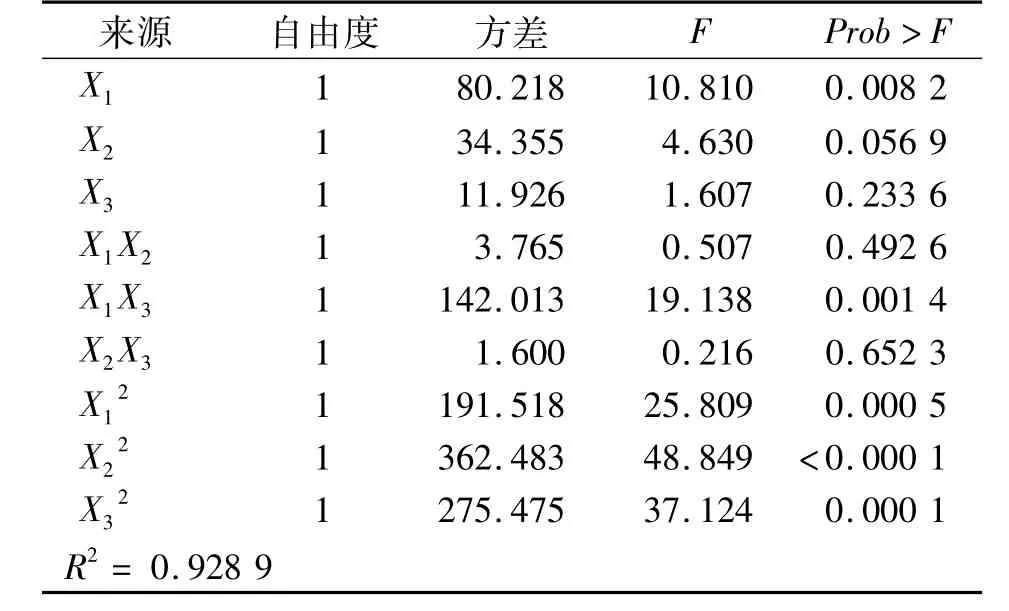
表5 中心组合实验结果的方差分析Tab.5 The analysis of variance of central composite experimental results
分别以谷氨酸钠和酵母粉浓度(图1A)、谷氨酸钠和MgSO4浓度(图1B)、酵母粉和MgSO4浓度(图1C)作为平面坐标,γ-PGA的水平作为响应值,绘制了三维响应面和等高线图,可看出从图中均可找到一个γ-PGA水平的最大值。通过拟合方程分别对各自变量求偏导数,并令各偏导数为0,可得一个二元一次方程组,求解得到最大产γ-PGA量对应的最优化条件为酵母粉 27.20 g/L、谷氨酸钠76.92 g/L、MgSO40.26 g/L,预测 γ-PGA 的水平最大值为56.4 g/L。
为了验证预测值,按上述最佳发酵条件:谷氨酸钠 76.92 g/L、酵母粉 27.20 g/L、MgSO40.26 g/L、蔗糖50 g/L、K2HPO4·3H2O 2 g/L、NaCl 5 g/L、接种量5%、pH 7,做3次重复实验,得到γ-PGA水平的最大值为56.9 g/L,基本与响应面预测的最大γ-PGA水平符合,说明响应面法优化得到的数学模型与实验数据拟合的较好。在初始发酵培养条件,γ-PGA的水平为29.4 g/L,响应面法优化后γ-PGA的水平提高到56.9 g/L,增加了93.5%。
本文通过PB设计法和响应面分析法,用较少的试验对Bacillus subtilis S18的发酵培养条件进行了优化。结果表明,谷氨酸钠、酵母粉和MgSO4为影响γ-PGA发酵水平的重要影响因子。

图1 γ-PGA水平为响应值的曲面和等高线图Fig.1 Response surface and contour plots for the effects on the yield ofγ-PGA
[1]Shih I L,Van Y T,Sau Y Y.Antifreeze activities of poly(γ-glutamic acid)produced by Bacillus licheniformis[J].Biotechnol Lett,2003,25(20):1709-1712.
[2]Mark SS,Crusberg T C,Dacunha C M,et al.Chelation of vanadium(Ⅳ)by a natural and edible biopolymer poly(γ-glutamic acid)in aqueous solution:structure and binding constant of complex[J].Macromol Biosci,2007,8(2):171-176.
[3]Masao Kunioka.Biodegradable water absorbent synthesized from bacterial poly(amino acid)s[J].Macromol Biosci,2004,15(4):324-329.
[4]Kubota H,Matsunobu T,Uotani K,et al.Production of poly(gamma-glutamic acid)by Bacillus subtilis F-2-01[J].Biosci Biotechnol Biochem,1993,57(7):1212-1213.
[5]Ogawa Y,Yamaguchi F,Yuasa K,et al.Efficient production ofγpolyglutamic acid by Bacillus subtilis(natto)in jar fermenters[J].Biosci Biotechnol Biochem,1997,61(10):1684-1687.
[6]Bruckner V,Kovaca J,Denes G.Structure of poly-d-glutamic acid isolated from capsulated strains of Bacillus anthracis[J].Nature,1953,172(4376):508.
[7]Kubota H,Matsunobo T,Uotani K,et al.Production of poly(γglutamic acid)by Bacillus subtilis F-2-01[J].Biosci Biotechnol Biochem,1993,57(7):1212-1213.
[8]Zhang L,Li Y J,Wang Z N,et al.Recent developments and future prospects of Vitreoscilla hemoglobin application in metabolic engineering[J].Biotechnol Adv,2007,25(2):123-136.
Response surface analysis ofγ-polyglutamic acid fermentation conditions
LIU Qing-zhi1,LI Xia2,SU Yi-shan2,ZHU Xi-qiang2,GUO Xue-ping1,2
(1.School of Pharmaceutical Science,Shandong University,Jinan 250012,China;2.Institute of Biopharmaceuticals of Shandong Province,Jinan 250101,China)
Purpose To improve the fermentation yield ofγ-polyglutamic acid(γ-PGA)by optimizing the fermentation conditions of Bacillus subtilis S18.Methods A Plackett-Burman design was used to evaluate the effects of eight variables on the production ofγ-PGA.The method of steepest ascent(descent)was used to approach the optimal response surface experimental area.The optimal conditions for fermentation were obtained by central composite design and response surface analysis.Finally,the experimental results were verified.Results It was indicated that glutamic sodium,yeast powder and MgSO4had significant influences on the production ofγ-PGA by Plackett-Burman design.After the level of center was determined by the method of steepest ascent(descent),the optimal concentrations of glutamic sodium,yeast powder and MgSO4could be obtained by central composite design and they were 76.92 g/L,27.20 g/L and 0.26 g/L,respectively.The fermentation yield of γ-PGA could be up to 56.9 g/L.Conclusion The γ-PGA production in the optimized medium can be increased by 93.5%than before.
γ-polyglutamic acid;fermentation;Plackett-Burman design;response surface analysis;Bacillus subtilis S18
TQ464.7
A
1005-1678(2011)02-0099-04
2009-12-28
刘青芝,女,硕士研究生,主要从事生物制药工艺研究;郭学平,男,通信作者,研究员,Tel:0531-82685555,E-mail:guo-xp@139.com。