鲈鱼对组氨酸需求量的研究*
2011-01-05艾庆辉麦康森何志刚程镇燕
李 燕,艾庆辉,麦康森,何志刚,程镇燕
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
鲈鱼对组氨酸需求量的研究*
李 燕,艾庆辉**,麦康森,何志刚,程镇燕
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
鲈鱼的生长受饲料中组氨酸(His)的含量变化显著(P<0.05)。当饲料中组氨酸含量过低或过高时,鲈鱼的终末体质量和特定生长率显著低于其它处理组,而处理组2(组氨酸含量为0.45%)、处理组3(组氨酸含量为0.57%)和处理组4(组氨酸含量为0.66%)之间差异不显著。终末体重、特定生长率和饲料效率在处理组3(组氨酸含量为0.57%)达到最大值,分别为21.0 g,1.72%d-1和0.81。以上结果表明,His是鲈鱼生长的必需氨基酸之一,且鲈鱼能有效利用晶体His。根据饲料中组氨酸的含量与鲈鱼特定生长的关系,经计算求得鲈鱼饲料中组氨酸含量为0.54%饲料干物质(即1.29%蛋白)时,鲈鱼的生长达到最佳状态。
鲈鱼;组氨酸;需求量;摄食和生长
组氨酸(histidine)化学名为N-乙酰-L-色氨酸,组氨酸属于碱性氨基酸,主要作用于代谢的调节。对人体来说,组氨酸可由普通的中间代谢产物合成,一直被认为是非必需氨基酸,但随着研究的深入,发现幼龄动物和婴儿体内的组氨酸合成量不能满足机体生长需要,即使是成年动物,若不从食物中补充,体内合成的也不能满足需要,所以对人体来说为半必需氨基酸。但对鱼类、鼠而言,组氨酸为必需氨基酸。目前对鱼类组氨酸的需求量研究相对较少。不同的学者采用不同的研究方法,依据不同的评价指标得出的值也不同。例如:当以生长和蛋白排泄为评价指标分别确定鲤鱼对组氨酸的需求量是2.1%蛋白和1.4%蛋白[1-2]。Rollin[3]采用理想蛋白的方法测出大西洋鲑对组氨酸的需求量为1.2%蛋白,Nose[1]和Borlongan和Coloso[4]以生长为评价指标确定日本鳗鲡和遮目鱼对组氨酸的需求量则分别为2.1%蛋白和2.0%蛋白。这可能是由于不同种类的实验鱼以及所采取的评价指标的不同而导致结果的差异性。总之,以生长、理想蛋白、A/E的值和蛋白排泄为指标测定不同鱼类对组氨酸的需求量为0.9%~2.1%蛋白[5]。
目前有关鲈鱼赖氨酸、蛋氨酸、精氨酸的定量需求已经完成[6-7]。但鲈鱼对饲料中组氨酸的需求量尚未研究过,因此本实验在以往的研究基础上,进一步探讨鲈鱼对饲料中组氨酸(His)的定量需求,以期完善鲈鱼对10种必需氨基酸需求量的数据库,并为鲈鱼高效环保饲料的开发和利用提供理论依据。
1 材料和方法
1.1 实验鱼来源及驯化
实验鱼选用当年人工孵化的同一批鱼苗,体长约10 cm,体质量8.3 g左右。正式实验前,实验鱼以对照组饲料饱食投喂。经10 d的驯养后,挑选出体格健壮、规格一致的鲈鱼幼鱼进行分组实验。
1.2 实验饲料
以鱼粉、玉米蛋白和明胶为主要蛋白源,鱼油及大豆油为脂肪源,并补充矿物质、维生素配制出基础饲料。以鲈鱼鱼体氨基酸含量为需要量参考标准,添加相对应的晶体氨基酸,使基础料中除组氨酸以外的其它各种氨基含量达到在鲈鱼鱼体中的含量(见表1)。基础饲料中的蛋白质、脂肪含量分别约为43%和13%,组氨酸的含量为0.42%。分别在基础饲料中添加0.0%、0.1%、0.2%、0.3%、0.4%和0.5%的晶体L-His,以等量谷氨酸作为L-His的等氮替代物,配制出6种等氮等能(蛋白含量为43%,能量为20 kJ g-1)的实验饲料(见表2)。最终饲料中设计组氨酸梯度包括鲈鱼全鱼的组氨酸含量(0.55%)。在饲料制作过程中,所有原料经粉碎过筛(220μm)后按配比定量均匀混合,p H值用6N NaOH调成中性,然后加入适量的水揉匀,用F(II)-26双螺杆制粒机(华南理工大学,广州)加工制成硬颗粒饲料(1.5 mm×3.0 mm和2.5 mm×5.0 mm),60℃烘干至饲料水分含量为10%左右,保存于-15℃冰柜中备用。另外,每种饲料中分别取定量的样品,保存于-20℃下待测。

表1 鲈鱼对组氨酸需求的饲料中氨基酸组成(%干物质)Table 1 Amino acids composition of the experimental diets(%dry matter)
1.3 饲养管理
生长实验在浮式海水网箱中进行。实验开始之前,停止投喂24 h,然后以丁香酚(1∶10000,上海试剂厂,中国上海)对鲈鱼进行麻醉后称量(精确至0.1 g)。从中挑选出体格健壮,体质量相近(8.0 g±0.20 g)的鲈鱼作为实验对象。每个网箱(1.5 m×1.5 m×2.0 m)放养30尾实验鱼,每种饲料设立3个重复。
实验为期8周,每天投喂2次(05:00和16:30)达饱足水平。第1至4周投喂(1.5 mm×3.0 mm)规格饲料,之后投喂2.5 mm×5.0 mm规格饲料至养殖实验结束。投喂时如有死鱼记录数量并称质量。实验期间水温为26.0~32.0℃,盐度为26~30,溶氧维持在7 mg.L-1左右。生长实验结束后,对实验鱼停食24 h,然后进行计数并称质量。
1.4 实验样品制备
从每个养殖桶随机取5尾鱼,保存于-20℃冰箱,用于常规生化分析等。
1.5 样品分析测定方法
1.5.1 饲料原料、饲料氨基酸测定 氨基酸分析采用氨基酸自动分析仪测定(Biochrom Ltd?,England)。样品采集后用粉碎机粉碎于冰箱中冷冻保存。准确称取一定量样品,精确到0.000 1 g,将称好的样品放于水解管中,加入6 mol.L-1盐酸15 mL,充入高纯氮气;重复3次后,在充氮气状态下封口或拧紧螺丝盖将已封口的水解管放在(110±1)℃的恒温干燥箱内,水解22 h后,取出冷却。打开水解管,将水解液过滤后,用去离子水多次冲洗水解管,将水解液全部转移到50 mL容量瓶内,用去离子水定容。吸取滤液2 mL于5 mL容量瓶内,用干燥器在40~50℃干燥,残留物用2 mL水溶解,再干燥,反复进行2次,最后蒸干,用2 mL p H=2.2的缓冲液溶解,供仪器测定用。准确吸取0.200 mL混合氨基酸标准,用pH=2.2的缓冲液稀释到5 mL,此标准稀释浓度为5.00 nmol.50μL-1,作为上机测定用的氨基酸标准。
1.5.2 化学组成 原料、饲料以及鱼体的样品均在105℃烘干至恒重后求得干物质含量,然后进行生化测定。采用自动定氮仪(Kjeltec 2300,Sweden)测定粗蛋白含量;采用自动脂肪抽提仪(B-801,Switzerland)测定粗脂肪含量;灰分是将样品在电炉上炭化后,在550℃马福炉中灼烧12 h后测得,能量采用氧弹仪(Parr 1281,美国)测定。

表2 鲈鱼对组氨酸需要量的饲料配方(%干物质)Table 2 Composition of the test diets used for the leucine requirement of Japanese seabass(%dry matter)
1.6 计算及统计方法
以下各参数的计算公式为:
特定生长率(S GR)=[(LnWt-LnWo)/t]×100
饲料效率(FE)=(Wt-Wo)/Id
存活率=实验结束时活鱼总数/实验开始时活鱼总数×100。
其中Wt(g)为终末体质量,Wo(g)为初始体质量,t(d)为实验时间,Id(g)为摄入饲料干质量。
采用SPSS 13.0 for Windows对所得数据进行方差分析,若差异达显著,然后进行Tukey多重比较,显著性水平为P<0.05。
2 结果
2.1 饲料中组氨酸含量对鲈鱼生长的影响
鲈鱼的成活率不受饲料中组氨酸的含量的显著影响(P>0.05),但饲料中组氨酸的含量则显著影响了鲈鱼的生长(P<0.05)(见表3)。鲈鱼的终末体重和特定生长率随着饲料中组氨酸含量的升高呈现先上升后下降的趋势,当饲料中组氨酸含量为0.57%时,鲈鱼的终末体质量、特定生长率和饲料效率达到最大值,分别为18.2 g,2.18%d-1,0.88,之后,随着饲料中组氨酸含量的进一步升高,鲈鱼的生长显著下降,但在饲料中组氨酸含量为0.45%、0.57%、0.66%时,各处理组之间差异不显著(P>0.05)。根据饲料中组氨酸的含量与鲈鱼特定生长率的关系,拟合二次曲线为Y=-4.5814X2+4.9647X+0.2891(R2=0.9045)(见图1),经计算求得饲料中组氨酸含量为0.54%饲料干物质(1.29%蛋白)时,鲈鱼的生长达到最佳状态。
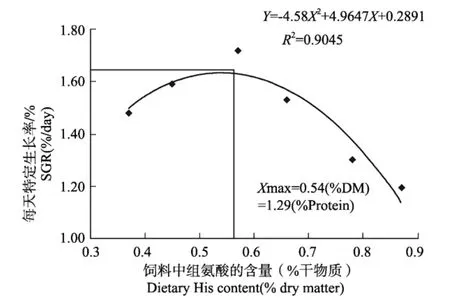
图1 饲料中组氨酸含量对鲈鱼特定生长率的影响Fig.1 Effects of dietary histidine on SGR of juvenile Japanese seabass(L ateolabrax japonicus)fed experimental diets for 8 weeks

表3 饲料中组氨酸含量对鲈鱼成活率、特殊生长率、饲料效率的影响Table 3 Effects of dietary histidine on survival,SGR,FE of juvenile Japanese seabass(L ateolabrax japonicus)fed experimental diets for 8 weeks①
2.2 饲料中组氨酸含量对鲈鱼体成分的影响
饲料中组氨酸含量对鲈鱼体成分无显著影响(见表4)。水分、蛋白、脂肪和灰分都不随饲料中组氨酸含量的不同而出现显著性差异(P>0.05),水分含量为77.0%~78.3%,蛋白含量为15.1%~15.6%(湿质量),脂肪含量为1.5%~2.7%(湿质量),灰分含量为5.3%~6.0%(湿质量)。
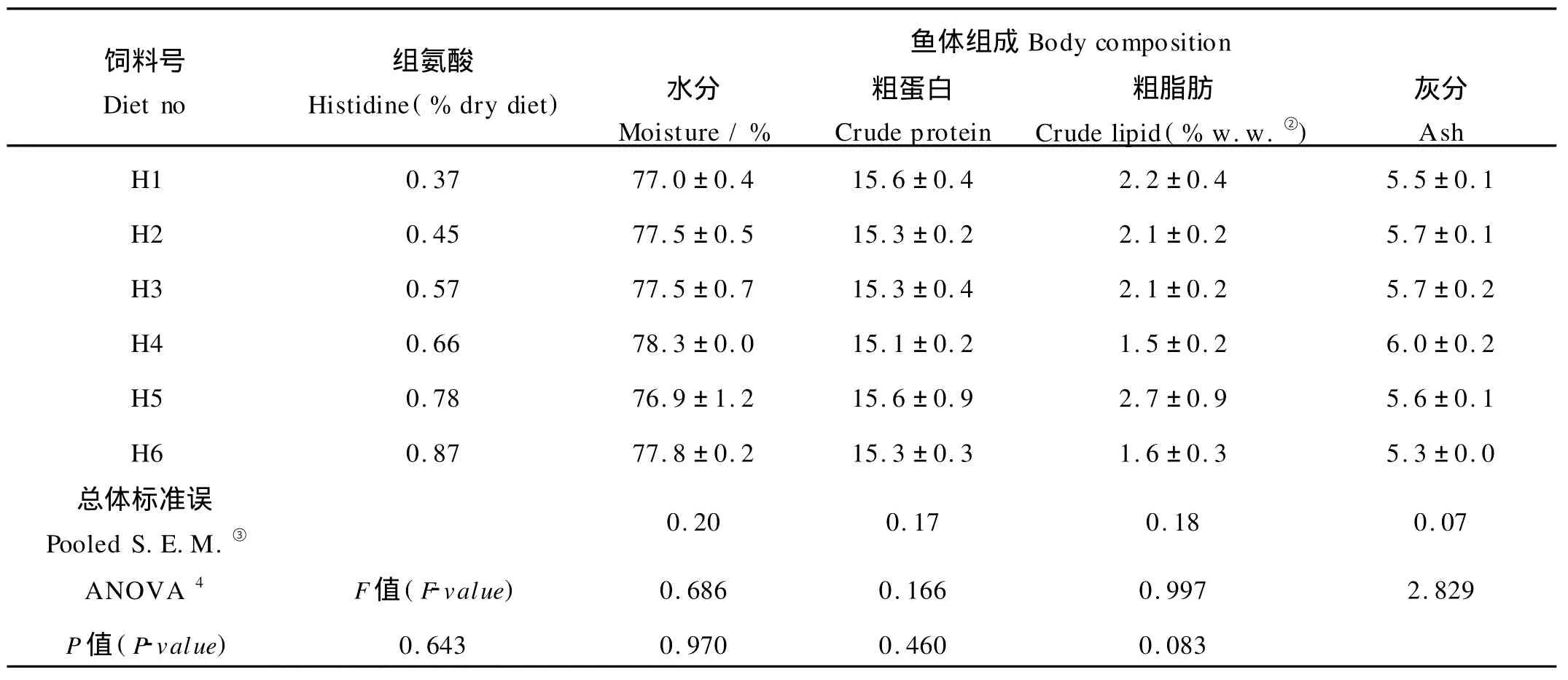
表4 氨酸含量对鲈鱼体组成的影响Table 4 Effect of dietary histidine on body composition of juvenile Japanese seabass(L ateolabrax japonicus)fed experimental diets for 8 weeks①
3 讨论
本实验以鲈鱼为研究对象,通过在基础饲料中添加不同含量的组氨酸,探讨不同组氨酸水平的饲料饲喂鲈鱼8周后对生长、成活以及体成分的影响。结果表明,鲈鱼的生长显著受到饲料中不同His添加水平的影响。基础饲料组经过8周的养殖实验,生长受到严重抑制,随着饲料中His添加的升高,鲈鱼的生长也显著提高,当添加量在0.57%时,鲈鱼的生长达到最大值,而当饲料中His的含量超过0.66%时,鲈鱼的生长显著受到抑制。这表明His为鲈鱼正常生长所必需的营养成分之一。随着饲料中晶体His水平的增加,鲈鱼的生长状态得到明显改善,这说明鲈鱼有利用晶体His的能力。但当His的含量超过鲈鱼所需的范围内,则会显著抑制鲈鱼的生长。
本研究发现,鲈鱼对饲料中组氨酸的最适需求量为1.29%蛋白。与大西洋鲑(S almon salarL.)(1.2%蛋白)[3]、鲤鱼(Cy prinus carpioL.)(1.4%蛋白)[2]、牙鲆(Paralichthys lethostigma)(1.3%蛋白)[8]、红鲷(1.4%蛋白)[8]对饲料中组氨酸的需求量相似,但低于大菱鲆(Scophthalmus maximus)(1.5%蛋白)[9]、银大马哈鱼(Oncorhynchus kisutch)(1.8%蛋白)[10]、欧洲鲈(Morone labrax)(1.6%蛋白)[9]、金头鲷(S parus auratus)(1.7%蛋白)[9]、日本鳗鲡(A nguilla japonica)(2.1%蛋白)[1]、遮目鱼(Chanos chanos)(2.0%蛋白)[11]、尼罗罗非鱼(Oreochromis nilotica)(1.7%蛋白)[12]、虹鳟(Oncorhynchus mykiss)(1.6%蛋白)[2]、美国红鱼(Sciaenops ocellatus)(1.7%蛋白)[13]对组氨酸的需求量。这主要是因为许多因素影响着鱼类对氨基酸的需求量的,如鱼的种类、饲料的组成及适口性、实验鱼的大小、投喂次数及水平、实验条件等[14-15],从而导致不同的实验结果。
将本实验鲈鱼的生长状态数据与本论文已做过鲈鱼支链氨基酸需求量实验的生长状态数据比较(未发表),在支链氨基酸需求的实验中,鲈鱼最佳特定生长率最大可达到每天2.84%。而本实验鲈鱼每天最佳特定生长率为每天1.72%。可见,本实验鲈鱼的相关生长指标均低于支链氨基酸实验的数值。这可能由试验饲料中所用原料的差异造成的。组氨酸试验饲料中利用玉米蛋白和鱼粉作为蛋白源,而亮氨酸(支链氨基酸)试验饲料中用豆粕和鱼粉作为蛋白源,豆粕一直视为替代鱼粉的良好蛋白源,其氨基酸组成模式比玉米蛋白好。另外,已有研究证实,对大多数鱼类而言,由于晶体氨基酸吸收不同步或水溶失问题,当以晶体氨基酸为主要氮源时,实验鱼的生长率低于使用完整蛋白源时的生长[16-17]。本实验中,饲料晶体氨基酸含量约为干重的19.30%,而在鲈鱼亮氨酸需求实验中,饲料中晶体氨基酸含量为干重的18.79%,这也可以部分解释为何本实验生长状态指标低于亮氨酸实验的指标。
添加晶体组氨酸对鲈鱼的生长的影响,出现先上升后下降的变化趋势,在所有研究氨基酸需求量的试验中,总结发现饲料中必需氨基酸的需求量对鱼类的生长都出现非线性变化趋势,这种非线性变化趋势大致可以分成2种,1种是随着饲料中必需氨基酸含量的升高,鱼类的生长出现先上升后平稳的变化趋势;例如:鲶鱼[18],大黄鱼[19],军曹鱼[20]等。另外一种是随着饲料中必需氨基酸含量的升高,鱼类的生长出现先上升后下降的变化趋势。例如:鲤鱼[21-22]和印度鲤[23]。因此,通过生长与饲料中必需氨基酸含量之间的非线性关系来确定鱼类对其需求量是合理并准确的。
本实验发现鲈鱼的体组分不受饲料中组氨酸含量的影响而出现显著差异性,可能鲈鱼对维持体组分的能力相对较强。另外,本实验的周期比较短,可能在短时间内补充晶体氨基酸对鲈鱼的体成分不能表现出明显的差异性,更长周期的实验有待在下一步研究。
总之,组氨酸是鲈鱼生长的必需氨基酸,在配制饲料配方中,要满足鱼类对其需求量,这样才能达到更好的生长。
致谢:感谢张文兵,王小洁,马洪明,徐玮和刘付志国的大力支持和帮助。
[1] Nose T.Summary report on the requirements of essential amino acids for carp[M].∥Halver,J.E.,Tiews,K,Eds.,Finfish Nutrition and Fishfeed Technology.Heenemann,Berlin:Federal Republic of Germany,1979:145-156.
[2] Ogino C.Requirements of carp and rainbow trout for essential amino acids[J].Bull Japanese Society Science of Fish,1980,46:171-174.
[3] Rollin X.Critical study of indisensable amino acids requirements of atlantic salmon(Salmo salarL.)fry.Ph.D.thesis[D].Loucain,Belgium:Universite catholiqure de loucain,1999.
[4] Borlongan I G,Coloso R M.Requirements of juvenile milkfish(Chanos chanosForsskal)for essential amino acids[J].Journal of Nutrition,1993,123:125-132.
[5] Halver J E,Hardy R W.Fish nutrition[M].USA:Elsevier Science(USA),2002:156-159.
[6] Mai K S,Zhang L,Ai Q H,et al.Dietary lysine requirement of juvenile Japanese seabass,L ateolabrax japonicus[J].Aquaculture,2006,258:535-542.
[7] 万军利.鲈鱼和大黄鱼必需氨基酸营养生理研究[D].青岛:中国海洋大学水产学院,2005.
[8] Forster I,Ogata H Y.Lysine requirement of juvenile Japanese flounderParalichthys oliíaceusand juvenile red sea breamPagrus major[J].Aquaculture,1998,161:131-142.
[9] Kaushik SJ.Whole body amino acid composition of European seabass(Dicentrarchus labrax),gilthead seabream(S parus aurata)and turbot(Psetta maxima)with an estimation of their IAA requirement profiles[J].Aquat.Living Resource,1998,11(5):355-358.
[10] Klein R G,Halver J E.Nutrition of salmonoid fishes:Arginine and histidine requirements of chinook and coho salmon[J].Journal of nutrition,1970,109:965.
[11] Borlongan I G,Coloso R M.Requirements of juvenile milkfish(Chanos chanos Forsskal)for essential amino acids[J].Journal of Nutrition,1993,123:125-132.
[12] Santiago C B,Lovell R T.Amino acid requirements for growth of Nile tilapia[J].Journal of Nutrition,1988,118:1540-1546.
[13] Moon H Y,Gatlin III D M.Total sulfur amino acid requirement of juvenile red drum,Sciaenops ocellatus[J].Aquaculture,1991,95:97-106.
[14] Tacon A GJ,Cowey C B.Protein and amino acid requirements[M].∥Tytler P,Calow P,eds.Fish Energetics:New Perspectives.Baltimore:The Johns Hopkins University Press,1985:155-183.
[15] Rodehutscord M,Becker A,Pack M,et al.Response of rainbow trout(Oncorhynchus mykiss)to supplements of individual essential amino acids in a semipurified diet,including an estimate of the maintenance requirement for essential amino acids[J].Journal of Nutrition,1997,126:1166-1175.
[16] Cowey C B.Amino acid requirements of fish:a critical appraisal of present values[J].Aquaculture,1994,124:1-11.
[17] Peres H,Oliva-Teles A.The effect of dietary protein replacement by crystalline amino acid on growth and nitrogen utilization of turbotScophthalmus maximusjuveniles[J].Aquaculture,2005,250:755-764.
[18] Luo Z,Liu Y J,Mai K S,et al.Dietary l-methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level[J].Aquaculture,2005,249:409-418.
[19] Mai K S,Wan J L,Ai Q H,et al.Dietary methionine requirement of large yellow croaker,Pseudosciaena croceaR[J].Aquaculture,2006,253:564-572.
[20] Zhou Q C,Wu Z H,Tan B P,et al.Optimal dietary methionine requirement for Juvenile Cobia(Rachycentron canadum)[J].Aquaculture,2006,258:551-557.
[21] Wang S,Liu YJ,Tian L X,et al.Quantitative dietary lysine requirement of juvenile grass carpCtenopharyngodon idella[J].Aquaculture,2005,249:419-429.
[22] Ahmed I,Khan M A.Dietary lysine requirement of fingerling Indian major carp,Cirrhinus mrigala(Hamilton)[J].Aquaculture,2004,235:499-511.
[23] Ahmed I,Mukhtar A K,Jafri A K.Dietary threonine requirement of fingerling indian major carp,Cirrhinus mrigala(Hamilton)[J].Aquaculture Research,2004,35:162-170.
Dietary Hstidine Requirement of Juvenile Japanese Seabass
LI Yan,AI Qing-Hui,MAI Kang-Sen,HE Zhi-Gang,CHENG Zhen-Yan
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
Dietary histidine significantly affected the growth responses of Japanes seabass(P<0.05).FW and SGR of fish fed diets less or beyond the optimum requirement level for histidine were significantly lower compared to other treatments.However,there were no significant differences among diet 2(0.45%His),diet 3(0.57%His),diet 4(0.66%His)and diet 5(0.78%His).FW(21.0 g),SGR(1.72%d-1)and FE(0.81)were the highest in fish fed diet with 0.57%His(Diet 3).The results indicated that for growth of Japanese seabass,histidine was essential and Japanese seabass was able to utilize crystalline forms of histidine.On the basis of SGR,the optimum dietary valine requirements of juvenile Japanese seabass were estimated to be 0.54%of diet(1.29%of dietary protein).
Japanese seabass;histidine;requirement;feed and nutrition
S963.821.1
A
1672-5174(2011)03-031-07
“:十一五”国家科技支撑计划项目(2006BAD03BO3)资助
2010-05-18;
2010-06-21
李 燕(1982-),女,博士生,主要从事水产动物营养与饲料的研究。E-mail:liyan0501@126.com
**通讯作者:E-mail:qhai@ouc.edu.cn
责任编辑 于 卫
