小麦株高性状的QTL定位分析
2011-01-04翟洪翠王华忠
章 珍,翟洪翠,王华忠
(天津师范大学a.生命科学学院,b.天津市细胞遗传与分子调控重点实验室,天津 300387)
小麦株高性状的QTL定位分析
章 珍,翟洪翠,王华忠
(天津师范大学a.生命科学学院,b.天津市细胞遗传与分子调控重点实验室,天津 300387)
以国际小麦作图组织的重组自交系群体W7984×Opata85为材料,在两种不同试验环境(2009年天津东丽区、2009年天津西青区姚村)下,分析其亲本及114个株系群体的株高,并利用QTL作图软件WinQTLCart2.5和区间作图及复合区间作图方法,对控制小麦株高性状的QTL进行定位.共检测到4个与小麦株高相关的QTLs,分别位于1A,3D,4A和7A染色体上,其中位于3D染色体上的QTL贡献最大,可以解释株高变异的10.3%~14.8%.
普通小麦;株高;数量性状位点;区间作图
20世纪60—80年代,矮杆和半矮杆小麦品种的推广,对全世界小麦产量的提高起到了关键作用.除受主效矮秆基因控制外,小麦株高性状还表现为受多基因控制的数量性状特征.部分小麦染色体存在决定小麦株高的数量性状位点(Quantitative trait locus,QTL),对小麦产量有重要作用.Cadalen等[1]检用Courtot与中国春杂交产生的DH群体,除了检测到Courtot所含的Rht-B1b和Rht-D1b矮秆基因外,还检测到控制株高的另外3个QTL和1个互作位点,这些QTL可以分别解释11.9%~19.1%的表型变异.Keller等[2]利用普通小麦Forno和斯卑尔脱小麦Oberkulmer的重组自交系群体,在3个环境中检测到分布于9条染色体上的11个 QTLs,单个 QTL可解释7.9%~31.4%的表型变异,全部QTLs可解释72.6%的表型变异.刘冬成等[3]发现7个影响株高的QTLs,分别位于染色体1B,4B(2个),6A(2个),6D和7A上,每个QTL能解释5.2%~50.1%的表型变异.周淼平等[4]利用重组自交系检测到4个影响小麦株高的QTLs,分别位于1D,2B,4A和4D染色体上,单个QTL能够解释10.3%~33.8%的表型变异,降低株高的效应为3.2%~7.4%.王竹林等[5]利用SSR和AFLP分子标记构建连锁图,在3种试验环境下分析了百农64×京双16组合的218个株系群体株高,检测到3个控制株高的QTLs,分别位于2B,4D和6A染色体上,贡献率分别为7.3%~11.5%,7.4%~12.9%,5.7%~11.3%.影响株高的QTL很多,且各位点存在大量等位变异,当选用不同遗传材料进行QTL分析时,可能会发现不同的基因;株高性状受基因型、环境以及基因型与环境互作的影响较大,各个位点受环境影响的程度是一个未知领域[4];同时一些影响株高性状的其它基因位点与该基因的多效性也处于研究阶段[6].因此,关于小麦株高的QTL定位还需要进一步深入研究.
Opata85×W7984重组自交群体是国际小麦作图组织用于构建小麦连锁图的作图群体,该群体的双亲遗传差异大,分子标记多态性频率高,利用该群体绘制的小麦遗传连锁图谱的分子标记近千个,平均每条染色体上有40多个标记,几乎达到了饱和的程度.利用该群体已对小麦斑病(Pyrenophoratritici-repentis)[7]、小 麦 叶 锈 病 (Pucciniarecondite)[8]、小麦白粉病(Blumeriagraminis)、小麦品质和产量构成因素等[9]许多重要的目标性状进行了QTL作图.本研究利用该作图群体亲本及114个重组自交系为材料定位影响株高性状的QTL,丰富小麦株高遗传基础理论.
1 材料与方法
1.1 植物材料
国际小麦作图组织(ITMI)的 Opata85×W7984重组自交系群体及亲本由南京农业大学作物遗传与种质创新国家重点实验室提供,其中Opata85为国际小麦玉米改良中心(CIMMYT)培育的春小麦品种,W7984是由硬粒小麦(Triticum durum)Altar84与粗山羊草(Ae.tarschii,DD基因组供体)CIGM86.940合成的双二倍体,该群体共有114个株系用于本研究.
1.2 田间试验
2008年秋分别将上述株系和亲本同时播种于天津东丽区(北纬39.16东经117.35)及天津西青区姚村(北纬39.05东经117.11)两地,采用随机区组设计,2次重复,单行区,行长1m,行距0.3m,为防止边际效应,在四周播种对照小麦,按常规方法进行田间管理,株高于2009年6月初小麦成熟期测量,分别测量东丽(Dongli,DL)和姚村(Yaocun,YC)两个地点的数据,以每个株系3~5次重复的平均值作为该株系的表型值.
1.3 统计分析和QTL定位
利用SAS软件对小麦株高鉴定结果进行统计分析和正态性检验.
选取利用该重组自交系构建的遗传图谱中的461个标记用于QTL定位分析,标记均匀分布在小麦18条染色体上(6A,6B和6D未考虑),覆盖2 972.1cM,标记间平均遗传距离为6.45cM.不同标记在Opata85×W7984重组自交系群体中的分离数据从grain genes网站获得(http://wheat.pw.usda.gov).
使用QTL作图软件winQTLCart 2.5,采用区间作图法和复合区间作图法对控制小麦株高的QTL进行定位分析,以LOD值大于2.5作为QTL存在的阈值,显著性水平为P<0.05.
2 结果与分析
2.1 小麦群体株高性状的统计分析
在两种不同的试验环境下,Opata85的平均株高为49.5cm,W7984的平均株高为74cm,双亲间相差24.5cm,差异达到极显著水平.株系群体株高分析结果表明,株系间存在较大差异,其变异系数为12.7%~14.8%.利用SAS软件对小麦株高性状进行了统计分析,表现为连续变异且超亲分离现象明显.群体中偏斜度值与峰度值的绝对值都小于1.0,基本上呈正态分布(图1,表1),表明小麦株高性状是受多基因控制的数量性状,其分布符合QTL作图对群体的要求.

图1 小麦株高在群体中的分布Figure 1 Frequency of plant height in the mapping population of wheat
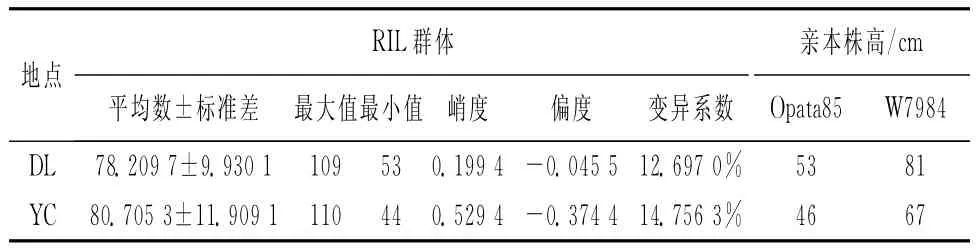
表1 小麦亲本及重组自交系群体中的株高分布Table 1 Frequency of plant height in mapping population of parents and RILs(W7984×Opata85)
2.2 小麦株高的QTL定位
使用QTL作图软件WinQTLCart2.5,利用区间作图法对控制小麦株高的QTL进行定位分析,在DL环境生长的小麦定位到显著的QTL;而在YC环境定位到3个QTLs,分别位于1A,3D和4A染色体上(表2,图2),其中位于1A和4A染色体上的QTL是来自于亲本W7984的基因,而位于3D染色体上的QTL是来自于亲本Opata85的基因且贡献率最大,可解释株高变异的14.8%.

表2 区间作图法检测小麦株高QTLs的结果Table 2 QTLs of plant height based on interval analysis
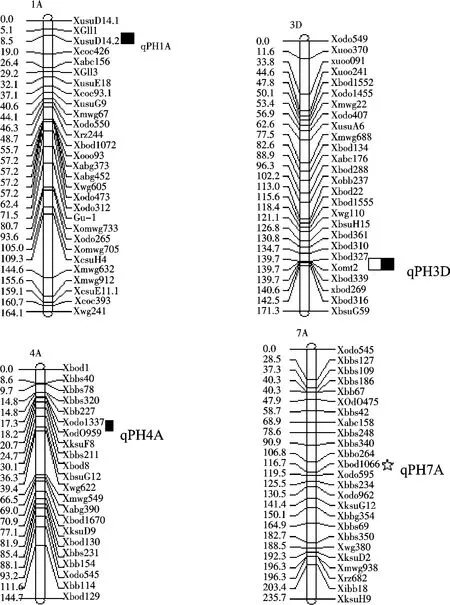
图2 定位在小麦染色体上的株高QTLsFigure 2 QTLs for plant height in wheat chromosome
利用复合区间作图法进行株高QTL定位分析时,在DL环境定位到1个QTL,位于7A染色体上(表3,图2),来自于亲本Opata85,贡献率为13.64%;在YC环境定位到1个QTL,位于3D染色体上(表3,图2),来自于亲本Opata85,贡献率为10.3%.
3D染色体上的株高QTL在两种环境中均能检测到.两种不同试验环境下也检测出了不同的QTLs,表明这些检测出的QTLs受环境的影响较大.

表3 复合区间作图法检测小麦株高QTLs的结果Table 3 QTLs of plant height based on composite interval analysis
3 讨论
在YC环境生长下的4A染色体上检测到的QTL接近周淼平等[4]在4A染色体上所检测到的QTL位点,在DL环境生长下的7A染色体上检测到的位点接近刘冬成等[3]在7A染色体上所检测到的QTL位点.上述2个QTLs位点,是不同研究者用不同材料在不同环境中发现的控制株高的QTL位点,表明位于4A和7A染色体上控制株高的数量性状位点稳定可靠;而在YC环境生长下的小麦检测到位于1A和3D染色体上的QTLs可能是本研究中发现的新的控制小麦株高的QTL.
Snape等[10]和 Sears[11]的研究结果表明,小麦中21条染色体中的大部分都与株高的遗传变异有关,而本研究中只检测到4个与小麦株高有关的QTL,这4个QTLs所能解释的株高变异只有10.3%~14.8%,说明仍有部分QTL未能检出.
具体来说,在本研究中使用区间作图在DL环境中未找到QTL,而使用复合区间作图却找到1个QTL;使用区间作图在YC环境中找到3个QTLs,而使用复合区间作图却找到1个QTL.其原因可能在于区间作图定位的QTL区间往往太宽,如果一个性状在同一染色体上有多个QTL存在时常常会标错QTL的位置,致使QTL定位不准确甚至出错误,由此可以看出复合区间作图更加精细和准确.另外,某一特定性状的QTL在同一连锁群的分布及数量是影响QTL定位精确度的又一主要因素.如果某一性状在某一连锁群上只有一个QTL,该QTL刚好处在某一标记座位上,且与标记表现为完全共分离,那么各种作图方法做出的结果差别不大;相反,如果同一连锁群上有多个QTL,则不同作图方法的结果会有很大的差别[12].由此可知,本研究检测到的位于3D染色体上的QTL分布比较单一.再者,QTL之间的互作效应也是影响QTL检测及定位精确性的一个因素[12].如果QTL之间存在连锁或上位性,不同作图群体、不同作图方法做出的结果会差别很大.用于QTL定位的群体概括起来分为:初级群体(F2,BCl,RIL,DH等),次级群体(NILs,ILs,CSSLs等),高级群体(SSSLs等).本研究所选的是初级群体,由于遗传背景的干扰,用初级群体很难检测出效应小的QTL[13].虽然在作图方法上尽量对遗传背景噪音进行了控制,但仍存在局限性.理论上讲,作图群体越大,等位基因分离越彻底,检出QTL的能力就越强,但是在前人研究[14]和本研究中并不是如此.另外,不同群体所用的亲本的亲缘关系不同,基因型差异大小不一致,株高性状潜在的QTL数目不一样,因此检出的QTL数目也会有差异.
由于基因型和环境的互作导致许多控制数量性状的QTL在不同的环境下表达水平不一致,也就是说,环境条件影响QTL检测:受环境影响小的QTL,在多个环境中均可被检测出,而受环境影响大的QTL在有的环境中未被检测出,在另外的环境中则能被检测出.正如本研究的结果所示,可能是由于株高性状受环境条件的影响较大,导致两个环境条件下检测到的QTL有所不同.
[1] Cadalen T,Sourdill P,Charmet G,et al.Molecular markers linked to Genes affecting plant height in wheat using a doubled-haploid population[J].TAG Theoretical and Applied Genetics,1998,96(6,7):933-940.
[2] Keller M,Karutz Ch,Schmid J E,et al.Quantitative trait loci for lodging resistance in a wheat×spelt population [J].Theor Appl Genet,1999,98:1171-1182.
[3] 刘东成,高睦枪,关荣霞,等.小麦株高性状的QTL分析[J].遗传学报,2002,29(8):706-711.
[4] 周淼平,黄益洪,任丽娟,等.利用重组自交系检测小麦株高的QTL[J].江苏农业学报,2004,20(4):201-206.
[5] 王竹林,王辉,孙道杰,等.小麦株高的QTL分析[J].西北农林科技大学学报,2008,36(12):59-63.
[6] Korzun V,Roder M S,Ganal M W,et al.Genetic analysis of the dwarfing gene(Rht8)in wheat.Part I:Molecular mapping ofRht8on the short arm of chromosome 2Dof bread wheat(TriticumaestivumL.)[J].Theor Appl Genet,1998,96:1104-1109.
[7] Faris J D,Anderson J A,Feancl L J,et al.RELP mapping of resistance to chlorosis nduction by Pyrenophora tritici-repentis in wheat[J].Theor Appl Genet,1997,94:98-103.
[8] Nelson J C,Singh R P,Autrique J E,et al.Mapping genes conferring and suppressing leaf rust resistance in wheat[J].Crop Sci,1997,37:1928-1935.
[9] Borner A,Schumann E,Furste A,et al.Mapping of quantitative trait loci determining agronomic important characters in hexaploid wheat (Triticum aestivum L.)[J].Theor Appl Genet,2002,105:921-936.
[10] Snape J W,Law C N,Worland A J.Whole chromosome analysis of height in wheat[J].Heredity,1977,38:25-36.
[11] Sears E R.The aneuploids of common wheat[J].Univ M Res Bull,1954,572:1-58.
[12] 席章营,朱芬菊,台国琴,等.作物QTL分析的原理与方法[J].Chinese Agricultural Science Bulletin,2005,21(1):88-92.
[13] Darvasi A,Weinreb A,Minke V,et al.Detecting marker-QTL linkage and estimating QTL gene effect and map location using a saturated genetic map[J].Genetic,1993,134:943-951.
[14] Hyne V,Kearsey M J,Pike D J,et al.QTL analysis:unreliability and bias in estimation procedures[J].Molecular Breeding,1995(1):273-282.
QTL mapping for plant height of wheat
ZHANGZhen,ZHAIHongcui,WANGHuazhong
(a.College of Life Science,b.Tianjin Key Laboratory of Cyto-Genetical and Molecular Regulation,Tianjin Normal University,Tianjin 300387,China)
A population of 114RILs lines from the cross of W7984×Opata85was used for wheat plant height genetic analysis and QTL mapping.The genetic linkage map was based on the 461segregation markers in this population published online.With the QTL mapping software WinQTLCart2.5and the methods of interval mapping and composite interval mapping,4putative QTLs related to plant height were detected in this population and respectively located on chromosomes 1A,3D,4Aand 7A.The largest contributive locus was identified on chromosome 3D,accounting for 10.3%—14.8%plant height phenotypic variation.
common wheat;plant height;QTL;interval mapping
Q943
A
1671-1114(2011)02-0073-04
2010-10-11
天津市自然科学基金资助项目(08JCYBJC5000);天津市高等学校科技发展基金资助项目(20070916)
章 珍(1982—),女,硕士研究生.
王华忠(1976—),男,副教授,博士,主要从事植物遗传学方面的研究.
(责任编校 纪翠荣)
