5种海洋微藻多糖体外免疫调节活性的筛选
2010-12-28周妍王凌孙利芹王长海
周妍,王凌,孙利芹,王长海
(烟台大学海洋学院,山东 烟台 264005)
5种海洋微藻多糖体外免疫调节活性的筛选
周妍,王凌,孙利芹,王长海
(烟台大学海洋学院,山东 烟台 264005)
目的:研究5种海洋微藻多糖对小鼠体外免疫细胞功能的影响,筛选出免疫调节活性强的微藻藻株。方法:考察5种海洋微藻多糖对小鼠脾脏淋巴细胞增殖,腹腔巨噬细胞RAW264.7增殖、吞噬中性红、释放NO能力的影响。结果:5种海洋微藻多糖对小鼠免疫细胞具有不同的刺激能力,其中,紫球藻多糖可极显著增强吞噬细胞的吞噬功能,促进巨噬细胞合成NO,促进脾淋巴细胞及腹腔巨噬细胞的增殖。证明紫球藻多糖具有增强小鼠细胞免疫功能的作用。
微藻多糖;脾淋巴细胞;腹腔巨噬细胞;免疫调节;活性;
海洋微藻是海洋生态系统中最主要的初级生产者,也是海洋生物资源的重要组成部分。海洋微藻多糖是由多个相同或不同的单糖基通过糖苷键相连形成的高分子碳水化合物。作为一种广泛存在于微藻体内的天然大分子物质,海洋微藻多糖除了具有传统的工业价值外,近年来的研究表明它们还具有多种生物活性及药用功能,如增强机体免疫活性、抗病毒、抗肿瘤、抗氧化、抗辐射等作用;大量研究表明海藻多糖是通过调节机体免疫系统功能发挥这些作用的。海藻多糖可以通过促进淋巴细胞增殖与分化、刺激巨噬细胞的吞噬功能、促进细胞因子和抗体的产生等途径来实现对机体免疫系统功能的调节[1-3]。本文采用小鼠脾脏淋巴细胞增殖以及腹腔巨噬细胞RAW264.7增殖、吞噬中性红、释放NO的能力为活性筛选指标,研究了5种海洋微藻多糖的免疫调节活性,旨在比较它们免疫增强作用的差异,筛选出免疫调节活性强的微藻,为研制新型免疫增强剂提供理论依据。
1 材料与方法
1.1 材料
紫球藻 (Porphyridium creuntum)、盐藻 (Dunaliella peircei)、等鞭金藻3011 (Isochrysis galbana 3011)、塔胞藻 (Pyramimonas sp.)、绿色巴甫藻 (Pavlova viridi),原种均购于中国海洋大学海洋微藻种质库,后由烟台大学海洋生化研究所纯化并保存;小鼠巨噬细胞样细胞株RAW264.7 (ATCC TIB-71) 由上海细胞研究所提供;清洁级昆明种小鼠,雌雄不限,体重18 ~ 22 g,购自山东绿叶制药有限公司(许可证号:SYXK(鲁)20030020)。
刀豆蛋白 A (ConA)、脂多糖 (LPS)、三羟甲基氨基甲烷 (Tris)、噻唑蓝 (MTT) 和十二烷基磺酸钠(SDS) 均为Sigma公司生产;RPMI-1640培养基为Gibco公司生产;新生小牛血清为杭州四季青生物工程材料有限公司生产。Synergy HT型酶联免疫检测仪为美国Bio-TEK公司生产;TE2000U荧光倒置显微镜为上海精密仪器仪表有限公司生产。
1.2 方法
1.2.1 微藻的培养 5种海洋微藻的培养在自制15 L平板式光生物反应器中进行,在海水培养液中加入各种营养盐,其加入量参见文献[4],取生长旺盛、颜色正常的微藻进行接种,接种量为培养液的20%。控制温度为 (23 ± 1) ℃,通气量为2.5 L/min,光强为50 µmol/m-2·s-1,连续光照,培养到稳定期离心收集藻泥。
1.2.2 紫球藻胞外多糖制备 将收集的紫球藻藻液离心,取上清液,经旋转蒸发浓缩后,加入3倍体积的乙醇沉淀,过滤、透析、冷冻干燥得粗多糖PEP。
1.2.3 胞内多糖制备 将收集的藻液离心,获得新鲜的藻泥;加入5倍体积的去离子水,置于冰箱 (-4 ℃)中冷冻,然后取出融化。如此反复3次提取水溶物;将冻融后的溶液超声破碎,离心10 min,弃残渣,取上清液;将上清液在水浴中加热,浓缩至原体积的 1/3,加入体积分数为 3%的三氯乙酸沉淀蛋白,离心(12 000 r/min) 10 min,取上清液;加入5倍体积的乙醇溶液(体积分数为95%),离心取沉淀洗涤、透析、冷冻干燥得白色粉末为粗多糖[5]。免疫测定前,精密称取紫球藻多糖PEP、盐藻多糖PDS、等鞭金藻多糖IGP、塔胞藻多糖PSP、绿色巴甫藻多糖PVD各4 mg,溶于20 mL的RPMI-1640培养基中,得浓度为200 µg/mL的微藻多糖溶液,用直径为0.22 µm的微孔滤膜过滤除菌备用。使用时依次倍比稀释可得浓度为 100,50,25,12.5 µg/mL 的溶液。
1.2.4 小鼠单核巨噬细胞 RAW264.7释放 NO能力的检测 取处于对数生长期的小鼠单核-巨噬细胞RAW264.7,胰酶消化收集细胞,用含10% 胎牛血清的培养液将其制备成巨噬细胞悬液,调整细胞浓度为1 × 106个/mL,于96孔板接种100 µL/孔,置37 °C,5% CO2培养24 h。加入用培养液稀释的不同浓度的微藻多糖100 µL/孔,并以100 µL LPS(2 µg/mL)、培养液作阳性和空白对照。继续培养48 h后,从每个孔取50 µL培养上清液到一个新的96孔板中,加入等量的Griess试剂,室温反应10 min,半小时之内在520 ~ 550 nm之间 (540 nm) 测定吸光度。根据标准曲线计算NO的含量[6]。实验重复三次。
1.2.5 RAW264.7吞噬中性红实验 制备细胞浓度为1 × 106个/mL的巨噬细胞悬液,加入96 孔板,100 µL/孔,如1.2.4加药,培养22 h后,每孔加入0.1%中性红生理盐水液100 µL,继续培养20 min,倾去上清,温PBS洗3遍,每孔加入细胞溶解液(为体积胞分数50%的乙酸和体积分数50%的无水乙醇)0.2 mL,室温下静置2 ~ 3 h,待细胞溶解后,即在酶联免疫检测仪上测540 nm处的吸光度[7]。
1.2.6 RAW264.7增殖能力的测定 制备细胞浓度为 5×105个/mL的巨噬细胞悬液,于 96孔板接种100 µL/孔,如1.2.4加药,培养24 h后,SRB法检测[8,9]570 nm处吸光值。
1.2.7 脾淋巴细胞增殖实验 无菌取脾,制备小鼠脾淋巴细胞悬液,调整细胞浓度为 (8 ~ 10) × 106个/mL,于96孔板接种100 µL/孔,再分别加入培养液(空白对照)、10 µg/mL ConA(阳性对照)及不同浓度的微藻多糖溶液各100 µL/孔,置37 °C,5% CO2培养48 h。培养结束前4 h,用MTT法[8-9]测定酶标仪在570 nm的吸光值。淋巴细胞增殖指数SI=供试样品组吸光值/空白对照组吸光值。
1.2.8 数据处理 所有数据均以均值±标准差表示。t检验采用SPSS11.5统计软件包完成,以P < 0.05表示差异显著;P < 0.01表示差异极其显著。
2 结果与讨论
2.1 对小鼠腹腔巨噬细胞释放NO的影响
5种海洋微藻多糖对小鼠腹腔巨噬细胞释放NO的影响结果如表1所示。结果显示,紫球藻多糖 (PEP)和塔胞藻多糖 (PSP) 均可显著地促进小鼠腹腔巨噬细胞释放NO的能力,在12.5 ~ 200 µg/mL的浓度范围内,与空白对照组相比有极显著差异 (P < 0.01)。随浓度增大,其促进作用逐渐增强,至200 µg/mL时释放NO的作用达到最大值。低浓度范围内 (12.5 ~ 25 µg/mL) 盐藻多糖 (PDS) 促NO释放的作用与空白对照组相比,无显著性差异 (P > 0.05),随着浓度的升高,释放NO的能力增强,至200 µg/mL时可极显著地促进小鼠腹腔巨噬细胞释放NO,其活性呈一定的剂量的依赖性。12.5 ~ 100 µg/mL范围内,等鞭金藻多糖 (IGP) 与空白对照组基本无促进NO释放的能力 (P > 0.05),而高浓度200 µg/mL时表示出极显著促进小鼠腹腔巨噬细胞释放NO的活性。而绿色巴甫藻多糖 (PVD) 促NO释放的活性最大值出现在低剂量组12.5 µg/mL,浓度增大,各剂量组活性之间无显著性差异 (P > 0.05)。
表1 5种海洋微藻多糖对小鼠腹腔巨噬细胞产生NO的影响(x±s, n=9)Tab. 1 Effects of polysaccharides from five micro-algae on NO production(±s, n=9)

表1 5种海洋微藻多糖对小鼠腹腔巨噬细胞产生NO的影响(x±s, n=9)Tab. 1 Effects of polysaccharides from five micro-algae on NO production(±s, n=9)
注:与空白对照相比,*P<0.05, **P<0.01。下同。
组别Group 200 µg•mL-1 100 µg•mL-1 50 µg•mL-1 25 µg•mL-1 12.5 µg•mL-1 PEP 19.721 ± 1.109** 14.891 ± 2.168** 11.558 ± 1.134** 7.884 ± 0.918** 7.204 ± 0.667**NO/µmol•mL-1 PDS 16.932 ± 1.548** 6.932 ± 1.273* 5.912 ± 1.018* 4.211 ± 0.419 4.415 ± 1.388 IGP 12.102 ± 2.020** 5.027 ± 0.751 4.959 ± 0.928 4.823 ± 1.109 4.1436 ± 0.333 PSP 10.401 ± 0.976** 10.333 ± 2.175* 9.585 ± 0.673** 8.633 ± 1.424** 6.184 ± 0.601**PVD 7.272 ± 1.071** 8.156 ± 0.751** 9.109 ± 2.410* 9.381 ± 0.855** 12.510 ± 1.364**Control 3.598 ± 0.509 LPS 8.905 ± 0.385**
2.2 对小鼠巨噬细胞吞噬中性红能力的影响
5种海洋微藻多糖对小鼠腹腔巨噬细胞吞噬中性红的影响见表2。在12.5 ~ 100 µg/mL的浓度范围内,随浓度增大,紫球藻多糖 (PEP) 和等鞭金藻多糖 (IGP) 刺激小鼠巨噬细胞吞噬中性红的能力不断增强,至100 µg/mL达到最大值,浓度继续增大,其活性反而下降。盐藻多糖 (PDS) 和塔胞藻多糖 (PSP) 巨噬细胞的吞噬活性呈现同样的趋势,不同的是在50 µg/mL时活性即达到最大值。绿色巴甫藻多糖 (PVD) 在低浓度范围 (12.5 ~ 50 µg/mL) 内可极显著刺激小鼠腹腔巨噬细胞吞噬中性红 (P < 0.01),而在高浓度范围内 (100 ~ 200 µg/mL) 对其吞噬能力呈现显著的抑制作用 (P < 0.01)。
表2 5种海洋微藻多糖对小鼠巨噬细胞吞噬中性红活性的影响(x± s, n=9)Tab. 2 Effects of polysaccharides from five micro-algae on neutral red uptake of mouse macrophage(± s, n=9)
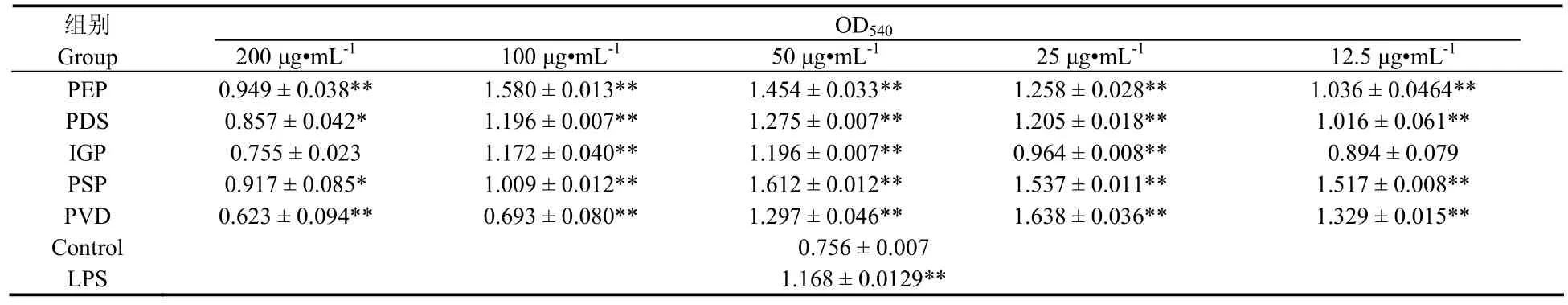
表2 5种海洋微藻多糖对小鼠巨噬细胞吞噬中性红活性的影响(x± s, n=9)Tab. 2 Effects of polysaccharides from five micro-algae on neutral red uptake of mouse macrophage(± s, n=9)
组别Group 200 µg•mL-1 100 µg•mL-1 50 µg•mL-1 25 µg•mL-1 12.5 µg•mL-1 PEP 0.949 ± 0.038** 1.580 ± 0.013** 1.454 ± 0.033** 1.258 ± 0.028** 1.036 ± 0.0464**OD540 PDS 0.857 ± 0.042* 1.196 ± 0.007** 1.275 ± 0.007** 1.205 ± 0.018** 1.016 ± 0.061**IGP 0.755 ± 0.023 1.172 ± 0.040** 1.196 ± 0.007** 0.964 ± 0.008** 0.894 ± 0.079 PSP 0.917 ± 0.085* 1.009 ± 0.012** 1.612 ± 0.012** 1.537 ± 0.011** 1.517 ± 0.008**PVD 0.623 ± 0.094** 0.693 ± 0.080** 1.297 ± 0.046** 1.638 ± 0.036** 1.329 ± 0.015**Control 0.756 ± 0.007 LPS 1.168 ± 0.0129**
2.3 对小鼠腹腔巨噬细胞增殖的影响
5种海洋微藻多糖对小鼠腹腔巨噬细胞增殖的影响结果如表3所示。100 µg/mL时,紫球藻多糖 (PEP)、塔胞藻多糖 (PSP) 和盐藻多糖 (PDS) 的活性都达到最大值,均可极显著地促进小鼠腹腔巨噬细增殖的能力(P < 0.01)。等鞭金藻多糖 (IGP) 的促巨噬细胞增殖活性随浓度增大呈现先增大后减小的趋势,在50 µg/mL时达到最大值。绿色巴甫藻多糖 (PVD) 低浓度时对小鼠腹腔巨噬细胞的增殖无显著刺激作用 (P > 0.05),在高浓度200 µg/mL时可极显著地促进小鼠腹腔巨噬细胞的增殖 (P < 0.01)。
表3 5种海洋微藻多糖对小鼠腹腔巨噬细胞增殖的影响(±s, n=9)Tab. 3 Effects of polysaccharides from five micro-algae on the proliferation of mouse peritoneal macrophage (±s, n=9).
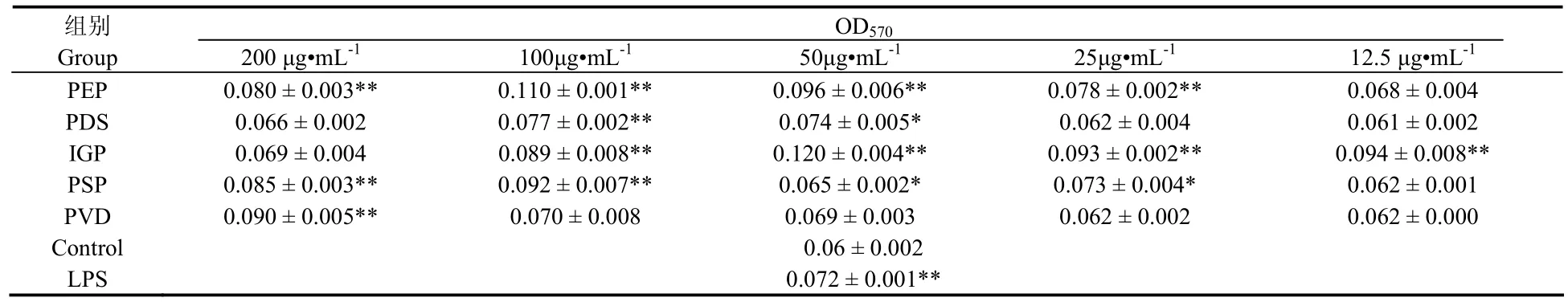
表3 5种海洋微藻多糖对小鼠腹腔巨噬细胞增殖的影响(±s, n=9)Tab. 3 Effects of polysaccharides from five micro-algae on the proliferation of mouse peritoneal macrophage (±s, n=9).
OD570组别Group 200 µg•mL-1 100µg•mL-1 50µg•mL-1 25µg•mL-1 12.5 µg•mL-1 PEP 0.080 ± 0.003** 0.110 ± 0.001** 0.096 ± 0.006** 0.078 ± 0.002** 0.068 ± 0.004 PDS 0.066 ± 0.002 0.077 ± 0.002** 0.074 ± 0.005* 0.062 ± 0.004 0.061 ± 0.002 IGP 0.069 ± 0.004 0.089 ± 0.008** 0.120 ± 0.004** 0.093 ± 0.002** 0.094 ± 0.008**PSP 0.085 ± 0.003** 0.092 ± 0.007** 0.065 ± 0.002* 0.073 ± 0.004* 0.062 ± 0.001 PVD 0.090 ± 0.005** 0.070 ± 0.008 0.069 ± 0.003 0.062 ± 0.002 0.062 ± 0.000 Control 0.06 ± 0.002 LPS 0.072 ± 0.001**
2.4 对小鼠脾淋巴细胞增殖的影响
5种海洋微藻多糖对小鼠脾淋巴细胞增殖的影响见表4。紫球藻多糖 (PEP) 可极显著地刺激小鼠脾淋巴细胞的增殖 (P < 0.01),并呈一定的剂量的依赖性,随着浓度的升高,其增殖作用不断增强。在12.5 ~50 µg/mL的浓度范围内,随浓度增大,等鞭金藻多糖 (IGP) 和绿色巴甫藻多糖 (PVD) 刺激小鼠脾淋巴细胞增殖的能力不断增强,至50 µg/mL达到最大值,浓度继续增大,其活性反而下降。塔胞藻多糖 (PSP) 各个浓度组均可显著或极显著地促进小鼠脾淋巴细胞增殖作用,且在12.5 ~ 100 µg/mL的浓度范围内,随浓度增大,作用不断增强,在 100 µg/mL达到最大值。盐藻多糖 (PDS) 对脾淋巴细胞的增殖作用与其他 4种藻比,相对较低。
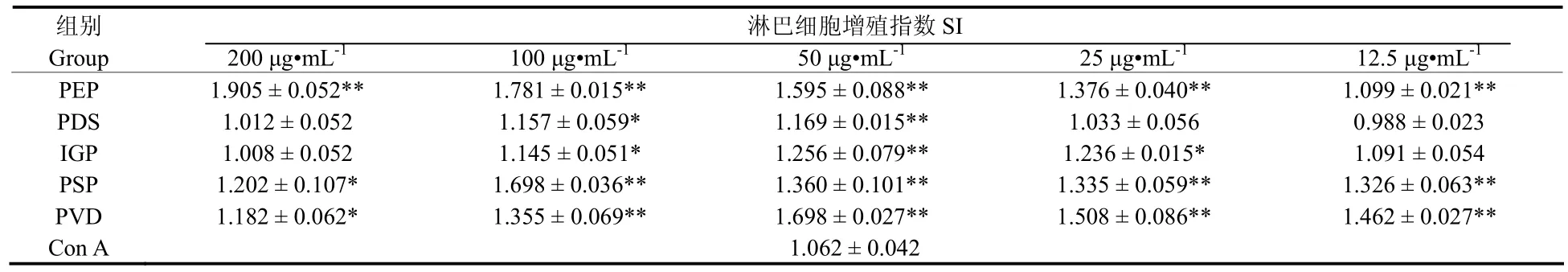
表4 五种海洋微藻多糖对小鼠脾淋巴细胞增殖的影响 (x±s, n=9)Tab. 4 Effects of polysaccharides from five micro-algae on the spleen lymphopoiesis of mouse (x±s, n=9)
2.5 五种海洋微藻多糖各个指标活性最大值的比较
分别以五种海洋微藻多糖四个指标的活性最大值作图,由图1 (a) 和 (b) 所示,紫球藻多糖 (PEP) 的活性相对都较高;盐藻多糖 (PDS) 除促巨噬细胞释放 NO活性较高外,其余三个指标相对于其它几种藻活性较低;等鞭金藻多糖 (IGP) 除促巨噬细胞增殖的活性较强外,另外三个指标活性相对较低;塔胞藻多糖 (PSP)、绿色巴甫藻多糖 (PVD) 的活性位于五种微藻多糖的中间水平。不同微藻的多糖,对同一免疫指标的最佳反应浓度不同:在巨噬细胞促进NO的释放试验中,除绿色巴甫藻多糖 (PVD) 活性最大值出现在低浓度 (12.5 µg/mL) 组,其它多糖均在最高浓度组 (100 µg/mL) 时出现最大值;在巨噬细胞吞噬中性红试验中,紫球藻多糖 (PEP) 活性最大值出现在100 µg/mL,绿色巴甫藻多糖 (PVD) 出现在25 µg/mL,其余3种均出现在50 µg/mL;而在巨噬细胞增殖试验中,绿色巴甫藻多糖 (PVD) 活性最大值出现在高浓度 (200 µg/mL) 组,等鞭金藻多糖 (IGP) 出现在50 µg/mL,其余3种均出现在100 µg/mL;在促淋巴细胞增殖试验中,紫球藻多糖 (PEP) 活性最大值出现在200 µg/mL,塔胞藻多糖 (PSP) 出现在100 µg/mL,其余3种微藻多糖活性最大值均出现在50 µg/mL。
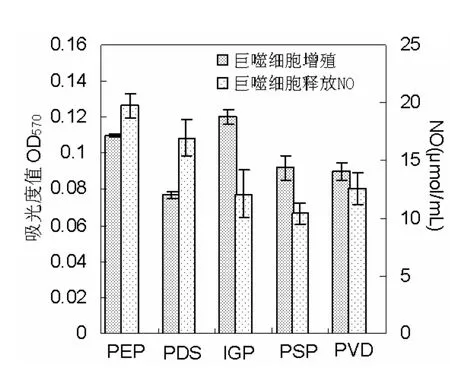
图1 (a) 五种海藻多糖活性最大值的比较 (1)Fig.1 (a) Maximal value comparison of five polysaccharides from five micro-algae (1)
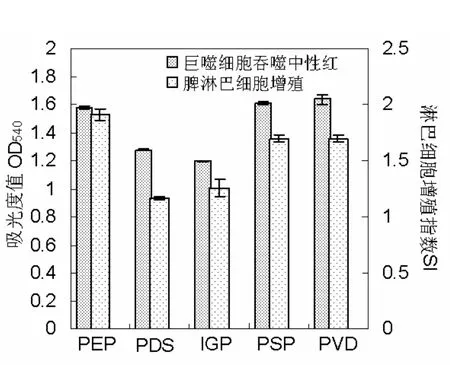
图1 (b) 五种海藻多糖活性最大值的比较 (2)Fig.1 (b) Maximal value comparison of five polysaccharides from five micro-algae (2)
3 结 语
已发现的免疫活性多糖,激活巨噬细胞是其最重要的作用机制之一[10]。多糖对巨噬细胞的激活作用可通过多种途径实现:促进巨噬细胞的增殖,提高其对肿瘤细胞或病原微生物的毒性;提高吞噬活性;增加NO和ROS产量;诱导或调节细胞因子和趋化因子的分泌等。脾脏是机体内重要的免疫器官,是体外试验中淋巴细胞的重要来源。测定淋巴细胞体外增殖反应是检测淋巴细胞功能的常用方法[11,12]。本研究中 5种海洋微藻多糖可不同程度地激活巨噬细胞或促进脾淋巴细胞增殖,从而达到提高机体免疫功能的目的,其中,紫球藻多糖活性最强。
从实验结果中我们发现,不同的海洋微藻多糖对同一免疫指标的影响程度有较大差别(作用的强弱不同),或是通过对不同的免疫细胞活性进行调节从而增强机体的免疫功能(作用的靶细胞不同),例如,紫球藻能极显著刺激淋巴细胞增殖反应,而盐藻多糖则不能,这可能是其免疫增强作用的机制不同造成的,因此,还要结合其他的实验才能给这些多糖的免疫增强作用做出准确的评价。
[1] Ramesh H P, Tharanathan R N. Carbohydrates-the renewable raw materials of high biotechnological value [J]. Crit Rev Biotechnol, 2003, 23: 149-173.
[2] 倪学文. 海洋微藻应用研究现状与展望 [J]. 海洋渔业, 2005, 27(3): 251-255.
[3] 刘晋, 郭长江, 刘嘉喜. 海藻多糖免疫调节作用的研究进展 [J]. 中国食物与营养, 2007(5): 49-51.
[4] 孙利芹, 林剑, 王长海等. 均匀设计在紫球藻培养基优化中的应用 [J]. 海洋通报, 2004, 23 (6): 70.
[5] 李亚清, 杨海波, 刘艳. 小球藻多糖的分离纯化和组成分析 [J].大连水产学院学报, 2006, 21(3): 294
[6] Green L C, Wagner D A, Glogowski J, et al. Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids [J]. Analytical Biochemistry 1982, 126:131-138.
[7] Wang Z T, Ng T B, Yeung H W, et al. Immunomodulatory effect of a polysaccharide-enriched preparation of Codonopsis pilosula roots [J]. General Pharmacology: The Vascular System. 1996, 27: 1 347-1 350.
[8] 周思朗, 屈艳妮, 张健. SRB与MTT法细胞计数应用的比较 [J]. 中国现代医药杂志, 2005, 15(17): 2 616.
[9] 刘建文. 药理实验方法学: 新技术与新方法 [M]. 北京: 化学工业出版社, 2003: 30-59.
[10] 兰凤英, 纪耀华. 香菇多糖的药理及临床研究进展 [J]. 吉林中医药 2004, 24: 56-57.
[11] 郭志廷, 伊鹏霏, 王鲁. 经分子修饰后的人参皂苷-Rh2对小鼠免疫功能的影响 [J]. 中兽医医药杂志, 2007, (1): 16.
[12] 陈炅然, 胡庭俊, 程富胜. 蕨麻多糖对小鼠淋巴细胞增殖和一氧化氮分泌的影响 [J]. 中国兽医科技, 2005, 35(9): 737.
Immunomodulation activities of polysaccharides in vitro from five micro-algae
ZHOU Yan, WANG Ling, SUN Li-qin, WANG Chang-hai
(Marine School of Yantai University, Yantai 264005, China)
To study the effects of polysaccharides from five micro-algae on immunocell functions of mice in vitro, and screen out bioactive marine micro-alga. The immune stimulating activities of polysaccharides from five micro-algae toward mice cells,including stimulating spleen lymphocyte proliferation and macrophage proliferation, enhancing phagocytic activity of neutral red, increasing nitro oxide (NO) production were tested. The results showed that the polysaccharides from these five micro-algae had stimulating activities on cells mediated immunity in mice. The Porphyridium creuntum polysaccharides had the effect of enhancing phagocytic activity of neutral red, increasing nitro oxide (NO) production, and stimulating spleen lymphocyte proliferation and macrophage proliferation. It proved that Porphyridium creuntum polysaccharides had the effect of enhancing the immunocompence of the cells in mice.
Polysaccharides from micro-algae; splenic lymphocyte; peritoneal macrophage; immunomodulation;activities
A
1001-6932(2010)02-0194-05
2009-04-01;
2009-08-05
山东省自然科学基金(Y2007D59);烟台大学大学生科技创新基金(080605);烟台市科技攻关项目(2009219)
周妍,女,(1985-),山东东营人,硕士研究生,从事海洋活性物质方面研究
王长海,教授,博士生导师,电子邮箱:chwang2001@sina.com
