不同条件下条斑紫菜光合效率的比较研究
2010-12-28赵小波张学成许璞
赵小波,张学成,许璞
(1,中国海洋大学 海洋生命学院,山东 青岛 266003;2,常熟理工学院生物与食品工程学院,江苏 常熟215500)
不同条件下条斑紫菜光合效率的比较研究
赵小波1,张学成1,许璞2
(1,中国海洋大学 海洋生命学院,山东 青岛 266003;2,常熟理工学院生物与食品工程学院,江苏 常熟215500)
用叶绿素荧光仪测试了7个条斑紫菜品系在不同氮磷浓度、盐度、pH及光质条件下的光合效率及光合色素含量。结果显示,条斑紫菜叶状体最适氮浓度为1.0 ~ 1.5 mg/L,最适磷浓度为0.05 ~ 0.15 mg/L;在盐度为20 ~ 30条件下紫菜的光合效率保持较高的水平;紫菜生长的适宜pH值为8.0。在其它条件相同时,紫菜在不同的光质照射下光合效率顺序为:白光>绿光>红光>蓝光。所实验紫菜品系的藻红蛋白含量和变异幅度均显著大于藻蓝蛋白和别藻蓝蛋白,而叶绿素含量无明显变异。
条斑紫菜;光合效率;光合色素
紫菜(Porphyra)是具有重要经济价值的大型海藻。因为营养丰富,其栽培和加工业有显著的经济效益,我国紫菜栽培业取得了长足的发展[1]。但是,由于人工栽培密度增大,群体内近交等原因,种质退化较为严重,选育具有优良性状的紫菜品系用于生产,十分迫切。在紫菜良种选育中,光合效率是一个十分重要的指标。它反映了藻体碳同化,生产有机物的能力。较高的光合效率意味着藻体可能具有更高的速率生长,从而缩短生长期,提高经济效率。
现在,国内外研究光合效率主要采用叶绿素荧光动力法。1983年,第一台脉冲振幅调制(Pulse-Amplitude-Modulation,PAM)荧光仪——PAM-101/102/103研制成功[2]。与“表观性”的气体交换指标相比,叶绿素荧光参数更具有反映“内在性”特点。因此,叶绿素荧光动力学技术被称为测定叶片光合功能快速、无损伤的探针[3]。叶绿素荧光参数中,Fv/Fm(Fv:可变荧光(variable fluorescence)反映了QA的还原情况;Fm:最大荧光产量(maximal fluorescence),是 PSⅡ反应中心处于完全关闭时的荧光产量。可反映通过PSⅡ的电子传递情况)代表光系统Ⅱ(PSⅡ)最大光化学量子产量,反映PSⅡ反应中心内光能转换效率,是研究光合结构生理状态的重要参数[4]。而在光合作用中,PSⅡ率先被激发,是形成氧气的重要阶段,因此对于PSⅡ的研究十分重要。目前,已将 Fv/Fm参数应用于部分海藻的研究,如束生刚毛藻(Cladophora fascicularis)[5],小球藻(Chlorella vulgaris)等[6],但在紫菜中还鲜有类似报道。
本实验使用叶绿素荧光仪(mini-PAM), 测定了 7个不同品系条斑紫菜叶状体在不同条件下的Fv/Fm,检测了它们光合色素的含量,旨在为优良品系筛选提供光合生理比较的实验检测方法和理论依据。
1 材料与方法
1.1 材料
本实验选用 7个不同品系紫菜叶状体材料,材料名称及来源见表 1。Y-Wqd采自青岛汇泉湾,Y-zkh由中国科学院海洋研究所费修绠研究员惠赠,其余均由常熟理工学院许璞教授惠赠。

表 1 实验品系及特征Tab. 1 Experimental strains and characteristics
1.2 材料预培养
将 -20 ℃保存的实验藻体预培养3 d,待活力恢复后进行测试。恢复条件为:自然海水,温度12℃,光周期12 L︰12 D,光强20 μmol/m2s。
1.3 不同氮浓度下紫菜光合效率比较
以 NaNO3为氮源,设置 0.5,1.0,1.5,2.0 mg/L,4个浓度梯度,将7个品系条斑紫菜置于不同氮浓度环境,12 ℃,20 μmol/m2s培养 3 d后,使用mini-PAM 叶绿素荧光仪(Walz Effectnich ,Germany)进行光合效率的测定。样品经暗适应 15 min,测试其光合效率(Fv/Fm)。实验重复6次。数据采用Excel进行处理统计分析。
1.4 不同磷浓度下紫菜光合效率比较
以KH2PO4为磷源,设置0.05,0.15,0.25,0.35 mg/L,4个浓度梯度,将7个品系条斑紫菜置于不同磷浓度环境,12 ℃,20 μmol/m2s培养3 d后,使用mini-PAM叶绿素荧光仪进行光合效率的测定。样品经暗适应 15 min,测试其光合效率(Fv/Fm)。实验重复6次。数据采用Excel进行处理统计分析。
1.5 不同盐度环境下紫菜光合效率比较
设置4个不同的盐度梯度,10,20,30和40。将 7个品系条斑紫菜置于不同盐度环境,12 ℃,20 μmol/m2s培养3d后,使用mini-PAM叶绿素荧光仪进行光合效率的测定。样品经暗适应 15min,测试其光合效率(Fv/Fm)。实验重复6次。数据采用Excel进行处理统计分析。
1.6 不同品系紫菜在不同pH环境下光合效率比较
设置4个pH值梯度,6.0,7.0,8.0,9.0,以NaOH,HCl调节得到。将 7个品系条斑紫菜置于不同pH环境,12 ℃,20 μmol/m2s培养3 d后,使用mini-PAM叶绿素荧光仪进行光合效率的测定。样品经暗适应15 min,测试其光合效率(Fv/Fm)。实验重复6次。数据采用Excel进行处理统计分析。
1.7 不同光质下紫菜光合效率比较
使用滤光片过滤光源,设置 4个不同光质条件,红光、白光、蓝光、绿光。将7个品系条斑紫菜置于不同光质条件,12 ℃,60 μmol/m2s,照射1 h,使用mini-PAM进行光合效率的测定。样品经暗适应15 min,测试其光合效率(Fv/Fm)。实验重复6次。数据采用Excel进行处理统计分析。
1.8 藻胆蛋白和叶绿素含量的测定
将保存的紫菜叶状体培养 3 d,待活力恢复后进行测试。恢复条件为:自然海水培养,培养温度12 ℃,光暗时间 12 L︰12 D,光照强度 20 μmol/m2s。
测试方法采用张学成等[7]改进方法用吸收光谱法进行藻胆蛋白含量测定。选取健康的藻体,用吸水纸吸去水分,各称取500 mg,切碎,加50 mM的磷酸缓冲液(pH5.5)8 mL,用研钵研细,然后将材料置冰箱内 2 h,用高速离心机离心(30 000 g,20 min),整个操作过程的温度控制在0 ~ 4 ℃。
上清液为藻胆蛋白的粗提液,沉淀加90 %丙酮黑暗中提取20 min,离心(10 000 g,10 min)后得到叶绿素粗提液。用下列公式计算藻胆蛋白和叶绿素的含量:

2 结 果
2.1 不同氮浓度下紫菜光合效率比较
从图1中可以看出不同品系的紫菜在不同氮浓度条件下表现差异较大。Y-zkh,Hy-1,在氮浓度1.0~ 1.5 mg/L时,达到较高的光合效率。Y-zkh在1.0 mg/L,1.5 mg/L时光合效率无显著差异(p> 0.05),但均显著大于(p< 0.0 5)0.5 m g/L,2.0 mg/L时的光合效率;Hy-1在1.0 mg/L,1.5 mg/L时光合效率无显著差异,但均显著大于0.5 mg/L,2.0 mg/L时的光合效率。Y-Wqd在0.5 mg/L时光合效率最高,0.5 mg/L时的光合效率较1.0 mg/L时提高了6.4%,较1.5 mg/L时提高了14%,较2.0 mg/L时提高了19.1%,显示其不耐高氮浓度。Y-H001,Y-W0401均在1.0 mg/L时达最大光合效率。Hy-1在0.5 ~ 1.0 mg/L时光合效率最高。

图 1 紫菜在不同氮浓度下光合效率Fig. 1 Photosynthetic efficiency of P. yezoensis under different concentrations of nitrogen
2.2 不同磷浓度下紫菜光合效率比较
结果见图2。大部分品系紫菜在0.05 ~ 0.15 mg/L时,光合效率逐渐提高,在0.15 mg/L后逐渐下降。Y-zkh在0.15 mg/L时光合效率较0.25 mg/L时提高了19.8%,较0.35 mg/L时提高了24.4%。Y-9970在0.15 mg/L时的光合效率极显著大于0.25 mg/L时的光合效率(p< 0.01),在0.05 mg/L时的光合效率显著大于0.25 mg/L时的光合效率。Y-zkh依然保持了较高的光合效率,在0.05 mg/L时,极显著大与其他品系,较Y-Wqd提高了36 %,Y-W0401提高了23 %。Y-H001的光合效率在0.35 mg/L时最高,显著大于0.15 mg/L,0.25 mg/L时的光合效率,极显著大于0.05 mg/L时的光合效率,显示较好的耐高磷浓度的特性。

图 2 紫菜在不同磷浓度下光合效率Fig. 2 Photosynthetic efficiency of P. yezoensis under different concentrations of phosphorus
2.3 不同品系紫菜在不同盐度下光合效率比较
不同品系紫菜在不同盐度环境下光合效率结果见图3。大部分品系的紫菜在盐度10 ~ 20时,光合效率逐渐提高,20后开始降低。盐度20时,Y-zkh的光合效率较10时提高了16.1 %,较30时提高了8.4 %,较40时提高了10.9 %;Y-W0401在盐度20时的光合效率较10时提高了9.5 %,较30时提高了8.6 %,较40时提高了20.0 %。但Y-Wqd在盐度30时的光合效率与在20时先比较,无显著差异。盐度20时,Y-zkh,Y-9970,Y-W0401的光合效率极显著大于Y-Wqd,盐度30 ~ 40时,Y-W0401与Y-Wqd无显著差异。Y-zkh,Y-9970在盐度较高的情况下(盐度>30)光合效率极显著大于其它品系,显示了较好的耐高盐性能。

图 3 紫菜在不同盐度环境下光合效率Fig. 3 Photosynthetic efficiency of P. yezoensis under different salinities
2.4 不同品系紫菜在不同pH下光合效率比较
结果见图4。总体上紫菜在弱碱环境,特别是pH8.0时可以取得较高的光合效率。在中性及偏酸环境下,光合效率较低。pH8.0时,所有品系的紫菜均达到最大光合效率,与其他pH值时的光合效率相比均具有显著差异或极显著差异。pH8.0时,Y-Wqd的光合效率,较 pH9.0时增长了 4 %,较pH7.0时增长了4.6 %,较pH6.0时增长了12.1 %;Y-H001较pH9.0增长了3.8 %,较pH7.0增长了10.9%,较pH6.0增长了19.9 %;Y-zkh较pH9.0增长了10.0 %,较pH7.0增长了6.3 %,较pH6.0增长了13.0 %。pH8.0时,Y-zkh光合效率均极显著大于其它品系;Y-W0401的光合效率极显著大于Y-Wqd;Y-H001极显著大于 Y-Wqd,显著大于其它品系。这反映了Y-zkh,Y-H001产量较高这一特性。pH8.0时,Yh-1的光合效率极显著大于Hy-1。
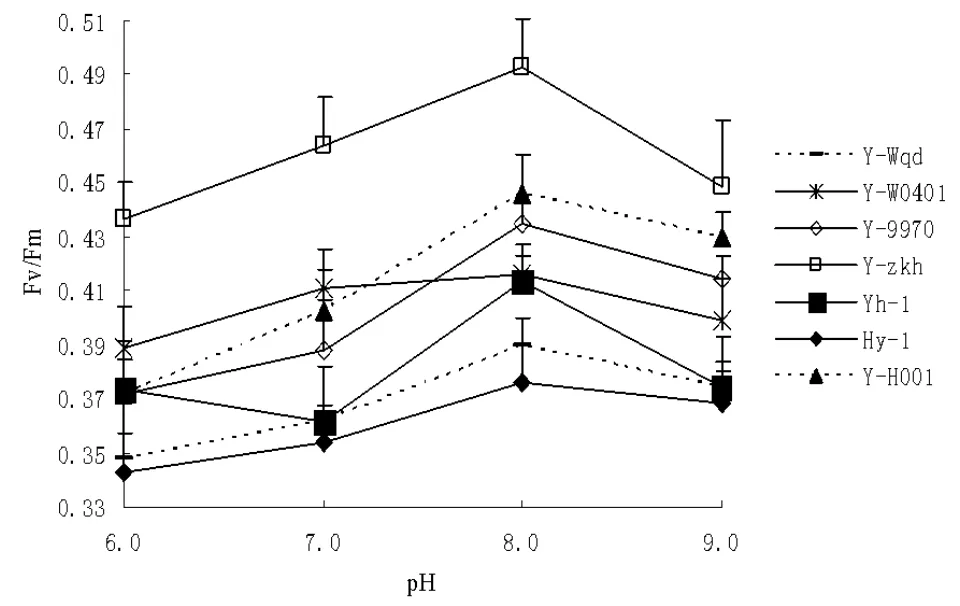
图 4 不同品系紫菜在不同pH值环境下光合效率比较Fig. 4 Photosynthetic efficiency of P. yezoensis under different pH
2.5 不同光质下紫菜光合效率比较
结果见图 5。紫菜在白光照射下可以取得较高的光合效率,绿光次之,红光再次,而在蓝光时光合效率最低。在白光条件下,Y-Wqd的光合效率较红光时提高了16.2 %,较蓝光时提高了27.3 %,较绿光提高了15.1 %;Y-zkh在白光时的光合效率较红光增长了6.6 %,较蓝光增长了13.7 %,较绿光时增长了2.8 %;w0401在白光时的光合效率较红光增长了6.3 %,较蓝光增长了9.1%,较绿光时增长了3.5 %.在红光,绿光照射下,Y-Wqd,Y-W0401,Y-9970之间无显著差异,但在蓝光照射下Y-9970,Y-W0401光合效率均极显著大于Y-Wqd,白光照射下,Y-Wqd显著大于Y-W0401和Y-9970,Y-W0401和 Y-9970之间无显著差异。无论在何种光源照射下,Yh-1的光合效率均极显著大于Hy-1。
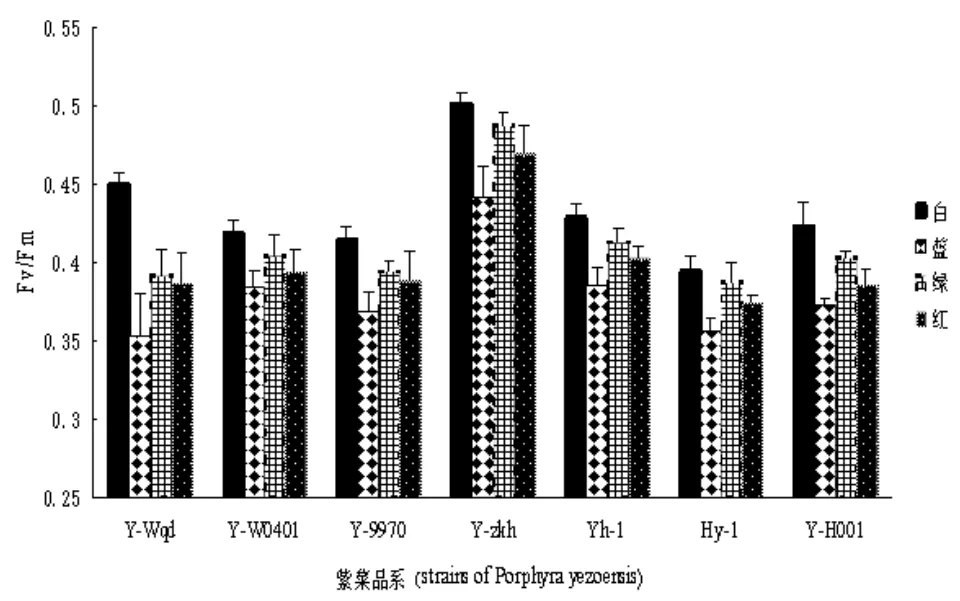
图 5 条斑紫菜在不同光质下光合效率Fig. 5 Photosynthetic efficiency of P. yezoensis under different light quality
2.6 藻胆蛋白和叶绿素含量的测定
结果见表2。所有品系紫菜,均为藻红蛋白(PE)含量显著大于其它类型藻胆蛋白。在Y-zkh中,PE的含量是藻蓝蛋白(PC)的1.39倍,别藻蓝蛋白(APC)的2.79倍;在Y-Wqd中, PE含量是PC的1.61倍, APC的7.42倍;在w0401中,PE含量是PC的1.32倍, APC的2.94倍。Y-Wqd的藻胆蛋白含量无论是PE,PC,APC 均显著小于其他品系的紫菜。本试验所用的所有紫菜品系的叶绿素含量均无显著差异。
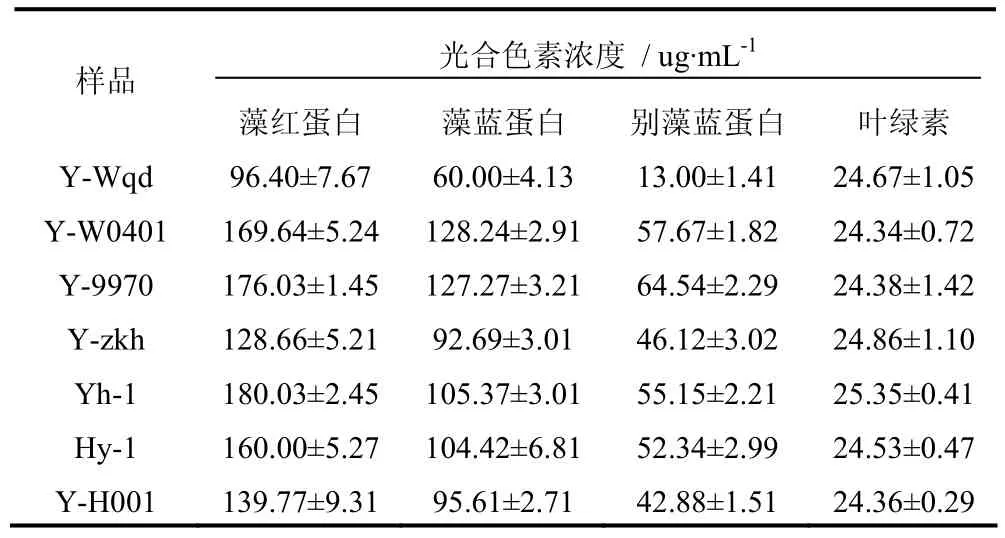
表 2 不同藻体光合色素含量Tab. 2 Photosynthetic pigment contents of different strains of P. yezoensis
3 讨 论
氮,磷是紫菜生长所必需的元素。氮是蛋白质,核酸,磷脂及其他紫菜生长所必需的有机氮化合物的构成成分,也是许多辅酶和叶绿素分子结构成分;磷是蛋白质,核酸,磷脂等多种物质的重要成分,与细胞的能量代谢,基因表达,蛋白质活性调控等过程密切相关。环境中氮,磷的供应直接影响紫菜的生长发育,紫菜的正常生长发育需要一定的氮磷浓度,在本试验中,栽培的紫菜最适氮浓度为1.0 ~ 1.5 mg/L,磷浓度为 0.05 ~ 0.15 mg/L。氮磷浓度过低,会影响一些重要物质的合成;氮浓度过高,会导致植物体内糖含量不足;磷浓度过高,会导致磷酸钙沉淀,会阻止植物对于硅,锌的吸收[8]。杨晓玲等认为紫菜对高质量浓度的氮、磷具有较高的适应与耐受性,因此通过实施紫菜栽培工程,不仅可以获得直接的经济效益,而且还以减缓海水富营养化,使退化的养殖海域得以修复,使海水养殖业得到持续发展[9]。
盐度是紫菜生长过程中的重要生态因子。迄今为止,用叶绿素荧光技术研究盐度对高等植物光合作用影响的报道较多[10,11]。目前探索紫菜适宜盐度方面的研究较少,严兴洪[12]等研究了紫菜的低耐盐性指出,盐度8是野生品系细胞存活的极限盐度,优良品系的生存极限盐度可达到盐度 5。骆其君认为,条斑紫菜自由丝状体生长最适盐度为25 ~ 30,在15 ~ 40范围内也能生长[13]。
分析本试验数据,20 ~ 30是紫菜生长较为合适的盐度范围,在这个范围内紫菜的光合效率保持较高的水平。超过这个范围,盐度变化导致光合系统处于胁迫状态,特别是对紫菜的PSⅡ产生影响,这可能是由于盐胁迫阻断QA到QB的电子传递,从而形成较多QB非还原性PSⅡ反应中心,导致PSⅡ反应中心放氧活性降低所致;而低渗条件下,细胞色素会溶解,破坏光合作用[14]。此外,有报道指出,在高盐环境下,有部分海藻能够产生磷脂 LPA,且LPA的量随胁迫时间的变化而变化[12]。但在紫菜中是否如此,需作进一步研究。
生物体内酶的产生,激活,调控作用需要适宜的pH 环境。本试验结果表明,紫菜在弱碱性环境中(pH 8.0)光合效率较高,这与其生态环境有关。一种植物在长期的进化过程中,逐渐适应周围的环境,各种生理指标逐渐产生相应的变化。赵小波等发现江苏启东吕泗地区的栽培型紫菜在各种测试中的指标均优于青岛野生型。从根本上说,这与它们长期生长的地区生态条件有关1)赵小波, 张学成, 许璞. 不同品系条斑紫菜光合效率比较研究[J].中国海洋大学学报,2010,待刊.。刘绿叶等检测了江苏吕四海区的酸碱度,其均值为 8.1[15]。本试验室检测了野生型紫菜采集地区的酸碱度,均值为8.4。紫菜在长期的弱碱性环境中生长,产生了一套适应机制,从而可以在弱碱性环境中达到较高的光合效率。
光质是调节控制植物代谢的基本因素之一,它对植物的生长、形态结构、光合作用和物质代谢都具有一定的调控作用。本试验比较在不同光质条件下紫菜的光合效率,结果表明:在其它条件相同时,其光合效率顺序为:白光>绿光>红光>蓝光。测试的7个品系紫菜,均为藻红蛋白占据优势。藻红蛋白主要吸收绿光,同时紫菜的光系统Ⅰ(PSⅠ)处于兴奋状态,绿光被藻胆蛋白吸收后,传递给PSⅡ,促使 PSⅡ的活性提高,两个光系统的能量趋于均衡,光合效率提高;红光和蓝光主要被叶绿素吸收,两个光系统间的能量分配差异更大,不利于光合效率提高。紫菜对于绿光较高的吸收,也是其对于环境的一种适应。Häder等人认为大部分红藻在海水较深处生长旺盛[16],绿光穿透海水的能力要强于红光,蓝光,因此,经过长期的适应,紫菜可以较好的吸收绿光。不同海藻对于不同光质的喜好不同,Dring[17]在小球藻、栅藻(Scenedesm us)的研究中发现,促进光合效率最有效光的是蓝光。此外,有人提出通过光质处理改变藻类的生长及生化组成,以提高其作为水产养殖饵料和食品的营养价值[18]。
叶绿素a和藻胆蛋白是紫菜重要的光合色素。叶绿素是光合作用过程中最重要的光合色素,在所有光合器官中都含有叶绿素。在紫菜中,存在的是叶绿素 a,是光合反应中心色素。藻胆蛋白是紫菜光合作用中重要的辅助色素蛋白,其中藻红蛋白在红藻的捕光色素系统中首先捕获光能,然后传递给藻蓝蛋白,再传递给别藻蓝蛋白,最后传递给叶绿素 a。光谱研究表明,藻胆蛋白捕获的光能高效而优先地分配给光合膜中的 PSⅡ反应中心说明藻胆蛋白与 PSⅡ反应中心之间存在结构和功能上的某种联系。这一观点已得到冰冻撕裂和冰冻蚀刻电镜观察的证明。而在本实验中,没有发现藻胆蛋白含量与光合效率之间的必然联系,光合效率较高的Y-zkh的藻胆蛋白含量与其他栽培型相比并不占优势。这其中,可能存在一个光合色素阈值的问题,当光合色素含量在阈值之下时,光合色素含量对于光合效率有重大影响;当含量高于阈值时,光合色素含量就不成为光合效率的决定性因素。
[1] 马家海, 蔡守清. 条斑紫菜的栽培与加工 [M]. 北京: 科学出版社, 1996, 1-68.
[2] Schreiber U, Bilger W, Klughammer C. Lichtenthaler,H K (ed).Applications of Chlorphyll Fluorescence in Photosynthesis Research,Stress Physiology, Hydrobiology and Remote Sensing.Dordrecht:Kluwer Academic Publishers [C]. 1988, 151-155.
[3] Schreiber U, Bilger W, Neubauer G. Ecophysiology of the Photosynthesis. (eds Schulze , E2D and Caldwell,MM.)[C]. Springer Verlag , Berlin.1994.
[4] 张守仁. 叶绿素荧光动力学参数的意义及讨论 [J]. 植物学通报,1999, 16 (4): 444-448.
[5] 韩志国, 贺立静, 顾继光. 束生刚毛藻脱水和复水过程中光合作用的变化 [J]. 生态学杂志, 2005, 24(11): 1 291-129.
[6] 梁 英, 金月梅, 田传远. 磷限制及恢复对小球藻叶绿素荧光特性的影响[J]. 南方水产, 2008, 4(4): 1-7.
[7] 张学成. 不同产地龙须菜光合色素的比较研究 [J]. 海洋湖沼通报, 1993, (1): 52-59.
[8] 武维华.植物生理学 [M]. 北京: 科学出版社, 2003: 90-92.
[9] 杨晓玲, 郭金耀. 条斑紫菜对高浓度氮、磷的耐受性研究 [J]. 水产科学, 2008, 27(12): 655-657.
[10] Netondo G W, Onyango J C, Beck E. Sorghum and salinity: Ⅱ. Gas exchange and chlorophyll fluorescence of Sorghum under salt stress[J]. Crop Science , 2004, 44(3): 806-811.
[11] Lu C, Qiu N, Lu Q.Does salt stress lead to increased susceptibility of photosystem Ⅱto photoinhibition and changes in photosynthetic pigment composition in halophyte Suaeda salsa grown outdoors [J].Plant Scidence, 2002, 163: 1 063-1 068.
[12] 严兴洪, 陈敏. 坛紫菜耐低盐优良品系的筛选 [J]. 上海水产大学学报, 2008, 17(3): 316-320.
[13] 骆其君, 卢冬, 费志清. 生态因子对条斑紫菜自由丝状体生长的影响 [J]. 水产科学,1999, 18(4): 6-9.
[14] Meijer HJ G, Arisz S A, Hinbergen J A J van. Hyperosmotic stress rapidly generate lyso-phosphatidic acid in Chlamydomonas [J]. The Plant Journal, 2001, 25 (5): 541-548.
[15] 刘绿叶, 孙国铭, 刘培廷. 应用主成分法和聚类分析法分析吕四渔场近岸海水水质 [J]. 海洋渔业,2006, 28(3): 217-221.
[16] Häder D P, Gröniger A, Hallier C. Photoinhibition by visible and ultraviolet radiation in the red macroalga Porphyra umbilicalis grown in the laboratory [J]. Plant Ecol, 1999, 145: 351-358.
[17] Dring M J. Light control of development in algae [J]. Ann Rev Plant Physiol Plant MolBiol, 1988, 39: 173-177.
[18] Sanchz Saavedra M P, Voltolina D. Effect of blue green light on growth rate and chemical composition of three diatoms [J]. J Appl Phycol, 1996, 8: 131-137.
Research on the photosynthetic efficiency of seven strains ofPorphyra yezoensisunder different conditions
ZHAO Xiao-bo1, ZHANG Xue-cheng1, XU Pu2
(1. college of Marine Life Sciences, Ocean University of China, Qingdao 266003, China;
2. Biology and Food engineering department, Changshu Institute of Technology, Changshu, 215500, China)
Photosynthetic efficiency of seven strains ofPorphyra yezoensisunder different salinities, pH, light quality,concentrations of phosphorus and nitrogen was investigated by mini-PAM, and the content of the photosynthetic pigments was also measured in the experiment. Results showed that the salinities between 20 and 30 were better forPorphyra yezoensis, and in this range, the sample could keep a high grade of Fv/Fm. The fitting pH forPorphyra yezoensisis 8.0.The result varies when the sample was irradiated by different light quality. The sequence of photosynthetic efficiency among different light quality is white>green>red>blue; The optimum concentration of phosphorus was 0.05 - 0.15 mg/L, and that of nitrogen was 1.0-1.5 mg/L. In all samples, while the content of PE was greater than other phycobiliprotein, there is no different content of chlorophyll.
Porphyra yezoensis;photosynthetic efficiency;photosynthetic pigments
Q949.29 文献标示码:A
1001-6932(2010)06-0623-06
2009-09-21;收修改稿日期:2010-01-20
国家高技术研究发展规划项目(2006AA10A314)
赵小波(1984—),男,山东青岛人,硕士研究生,主要研究方向:海藻遗传学,电子邮箱:wolfzhao@126.com。
张学成(1940—),电子邮箱:xczhang@ouc.edu.cn。
