银/聚吡咯纳米复合材料的制备与结构表征
2010-12-28罗青枝李雪艳王德松
安 静,罗青枝,李雪艳,王德松
(河北科技大学理学院,河北石家庄 050018)
银/聚吡咯纳米复合材料的制备与结构表征
安 静,罗青枝,李雪艳,王德松
(河北科技大学理学院,河北石家庄 050018)
以硝酸银和吡咯为原料,采用一步法制备Ag/PPy纳米复合材料,考察了单体用量、原料配比等因素对制备纳米复合微球的影响,运用扫描电镜(SEM)、紫外分光光度计(UV)、红外光谱仪(FTIR)和X射线衍射(XRD)等手段对纳米微球进行了表征。结果表明:银/聚吡咯纳米复合粒子具有棒状结构,聚吡咯对银纳米粒子进行了包覆;复合粒子圆球头部的平均直径为300~500 nm,银纳米粒子在复合微粒中呈面心立方的晶体结构;制备纳米复合粒子时,吡咯与硝酸银较适宜的物质的量比为0.9∶1。
银纳米粒子;导电聚合物;聚吡咯;核壳结构;纳米复合材料
一维、二维和三维的金属纳米粒子尤其是贵金属的纳米粒子具有优良的光、电和催化性能。然而,金属纳米粒子易发生团聚,而且在空气中容易被氧化[1-3]。因此,在金属纳米粒子表面包覆高聚物材料,可以延长它在空气中的稳定性。但是,通用高聚物包覆层的绝缘性影响了金属纳米粒子固有的电性能[4-5]。近年来,银/导电聚合物核壳结构复合微球越来越受到人们的关注[6]。采用导电高聚物包覆金属纳米粒子不仅可以延长金属纳米粒子在空气中的稳定性,保持金属纳米粒子的导电性能,同时金属纳米粒子也可以改善导电高聚物的强度和加工性能。这种以金属纳米粒子为核、导电高聚物为壳的纳米复合材料,在纳米微电子和纳米电路等领域具有潜在的应用前景[7-12]。
在化学法氧化吡咯单体聚合的反应中,Ag+到Ag0单质的标准氧化还原电位为0.800 eV。因此,从动力学角度来说,AgNO3具有氧化吡咯单体聚合的能力。根据氧化还原反应原理可知,吡咯单体和AgNO3之间发生氧化还原反应一步即可得到银/聚吡咯纳米复合材料。笔者在水溶液中利用氧化还原反应制备具有规则核壳结构的银/导电聚合物纳米微球,即用一步法制得具有核壳结构的银/聚吡咯(Ag/PPy)纳米复合微球,考察影响微球尺寸的各种影响因素,采用扫描电镜(SEM)、紫外分光光度计(UV)、红外光谱仪(FTIR)和X射线衍射(XRD)对复合纳米粒子的微观结构、形貌和性能进行了表征。
1 实验部分
1.1 主要药品
硝酸银,分析纯,天津市光复精细化工研究所提供;吡咯,分析纯,北京化学试剂公司提供;过硫酸铵,分析纯,北京化学试剂公司提供;聚乙烯吡咯烷酮K-30,分析纯,国药集团化学试剂有限公司提供;无水乙醇,化学纯,天津市永大化学试剂开发中心提供。
1.2 制备方法
银/聚吡咯纳米复合微球的制备方法如下:在室温25℃下,在250 m L锥形瓶中同时加入一定量的吡咯单体、PVP(聚乙烯吡咯烷酮)水溶液和硝酸银水溶液,磁力搅拌48 h,对产物进行离心分析,分别用无水乙醇和去离子水洗涤数次,最后放入真空干燥箱中于60℃下烘干48 h,得到黑色复合纳米粒子粉末。
1.3 表征
样品的高分辨形貌表征在S-4800Ⅰ冷场发射高分辨率扫描电镜上进行,加速电压为200 kV;样品的紫外吸收峰由UV-2501PC型紫外-可见分光光度计(日本岛津公司提供)获得;晶型表征采用Rigaku D/maxγA型X射线衍射仪(产地为日本)测试,扫描速率为0.06°/s,角度范围为10°~90°;红外光谱采用IR Prestige-21型傅里叶红外变换光谱仪测定,样品采用KB r盐压片制得。
2 结果与讨论
2.1 吡咯与硝酸银物质的量比对银粒子粒径的影响
固定吡咯单体的用量为0.6 m L,PVP的用量为0. 2 g,改变吡咯与硝酸银的物质的量比为0.3∶1,0.6∶1, 0.9∶1,1.2∶1,反应完全后得到银/吡咯胶体。在吡咯与硝酸银不同的物质的量比条件下,于350~550 nm波长段测定所得复合物胶体的紫外光吸光强度,结果如图1所示。
由图1可以看出,所得各复合物胶体在稀释相同倍数时,除了吡咯与硝酸银的物质的量比为0.3∶1时的最大吸收波长为550 nm外,物质的量比在0.6∶1,0.9∶1,1.2∶1时最大吸收波长均为450 nm,因此说明了生成的银粒子为纳米级的[17],吡咯与硝酸银的物质的量比在此范围内吸光强度逐渐增大,且在物质的量比为0.6∶1和0.9∶1时,复合物胶体可稳定存在48 h以上,而物质的量比为1.2∶1时仅能稳定存在36 h,所以吡咯与硝酸银的物质的量比为0.9∶1是较理想的值。出现此结果的原因是:在吡咯用量相对较少时,被还原出的银晶核很少,且由于反应缓慢,晶体有充足的时间成长为粒径较大的非纳米粒子;随着吡咯用量的增加,产生的银晶核增多,且反应速度较快,最终生成粒径较小的银纳米粒子,但还原剂的量过多时,反应速度太大,产生的纳米粒子较小,长时间放置部分粒子会团聚成较大晶体。
2.2 吡咯的用量对银粒子粒径的影响
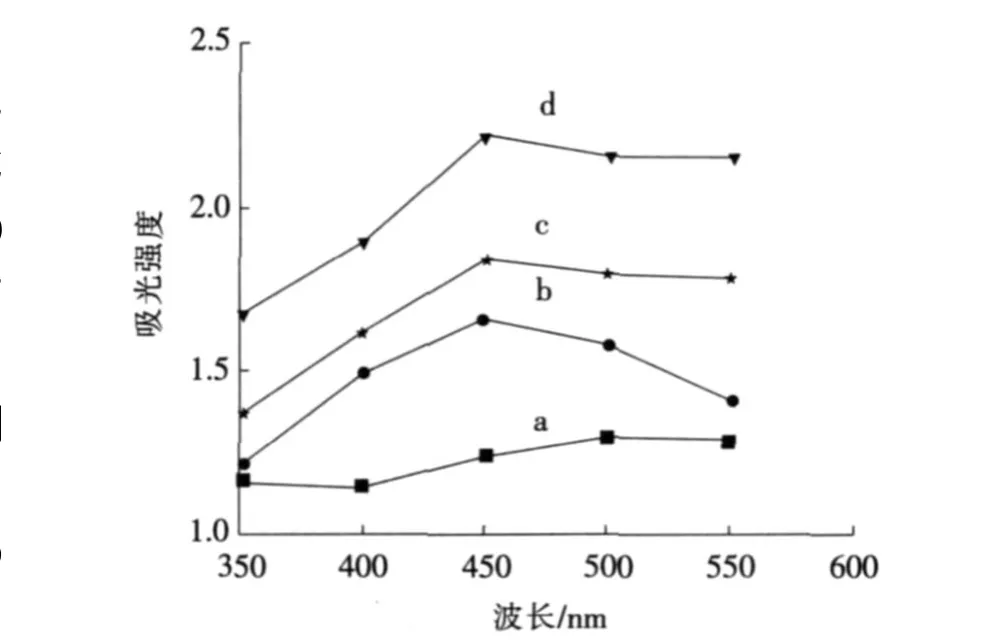
a—吡咯与硝酸银的物质的量比为0.3∶1; b—吡咯与硝酸银的物质的量比为0.6∶1; c—吡咯与硝酸银的物质的量比为0.9∶1; d—吡咯与硝酸银的物质的量比为1.2∶1
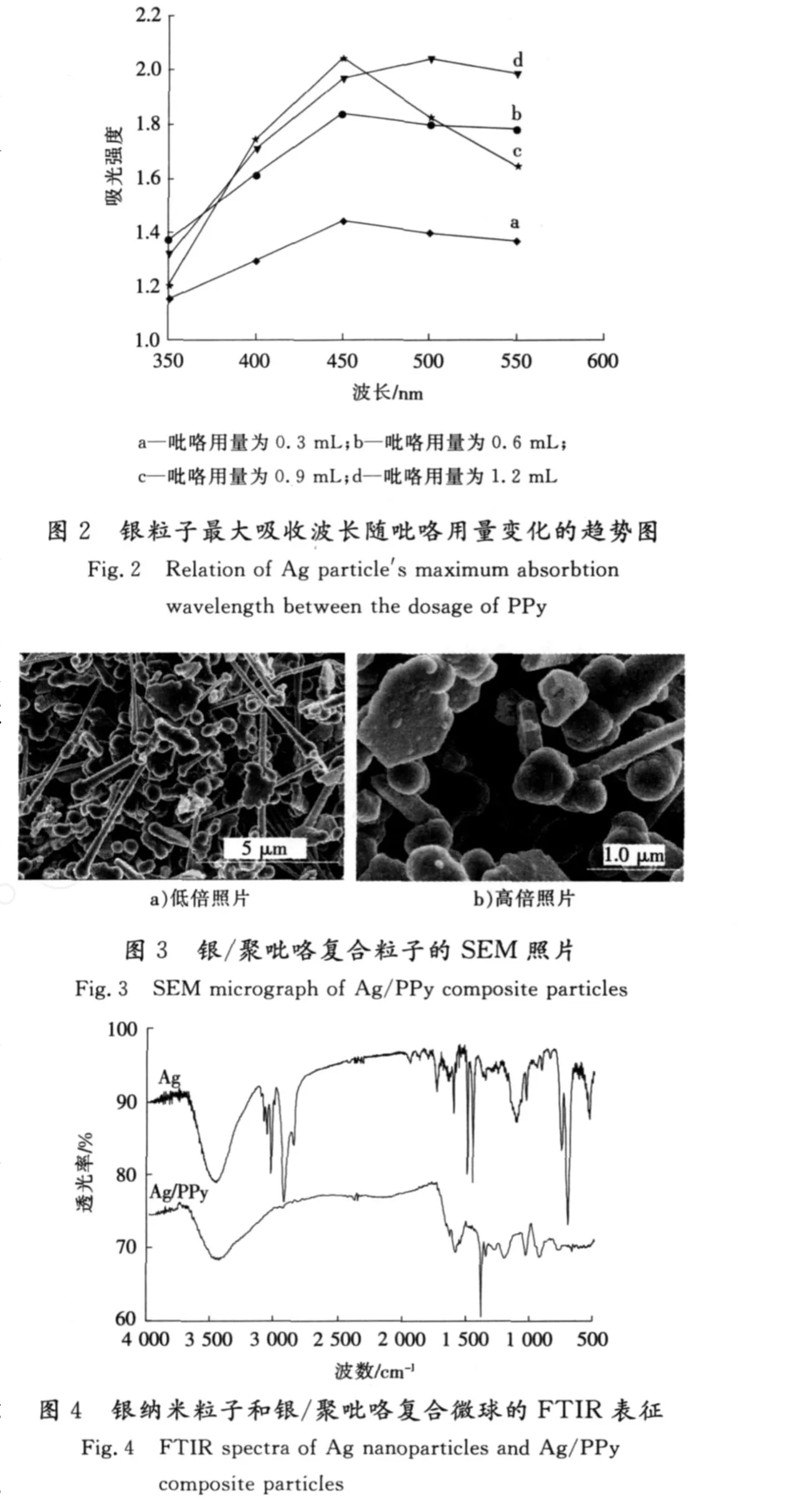
固定吡咯与硝酸银的物质的量比为0.9∶1,PV P的用量为0.2 g,改变吡咯的用量为0.3,0.6,0.9,1.2 m L,分别得到银/吡咯复合胶体。不同吡咯用量条件下,在350~550 nm波长段测定所得复合物胶体紫外光吸光强度,结果如图2所示。
由图2可知,不同的吡咯用量所得复合胶乳稀释相同倍数时,除了用量在1.2 m L时的最大吸收波长在500 nm外,用量为0.3, 0.6,0.9 m L时最大吸收波长都为450 nm,因此生成的银粒子为纳米级。而且在此范围内随着吡咯用量的增多,吸光强度增大,所以0.9 mL是较理想的吡咯用量[17]。出现此结果的原因是:随着吡咯用量的增加,生成的银晶核逐渐增多,但银离子量一定,因此最终生成较多的小粒径银纳米粒子;但还原剂的量过多时,较小粒径的纳米粒子由于存在高表面能,发生大规模团聚而生成了非纳米银粒子。
通过以上分析可知,实验控制吡咯的适宜用量为0.9 mL,吡咯与硝酸银的物质的量比为0.9∶1。
2.3 性能表征
2.3.1 银/聚吡咯纳米复合微球的SEM分析
图3是在吡咯与硝酸银的物质的量比为0.9∶1,吡咯的用量为0.9 m L,即吡咯单体浓度为0.5 mol/L时所得产物的SEM照片。从图3 a)可以看出,体系中形成了大量的银/聚吡咯棒状复合粒子;从图3 b)可估算出棒状粒子的圆球头部平均直径为300~500 nm。黑色的银纳米粒子被聚吡咯包覆成核壳结构位于复合粒子的头部[18]。
2.3.2 银/聚吡咯复合粒子的FTIR分析
图4是样品银/聚吡咯纳米复合粒子和银的FTIR谱图。从图4曲线可观察到Ag和A g/PPy的FTIR图在3 400,1 586和1 385 cm-1处都有相应的吸收峰,而1 586 cm-1和1 385 cm-1处为吡咯环的特征峰, 3 400 cm-1处对应N—H键振动峰[19]。此结果说明聚吡咯包覆在银纳米粒子的表面。
2.3.3 银/聚吡咯复合微球的XRD表征
图5是银/聚吡咯复合粒子的XRD图。从图5可以看出复合物中银纳米粒子为面心立方晶型,在2θ值分别为38.16°,44.28°,64.38°,77.74°时出现4个分别对应于(111),(200),(220)和(311)晶面的衍射峰[20]。与纯银纳米粒子衍射峰的位置一致,这说明所得包覆在银纳米粒子表面的聚吡咯并没有影响银粒子的晶型。
3 结 语
采用一步法将硝酸银和导电聚合物——吡咯复合制备纳米复合粒子,通过UV,SEM,FTIR,XRD表征手段,对银/聚吡咯纳米粒子的结构进行了表征与分析。UV分析结果表明,吡咯单体与硝酸银的物质的量比为0.9∶1,合成体系中吡咯单体的浓度为0.5 mol/L时可制得银/聚吡咯纳米复合粒子;SEM和FTIR分析结果表明,生成的银/聚吡咯纳米粒子呈棒状核壳结构,银粒子被包覆在聚吡咯中;XRD分析结果表明,银纳米粒子在复合微粒中的晶型结构为面心立方。

图5 银纳米粒子和银/聚吡咯纳米复合粒子的XRD图Fig.5 XRD patterns of Ag nanoparticles and Ag/PPy composite particles
[1] 陈爱华.银-聚吡咯纳米复合材料的制备、表征和性能研究[D].北京:北京化工大学,2005.
[2] MARCELA M,ERYZA G,CARLA D,et al.A simple two-phase route to silver nanoparticles/polyaniline structures[J].J Phys Chem B, 2006,110(3):17 063-17 069.
[3] EN IKO P,RITA P,TAMAS F,et al.Characterization of polypyrrole silver nanocomposites p repared in the p resence of different dopants [J].J Phys Chem B,2005,109(8):17 474-17 478.
[4] 陈爱华,王海侨,赵 彬,等.Fe3O4/聚吡咯复合材料的制备及表征[J].复合材料学报(Acta Material Compositae Sinica),2004,21(4): 157-160.
[5] ZHENG X W,ZHU L Y,X IE Y,et al.Congtrolling synthesis of silver nanow ires and dendrites in mixed surfactant solutions[J].Journal of Colloid and Interface Science,2003,268(2):357-360.
[6] M ILENA I,DAV ID L,SANDRINE L,et al.Immobilization of silver in polypyrrole/polyanionmposite coatings:Preparation,characterization,antibacterial activity[J].Langmuir,2003,19(3):8 971-8 979.
[7] 严东生,冯端主.材料新星——纳米材料科学[M].长沙:湖南科学技术出版社,1997.
[8] 曾 戎,章明秋,曾汉民.高分子纳米复合材料的制备、表征和应用前景[D].广州:中山大学,2004.
[9] CAO Y,DA IW L,DENGJ F.The oxidative dehydrogenation of methanol over a novel Ag/SiO2catalyst[J].App lied Catalysis A:General, 1997,158(12):127-134.
[10] 李亚栋,贺蕴普,钱逸泰.银纳米粒子的制备及其表明特性研究[J].化学物理学报(Chinese Journal of Chemical Physics),1999,12(4): 465-469.
[11] 金国山,周忠清,陶国忠.乙烯环氧化反应中银催化剂的研究动向[J].精细石油化工(Speciality Petrochemicals),1998,3(2):1-4.
[12] ANNA D,SHWETA C,M ICHAEL K,et al.Fabrication and characterization of silver/polyaniline composite nanow ires in porous anodic alumina[J].Chem Mater,2007,19(16):4 252-4 258.
[13] GAO Y,SONG L,XIE SS.Silver nanow iresw ith five-fold symmetric cross-section[J].Journal of Crystal Grow th,2005,27(9):606-609. [14] L IX,GAO H,MURPHY C J,et al.Nanoindentation of silver nanow ires[J].Nano Letter,2003,3(11):1 495-1 501.
[15] SH IS,SUN J,ZHANG G,et al.The grow th of thin silver nanowires bundle using RbAg4 I5 crystal grain thin film and the ionic conductivity of the thin film[J].Physics B,2005,362(6):266-268.
[16] TEMPLETON C,PEITRON J J,MULVANEY R W.Solvent ref ractive index and core charge influences on the surface p lasmon ahso rbance of alkanethiolate monolayer-p rotected gold clusters[J].J Phys Chem B,2000,104(3):10 564-10 570.
[17] 蒋鹤麟,祁更新,夏文华,等.银合金及银复合材料的技术发展[J].贵金属(Precious Metals),2000,21(3):56-59.
[18] CHANDRASEKHARAN N,KAMA T P V.Imp roving the photo electrochemicial performance of nanostructured TiO2films by adsorption of gold nanoparticles[J].J Phys Chem B,2000,104(3):10 851-10 857.
[19] SCHUELER P A,IVESJ T,DELACROIX F,et al.Physical structure,optical resonance,and surface-enhanced raman scattering of silverisland films on suspended polymer latex particles[J].Anal Chem,1993,65(8):3 177-3 179.
[20] ZABALA N,PUSKA M J,N IEM INEN R M.Spontaneous magnetization of simple metal nanowires[J].Phys Rev Lett,1998,80(6): 3 336-3 340.
[21] 黄艳娥.纳米TiO2的表面处理方法及改性效果表征[J].河北工业科技(Hebei Journal of Industrial Science and Technology),2001,18 (2):7-10.
[22] 封顺珍,咸立芬,徐 芹,等.C/Co/C纳米颗粒膜微结构和磁特性的时效性研究[J].河北科技大学学报(Journal of Hebei University of Science and Technology),2010,31(1):5-8.
Preparation and structure characterization of silver/polypyrrole nanocomposites
AN Jing,LUO Qing-zhi,L IXue-yan,WANG De-song
(College of Sciences,Hebei University of Science and Technology,Shijiazhuang Hebei 050018,China)
Ag/Polypyrrole(Ag/PPy)nanocomposites were p repared w ith silver nitrate and pyrrole as materials by one-step method and the effects of the monomer dosage and the ratio of raw materials on nanocomposite microspheres were surveyed. The nanoparticleswere characterized by UV-visible spectra,transmission electronmicroscopy,Fourier transfo rm inf rared spectroscopy,and X-ray diffraction.Results show that Ag/PPy nanocompositemicrospheres are all of core-shell structure,and the average size is 300~500 nm;silver nanoparticles are in the face-centered cubic crystal structure.In the synthesis system the mo re app rop riate molar ratio of PPy and AgNO3is 0.9∶1.
silver nanoparticles;conductive polymer;polypyrrole;co re-shell structure;nanocomposites
O614.122
A
1008-1542(2010)05-0409-04
2010-03-10;
2010-05-24;责任编辑:张士莹
安 静(1973-),女,河北巨鹿人,讲师,博士,主要从事纳米材料方面的研究。
王德松教授,E-mail:dswang06@126.com
