茶树叶片蛋白的SDS-PAGE分析
2010-12-24张立明王云生高丽萍夏涛
张立明,王云生,,高丽萍⋆,夏涛
(1.安徽农业大学生命科学学院,合肥 230036;2.农业部茶叶生物化学与生物技术重点实验室,合肥 230036)
SDS-PAGE(十二烷基磺酸钠-聚丙烯酰胺凝胶电泳),简称SDS电泳。它不需要昂贵的仪器设备,操作简便,能在几小时内得到结果,有较高的重复性,且不要非常纯的样品,是目前为大家所接受的用于测定亚基分子量的一种最好方法。这个方法可用于多肽分子量的分析,用于变性蛋白的分离以及仅溶解在离子去污剂中的膜蛋白和用层析方法分离的蛋白和酶的纯化控制[1]。蛋白提取是进行蛋白质组学研究的前提和基础,全叶蛋白的提取方法主要有冷丙酮沉淀法、TCA沉淀法、TCA-丙酮沉淀法、Tris-丙酮法等。目前,多种植物的鲜叶蛋白提取及分离都获得了良好效果,如棉花叶蛋白[2]、水稻叶蛋白[3,4]、玉米叶蛋白[5]、杨树叶蛋白[6]等。与悬浮细胞相比,植物组织样品由于富含色素、酚、脂类、醌类、多糖及其他多种次生代谢物,因而较难获取纯净的蛋白质[7-9]。茶叶中含有大量的多酚类物质(占干重18%~36%)[10],它们与其他物质一起,干扰SDS-PAGE分析,造成电泳结果不稳定和蛋白电泳谱带差异很大,电泳分析常不能获得满意的结果。
本实验对茶树鲜叶蛋白的提取和 SDS-PAGE的方法进行了比较,拟建立适合茶树鲜叶蛋白提取和SDS-PAGE的方法,并利用建立的方法对茶树鲜叶蛋白,不同处理蔗糖浓度处理的愈伤组织蛋白进行分析。
1 材料与方法
1.1 材料
茶树 (Camellia sinensis(L.) O.Kuntze.var.sinensiscultivar Shuchazao) 鲜叶采自安徽农业大学试验茶园。茶树愈伤组织为本实验室筛选的“云茎63Y”。茶树愈伤组织培养条件:以B5为基础培养基(pH5.5),25℃下暗培养,以21d为一个培养周期,蔗糖浓度为3%;茶树愈伤组织“云茎63Y”蔗糖处理蔗糖浓度为7%,其余条件同茶树愈伤组织培养条件[11]。
1.2 茶树叶片蛋白质的提取制备
1.2.1 TCA-丙酮沉淀法[12-15]
取0.5 g鲜叶,液氮冷冻,研磨至粉状,加入0.5 g水不溶性PVP,10倍-20℃预冷的TCA-丙酮(含1mmol/L EDTA,10% TCA,和0.07%β-巯基乙醇)溶液,涡旋后静置于-20℃下,沉淀蛋白过夜;离心(4℃, 15000×g,30min),弃上清,沉淀再次悬浮于-20℃预冷的丙酮溶液(含0.07 %β-巯基乙醇)中2h,离心(4℃, 15000×g,30min),重复3~4次;沉淀静置于-20℃下24 h,充分挥发丙酮,制成蛋白丙酮干粉,-20℃保存备用。
准确称取蛋白丙酮干粉50 mg,置于7 ml离心管中,加入1 ml裂解液(含9.5 mol/L Urea,2.0 %(V/V) NP-40(Nonidet P-40),40 mmol/L DTT),涡旋振荡,37 ℃水浴1.5 h,离心(4℃, 15000×g,30min),上清液用于蛋白质电泳分析。蛋白质含量检测按照Ramagli改进的Bradford法[15]进行。
1.2.2 冷丙酮沉淀法[17]
丙酮取代TCA-丙酮进行蛋白沉淀,其余步骤同1.2.1。
1.2.3 TCA沉淀法[17]
利用 20%TCA进行蛋白沉淀。鲜叶液氮冷冻,研磨至粉状,加入0.5g水不溶性PVP,10倍20%TCA后室温下静置过夜,其余步骤同1.2.1。
1.2.4 Tris-丙酮法[6]
取0.5 g鲜叶液氮冷冻,研磨至粉状,加入0.5 g水不溶性PVP,4倍体积蛋白提取缓冲液(62.5 mmol/L Tris-HCl,pH6.8,0.5 % SDS,10 %甘油和5 % β-巯基乙醇),涡旋震荡,4℃下静置过夜,离心(4℃, 15000×g,30min),上清加入2.5倍体积-20℃预冷的丙酮溶液(含 0.07%β-巯基乙醇),-20℃静置 1 h,离心(4℃, 15000×g,30min),重复3-4次;沉淀静置于-20 ℃下24 h,充分挥发丙酮,制成蛋白丙酮干粉。-20℃保存备用。加入上样液(12.5% 0.5mol/L Tris-HCl pH6.8,10%甘油,5%β-巯基乙醇,72.5%去离子水)溶解沉淀,沉淀充分溶解后,离心(4℃, 15000×g,30min),取上清液即为待测蛋白溶液。蛋白质含量检测按照Bradford 法[18]进行。
1.3 茶树蛋白质的SDS-PAGE凝胶电泳
1.3.1 凝胶制备及电泳
本实验采用了连续电泳和不连续电泳两种方式进行电泳,连续电泳和不连续电泳的分离胶浓度均为12.5%,不连续电泳的浓缩胶浓度为3.9%[19]。上样前取待测蛋白溶液,按体积比1:1加入上样缓冲液(100mmol/LTris-HCl,pH6.8,4%SDS,0.2%溴酚蓝,200mmol/Lβ-巯基乙醇,20%甘油)。混匀并在95℃以上沸水中处理5min。点样前离心(10000×g,5min),以减少蛋白质条带的拖尾现象[16]。
本实验比较了采用高、低压转换的连续电泳法和不连续电泳法,在不连续电泳过程中,还比较了横流和恒压两种方式,并且在浓缩胶中的电压或电流都比分离胶中的小。在上样前,先在恒压150V或横流35mA条件下预电泳30min。预电泳结束后在点样孔中点入适量待测蛋白溶液,再按表1电泳参数分别进行电泳,直至溴酚蓝离胶底1cm为止,时间约3.5h。

表1 电泳参数设定
1.3.2 染色及分析
电泳结束后,采用可兼容质谱分析的银染法[20]进行染色。染色结束后,立即对凝胶进行拍照,拍照后用BandScan5.0软件进行相应的处理分析,并结合蛋白分子量标准估算相应蛋白条带表观分子量。
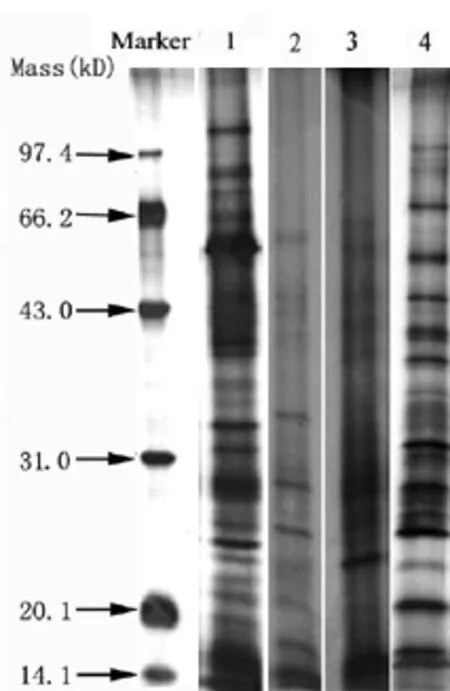
图1 茶树鲜叶四种蛋白提取方法的比较
2 结果与分析
2.1 茶树叶片蛋白电泳体系的建立
2.1.1 不同蛋白提取方法的比较
本实验比较了TCA-丙酮沉淀法、冷丙酮沉淀法、TCA沉淀法和Tris-丙酮法四种提取方法对茶树鲜叶蛋白的提取效果,表2及图1结果显示四种提取方法存在较大差异,其中TCA-丙酮沉淀法的蛋白提取效果最好,不仅蛋白质提取得率高,而且蛋白条带多且清晰;其次是Tris-丙酮法,蛋白质条带清晰,杂质少,但是蛋白的提取得率较低;其他两种沉降方法,蛋白的提取得率低,杂质较多,条带少且不够清晰。利用优化的TCA-丙酮沉淀法,提取愈伤组织“云茎63Y”的蛋白含量为14.6 mg/gFW,也取得了良好的电泳效果(见图2,B1),说明TCA-丙酮沉淀法也适合茶树愈伤组织蛋白的提取。
为了减少茶树鲜叶当中的杂质对电泳的干扰,在林金科等[16]的茶叶蛋白提取方案中,蛋白丙酮干粉经过了裂解液溶解、上清液经预冷丙酮(含5mmol/Lβ-Me)再沉淀,沉淀再用裂解液复溶的过程,本实验通过比较发现(图2),该方案会使蛋白含量损失很多(用丙酮重沉淀再溶解后的蛋白量为重沉淀前的1/3),但由于茶树鲜叶中含有的多酚类等杂物质较多,通过丙酮重沉淀会使杂物含量降低,并且对茶树鲜叶蛋白条带数的影响不大。而茶树愈伤组织含有的杂质要远远低于茶树鲜叶,不用丙酮重沉淀即可,丙酮重沉淀会使低于40KD蛋白分子条带颜色变浅或条带缺失。
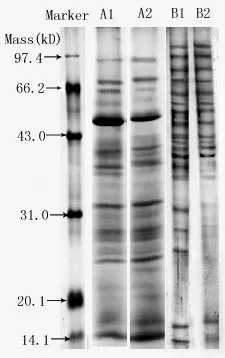
图2 冷丙酮重沉淀蛋白液对电泳条带影响的SDS-PAGE电泳图

表2 四种提取方法对茶树鲜叶蛋白质提取的影响
2.1.2 不同电泳方式的比较
SDS-PAGE垂直板电泳分为只有分离胶的连续电泳和带有浓缩胶的不连续电泳。浓缩胶的孔径要远远地大于分离胶的孔径,由于不同孔径凝胶的分子筛作用,使不连续电泳的分辨率大大高于连续电泳[1]。颜廷进等人[21]使用连续电泳,先将电压设为低电压进行电泳,待蛋白形成单一的界面层后再改设高压进行电泳,通过这种高、低压转换法取得了良好的电泳效果。本实验比较了采用高、低压转换的连续电泳法和不连续电泳法,在不连续电泳的过程中,还比较了横流和恒压两种方式(图3)。结果表明,不连续电泳比连续电泳的蛋白质分离效果好,条带清晰,条带数多。对于不连续电泳的恒压和横流两种方式,通过比较发现这两种方式的条带数差别不大,但在条带清晰度上,恒压要好于横流。
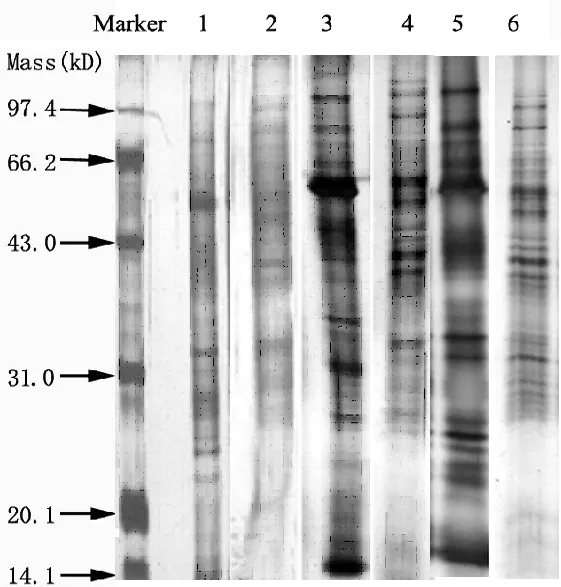
图3 连续电泳和不连续电泳SDS-PAGE电泳图谱的比较
另外,我们还比较了不同分离胶浓度(11%,12%,12.5%,13%)、不同浓缩胶浓度(5%,3.9%)的影响,发现比较适宜的分离胶浓度为 12.5%,浓缩胶浓度为3.9%。
2.2 用优化的方法分析蔗糖浓度对“云茎63Y”愈伤组织蛋白质表达的影响
蔗糖是主要的诱导植物细胞积累次生产物的因子之一。为了研究茶树愈伤组织儿茶素合成的调控,我们研究了蔗糖浓度对“云茎 63Y”愈伤组织儿茶素合成代谢的影响。以 3%蔗糖浓度为对照,7%蔗糖浓度处理一周期后,利用优化的蛋白提取和电泳方法比对了蔗糖诱导前后“云茎 63Y”的蛋白表达的差异,结果见图4。比对图谱分析发现,7%蔗糖处理后蛋白表达产生变化,分子量在 28kD~33kD间有几处明显差异条带。利用BandScan 5.0软件进行分析,差异条带的特性见表3。

图4 蔗糖处理对“云茎63Y”愈伤组织蛋白表达的影响

表3 蔗糖处理对“云茎63Y” 愈伤组织蛋白表达的影响
3 讨论
本实验通过比较研究,确立了适合茶树鲜叶蛋白的提取、定量、凝胶制备、电泳、凝胶染色技术。样品制备是电泳成功的关键环节,茶树当中含有大量的多酚类、色素和其他物质,这些成分使SDS-PAGE分析受到了很大的干扰,电泳分析常不能获得满意的结果,通过对茶树鲜叶蛋白的提取及SDS-PAGE方法进行比较,结果表明TCA-丙酮沉淀法可以有效避免茶树鲜叶中的杂物对蛋白的影响,适合茶树鲜叶蛋白的提取,并且在茶树愈伤组织蛋白的提取中也取得了良好效果。
本实验在研究过程还做了如下改进:(1)为了减少多酚类等杂物的影响,在提取过程中加大水不溶性PVP的量,在实验中按鲜叶鲜重1:1加入PVP,去除多酚类物质对电泳的干扰。(2)利用液氮充分研磨鲜叶,在液氮刚散去时,应立即加入蛋白提取液;为了尽可能地消除蛋白酶对蛋白的降解,在提取液中加入蛋白酶抑制剂EDTA。(3)对于蛋白浓度的测定,一般采用Bradford法,该法是根据考马斯亮蓝G-250和蛋白质的结合来定量的,但裂解液中含有的尿素,会影响G-250和蛋白的结合。为了消除尿素的影响,在蛋白含量测定时采用的是Ramagli改进了的Bradford法。该方法在标准曲线绘制和样品浓度测定中,先用0.1mol/L的盐酸来中和样品,这样会使测定的结果更为准确。(4)浓缩胶对于提高蛋白分辨率起着至关重要的作用,操作中再结合高低电压交替,在浓缩胶中采用低电压,分离胶中采用较高电压进行电泳可以起到更好的蛋白分离效果。(5)电泳实验中,通常采用的是恒压和横流两种参数设定,蛋白在胶中迁移的速率是与电压成正比的,在电泳的过程中,整个电路会产生大量的热,使电路的电阻变大,若采用横流的方式进行电泳,会使整个电路的电压逐渐变大,造成蛋白的速率越来越大,极大地降低分辨率,若采用恒压的方式进行电泳会避免这种情况的出现。
通过多次重复试验,发现利用该蛋白提取及电泳方法,提取的蛋白量大,分离的蛋白杂质少,条带多、清晰,而且重复性和稳定性良好。利用这一优化方法对不同蔗糖浓度处理的愈伤组织蛋白进行了研究,找到了差异条带,为进一步进行茶树鲜叶和茶树愈伤组织的蛋白质组学研究奠定了基础。
[1]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社, 2001,141~144,66.
[2]沙月霞,简桂良等.棉叶总蛋白提取及SDS-PAGE电泳的改良[J].棉花学报,2005,17(3):146~150.
[3]王玉琪,彭新湘.适用于水稻叶片蛋白质组分析的双向电泳技术[J].植物生理与分子生物学学报,2006, 32 (2): 252~256.
[4]钟伯雄.水稻蛋白质双向电泳分析新方法[J].浙江农业大学学报,1997,23(2):128~132.
[5]李冠军,付凤玲.玉米叶片总蛋白提取和双向电泳技术的改进玉米科学[J].2006,14(6):100~103.
[6]谷瑞升,刘群录,陈雪梅,等.木本植物蛋白提取和SDS-PAGE分析方法的比较和优化[J].植物学通报,1999,16(2):171~177.
[7]徐幼平,徐秋芳,蔡新忠.适于双向电泳分析的番茄叶片总蛋白提取方法的优化[J].浙江农业学报,2007,19(2):71~74.
[8]Granier F.Extraction of Plant Proteins for Two2dimensional Electrophoresis [J].Electrophoresis,1988,9: 712~718.
[9]Canovas F M,Dumas-Gaudo T E ,Recorbet G,Jonrrin J.Plant proteome analysis[J].Proteomics,2004 ,4 (2) :285~298.
[10]宛晓春.茶叶生物化学[M],北京:中国农业出版社, 2003(第三版),9~10.
[11]刘亚军,高丽萍,夏涛,高可君.茶悬浮培养细胞玻璃化超低温保存研究[J],茶叶科学,2009,29(2):120~126.
[12]Saravanan R S , Rose J K C.A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J].Proteomics ,2004, 4:2522~2532.
[13]Damerval C, Vienne D, ZivyM, et al.Technical Imp rovements in Two-dimensional Electrophoresis Increase the Level of Genetic Variation Detected inWheat-seedling Proteins [J].Electrophoresis,1986, 7: 52~54.
[14]王凤茹.双向凝胶电泳应注意的几个关键问题[J].生物技术通报,2005,(6):62~64.
[15]林金科,郑金贵,袁明,张学琴,等.茶树蛋白质提取及双向电泳的改良方法[J].茶叶科学,2003,23(1):16~20.
[16]夏其昌,曾嵘等.蛋白质化学与蛋白质组学[M],北京:科学出版社,2004, 91,278~279.
[17]钱小红,贺福初.蛋白质组学:理论与方法[M],北京:科学出版社,2003,50~52.
[18]王学奎.植物生理生化实验原理和技术[M], 北京:高等教育出版社,2006(第二版),190-192,159, 169~170.
[19]J.S.博尼费斯浓等.精编细胞生物学实验指南[M],北京:科学出版社,2007,509~510.
[20]Berkelman T, Stenstedt T.2-D Electrophoresis Principles and Methods[J].Uppsala:Handbooks from Amersham Biosciences,1998, 87.
[21]颜廷进,李群,杨平平,等.蛋白质电泳技术的改良及其应用效果[J].山东农业科学,1998,5:19~21.
