海藻酸纤维对水溶液中 Fe3+的吸附动力学研究
2010-12-22成芳芳孔庆山夏延致
成芳芳 孔庆山 纪 全 夏延致
(青岛大学纤维新材料与现代纺织国家重点实验室培育基地,山东青岛 266071)
海藻酸纤维对水溶液中 Fe3+的吸附动力学研究
成芳芳 孔庆山 纪 全 夏延致*
(青岛大学纤维新材料与现代纺织国家重点实验室培育基地,山东青岛 266071)
以海藻酸纤维作为吸附材料研究了纤维对水溶液中 Fe3+的吸附性能,用准一级动力学方程、准二级动力学方程、Elovich方程、粒子扩散方程、双常数方程和指数函数方程数学模型对不同 Fe3+浓度、吸附时间的吸附曲线进行分析,研究了其吸附的动力学机理。结果表明:在研究的浓度和条件范围内,准二级动力学模型、Elovich方程和双常数方程的拟合度较好,模拟值与实验值吻合较好,说明海藻酸纤维吸附 Fe3+是复杂的非均相扩散的化学吸附过程。粒子扩散方程表明颗粒内扩散不是控制海藻酸纤维吸附 Fe3+过程的唯一步骤,而是由膜扩散和颗粒内扩散联合控制。
海藻酸纤维 吸附 Fe3+动力学
海藻是一种丰富的海洋生物资源,海藻酸分子链上含有大量游离的羧基和羟基,与金属离子有较强的络合能力,能够通过络合及离子交换与金属离子形成稳定的螯合物。研究表明[1-5],海藻酸钠能够有效的用于重金属离子的吸附,但吸附后以沉淀或凝胶的形式分布在溶液中,回收困难。海藻酸纤维不仅吸附迅速、表面积大,而且回收后经过处理可以重复使用,节约成本,保护环境。Fe3+作为水体污染的重金属离子之一,其氧化物的还原直接影响其所吸附污染物的迁移释放,需要去除以实现水体净化。利用海藻酸纤维吸附水溶液中的 Fe3+是绿色有效的净化方式。
在 21世纪,模拟计算已成为化学工程研究的重要方法之一[6]。表观吸附动力学模型在描述吸附剂吸附净化水中重金属离子方面得到了广泛的应用。在各种吸附金属离子的表观吸附动力学模型中,准一级吸附动力学模型、准二级吸附动力学模型应用广泛,Elovich吸附速率模型、粒子扩散模型、双常数模型、指数函数模型[7-11]等也得到了应用。作者采用吸附动力学模型描述了海藻酸纤维对水溶液中 Fe3+的吸附。
1 实验
1.1 仪器与试剂
SHA-B型水浴恒温振荡器;670型火焰分光光度计;ZKF035型电热真空干燥箱。
海藻酸纤维:自制。置于烘箱中,50℃下烘干 2 h,放入干燥器中备用。
实验所用试剂均为分析纯。Fe3+溶液由 Fe(NO3)3·9H2O溶于蒸馏水配制。
1.2 吸附实验
准确称取一定量的海藻酸纤维放入 250 mL磨口锥形瓶中,加入 100 mL不同浓度的 Fe3+溶液,置于 25℃水浴恒温振荡器中震荡,不同时间取液过滤,滤液中的 Fe3+含量用 670型火焰分光光度计分析。根据质量守恒,由式 (1)计算海藻酸纤维吸附量(qt):
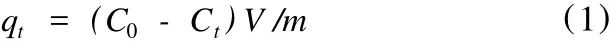
式中:C0——初始时间液相中的 Fe3+浓度;
Ct——给定时间t时的 Fe3+的浓度;
V——重金属溶液的体积;
m——体系中的吸附剂质量。
2 吸附动力学数学模型
2.1 准一级吸附动力学方程
描述准一级动力学模型可以用式 (2)表示:
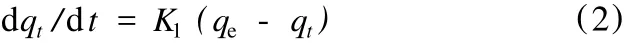
式中:qe——平衡吸附量;
K1——准一级吸附速率常数。
积分后得:
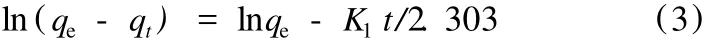
以 ln(qe-qt)对t作图如果能得到直线,说明其吸附机理符合准一级动力学模型。为了分析实验数据是否符合准一级动力学方程,必须知道qe。在许多情况下,qe并不知道,而且即使吸附量变化已相当慢,但其数值仍小于qe,甚至在许多情况下准一级动力学方程不能在全部时间范围内与实验数据符合。
2.2 准二级吸附动力学方程
准二级动力学表达式为:
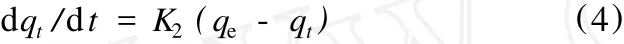
式中:K2——准二级吸附速率常数。
积分后得:
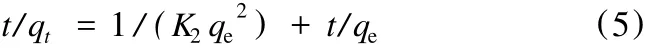
通过t/qt对t作图,若得出qe与K2的值越大,则意味着吸附速率越快。如果吸附过程符合准二级动力学模型,可得到一条直线。相对于准一级动力学模型,准二级吸附模型揭示整个吸附过程的行为而且与速率控制步骤相一致。
2.3 Elovich方程

式中:a——常数;
b——速率常数。
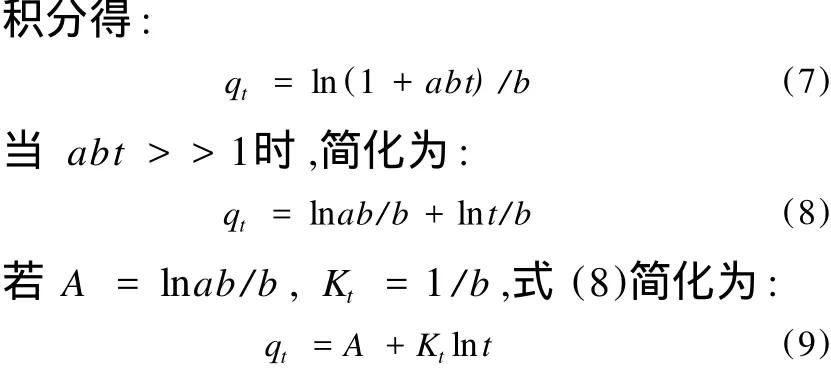
2.4 粒子扩散方程
粒子扩散方程可以简单地表示为:

式中:Kt——颗粒内扩散速率常数;C——粒子扩散方程常数。
2.5 双常数方程
双常数方程的线性形式为:
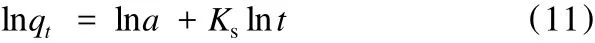
式中:Ks——吸附速率系数。
2.6 指数函数方程
指数函数方程的表达形式为:

式中:Kz——吸附速率常数。
各方程具有不同的物理化学意义:准一级模型基于假定吸附受扩散步骤控制,吸附速率正比于qe与t时刻qt的差值。准二级模型是基于假定吸附速率受化学吸附机理的控制,这种化学吸附涉及到吸附剂与吸附质之间的电子共用或电子转移。Elovich方程为经验式,它描述的是包括一系列反应机制的过程,如溶质在溶液体相或界面处的扩散、表面的活化与去活化作用等。因此,它对于单一反应机制的过程不适合,非常适用于反应过程中活化能变化较大的过程。此外,Elovich方程还能够揭示其他动力学方程所忽视的数据的不规则性。粒子扩散方程描述的是由多个扩散机制控制的过程,以qt对t1/2作图,可以得到分为二部分的一条曲线,曲线的开始呈斜线上升,然后呈水平直线,分别代表了吸附过程的 2个连续步骤。双常数速率方程又称 Freundlich修正式、幂函数方程,也是经验式。经实验应用表明,同样适合于反应过程较复杂的动力学方程。
季节变化对整个居住区的植物景观都是有影响的,气候和地理位置是居住区植物变化的决定性因素。由于中国横跨纬度大,所以各地区的环境气候差异也是十分明显的。与南方气候环境相比,北方气候环境最为突出的特点就是四季分明、冬季较长,季节变化影响很大。因此,在不同地理环境要注意因地制宜,研究出合适的植物配置方式[1]。
3 结果与讨论
3.1 Fe3+浓度和吸附时间
由图 1可以看出,随 Fe3+浓度的增加,qt增大,时间对吸附的影响不大。海藻酸纤维浸入溶液后在 10 min内达到吸附平衡,随时间的延长,没有明显的解吸附现象。
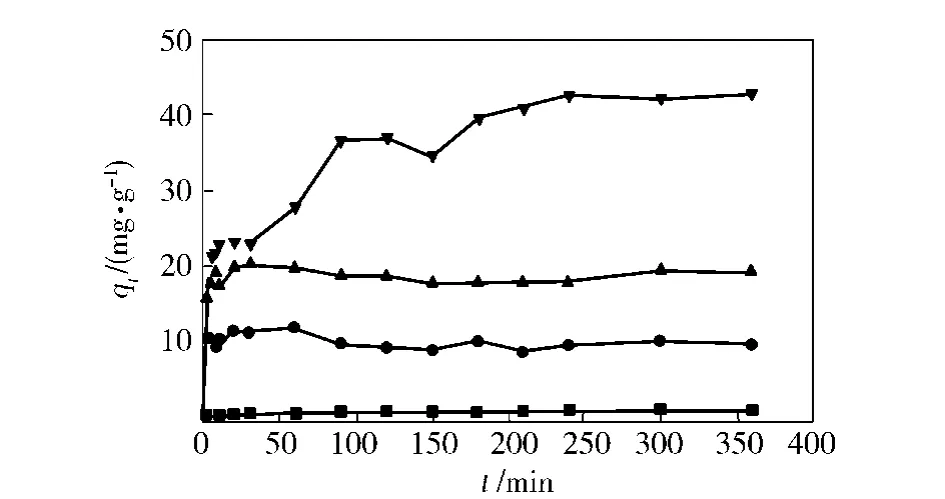
图 1 海藻酸纤维吸附不同浓度 Fe3+的吸附曲线Fig.1 Adsorption curves of alginic acid fiber for Fe3+of different concentration
3.2 海藻酸纤维吸附 Fe3+的动力学研究
利用准一级动力学方程、准二级动力学方程、Elovich方程、粒子扩散方程、双常数方程和指数函数方程等对海藻酸纤维吸附 Fe3+的实验数据进行拟合,见图 2。对数据进行线性回归分析,从斜率和截矩得到不同浓度下各个方程的动力学参数以及相关系数,结果见表 1。
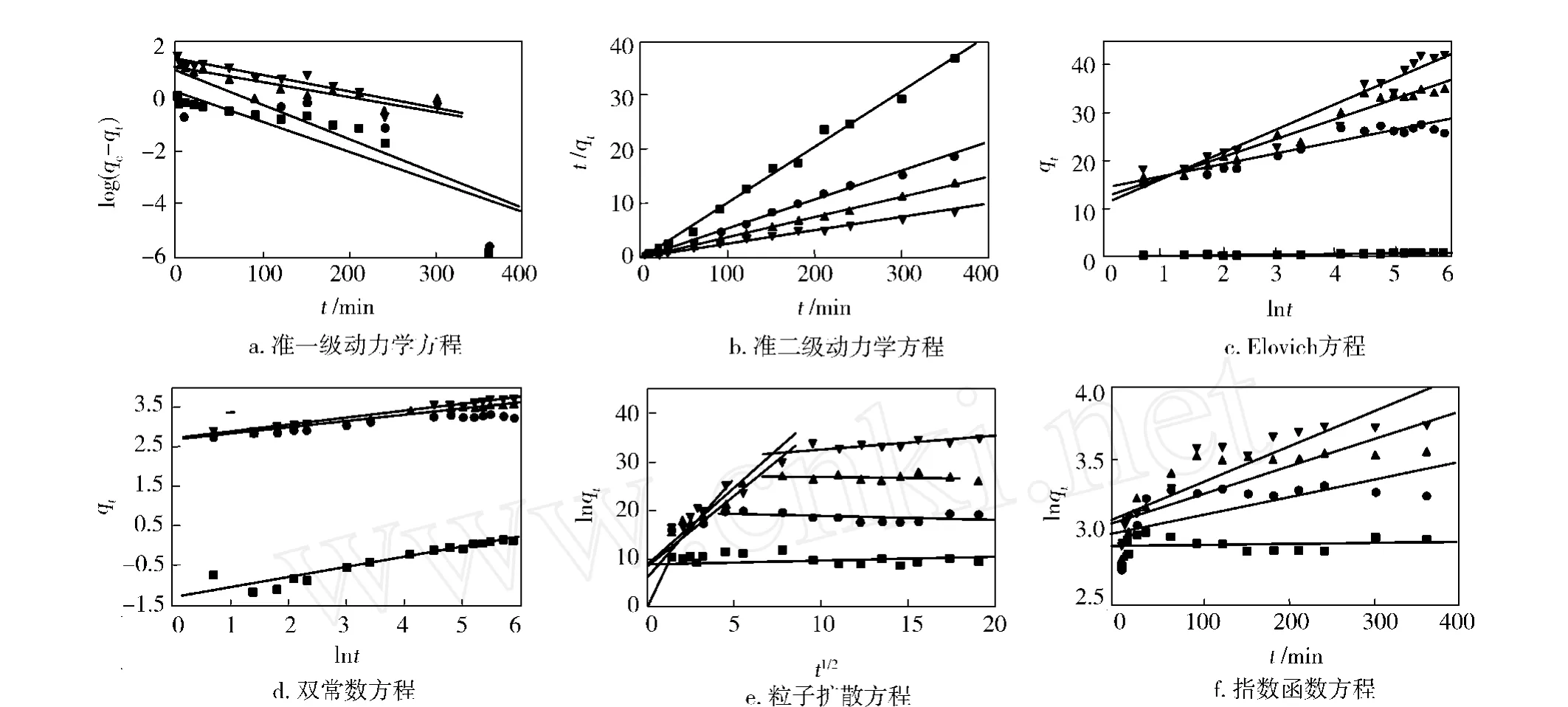
图 2 海藻酸纤维吸附不同浓度 Fe3+的吸附动力学方程Fig.2 Adsorption kinetics equations of alginic acidfiber for Fe3+of different concentrations
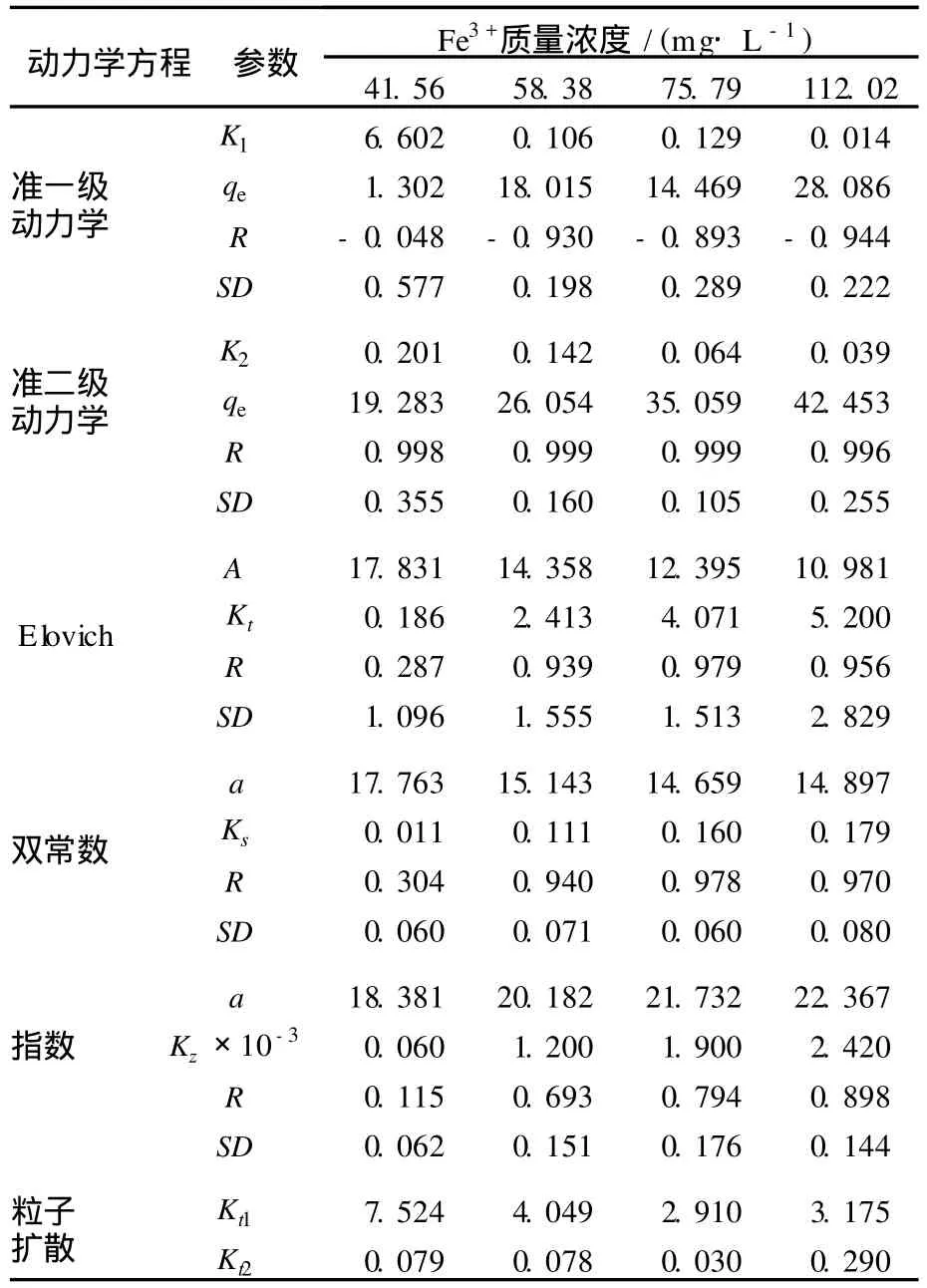
表 1 不同 Fe3+浓度下各个方程的动力学参数及 RTab.1 Kinetic parameters andRfor adsorption rate expressions at different Fe3+concentration
拟合结果中,用各模型线性化后所得线性方程的相关系数 (R)来检验拟合的显著性;用标准误差 (SD)来判断模型的优劣。
由图 2b和表 1可以看出,海藻酸纤维吸附Fe3+的准二级动力学模型的相关系数R值大于0.99,SD值较小,说明相关性很好,且由准二级方程计算出的 Fe3+的qe与实验值极为接近,这表明用准二级方程描述海藻酸纤维吸附 Fe3+的动力学行为较为合适,说明其吸附过程为化学吸附[12],拟合得出的K2随 Fe3+浓度的增大而减小,这可能是因为当增大溶液初始浓度,溶液中存在较多的 Fe3+,这些离子对吸附造成空间阻隔,以致吸附速度减慢,K2减小。
通过图 2c,d和表 1还可以看出,Fe3+浓度较大时,Elovich和双常数方程也有较好的拟合度,表明 Fe3+的吸附动力学也可以用 Elovich和双常数方程来描述,在动力学研究中类似的多解现象是较常见的。Elovich方程和双常数方程说明实验过程为复杂的非均相扩散过程。
由于准二级动力学方程不能确定吸附的机理,而粒子扩散方程可以用来描述金属离子的吸附过程。根据粒子扩散方程所作的海藻酸纤维吸附 Fe3+的qt对t1/2关系曲线见图 2e,在整个吸附时间内,图形不是一条直线,是分为二部分的一条曲线,表明了吸附过程的二个步骤。第一阶段表示 Fe3+扩散到纤维表面,即表面扩散过程;第二阶段为 Fe3+在海藻酸纤维孔隙内扩散,即颗粒内扩散过程。如果颗粒内扩散是控制吸附过程的唯一步骤,直线将通过原点,直线部分的斜率即为颗粒内扩散速率常数Kt[13]。图中海藻酸纤维吸附Fe3+的qt对t1/2曲线在第二阶段内为不通过原点的直线,说明颗粒内扩散不是控制海藻酸纤维吸附 Fe3+过程的唯一步骤,而是由膜扩散和颗粒内扩散联合控制。从图 2e还可以观察到,第一阶段直线的斜率较大(Kt1),表明表面扩散吸附过程很快。第二阶段直线接近水平,说明海藻酸纤维浸入溶液中在很短的时间内就达到了吸附平衡,且随时间的变化解吸附作用也没有明显增强。
4 结论
a.海藻酸纤维浸入溶液中在很短的时间内达到吸附平衡,Fe3+浓度增大,qt增大,延长吸附时间对吸附作用没有明显的影响,且随时间的延长解吸附作用没有明显增强。
b.海藻酸纤维对 Fe3+的吸附符合准二级动力学方程、Elovich方程和双常数方程,是一个复杂的非均相扩散的化学吸附过程,离子在海藻酸纤维表面及空隙内的扩散共同控制吸附速率。
[1] Zhu YM,Shen YB,WeiD Z.Adsorptiom of sodium alginate to Cu2+in disposalwater[J].J Ne Univ,2002,24(6):589-592.
[2] HoriaM N E,Manal FA T,AbdelW M E.Metal sorption and s welling characters of acrylic acid and sodium alginate based hydrogels synthesized by gamma irradiation[J].Nucl Instrum Methods Phys ResB,2008,266(11):2607-2613.
[3] Jodra Y,Mijangos F.I on exchange selectivitiesof calcium alginate gels for heavy metals[J].Water Sci Technol,2001,43(2):237-244.
[4] Yang H,NingQ J,Wu X R.The ion exchange and absorption of heavymetal on algin[J].I on Exch Adsorpt,2000,16(4):351-355.
[5] Wang K,He ZM.Study on adsorption equilibrium process of sodium alginate with calcium ionsor zinc ions[J].Chem Eng,2004,32(4):5-8.
[6] LiJ H.Perspectiveson chemical engineering in the 21stcentury[J].J Chem Ind Eng,2008,59(8):1879-1883.
[7] Rengaraj S,Kim Y,Joo C K,YiJ.Removalof copper from aqueous solution by aminated and protonated mesoporous aluminas:kinetics and equilibrium[J].J Colloid Interface Sci,2004,273(1):14-21.
[8] Ho Y S,McKay G.The kinetics of sorption of divalentmetal ions onto sphagnum moss peat[J].Water Res,2000,34(3):735-742.
[9] Panday K K,Prasad G,Singh V N.Copper(II)removal from aqueous solutions by fly ash[J].Water Res,1985,19(7):869-873.
[10]Cheung C W,Porter J F,Mckay G.Sorption kinetics for the removal of copper and zinc from effluents using bone char[J].Sep Purif Technol,2000,19(1-2):55-64.
[11]Chiron N,Guilet R,Deydier E.Adsorption of Cu(II)and Pb(II)onto a grafted silica:isother ms and kinetic models[J].Water Res,2003,37(13):3079-3086.
[12]Aksu Z.Determination of the equilibrium,kinetic and ther modynamic parameters of the batch biosorption of lead(II)ions onto Chlorella vulgaris[J].Process Biochem,2002,38(1):89-99.
[13]Lorenc-Grabowska E,Gryglewicz G.Adsorption of lignite-derived humicacids on coal-based mesoporous activated carbons[J].J Colloid Interface Sci,2005,284(2):416-423.
Adsorption kinetic studies of Fe3+onto algin ic acid fiber from aqueous solution
Cheng Fangfang,KongQingshan,JiQuan,Xia Yanzhi
(State Key Laboratory Cultivating Base of Advanced Fibers and Textile,Q ingdao University,Q ingdao266071)
The adsorption property of alginic acid fiber for Fe3+in aqueous solution were studied.The adsorption curves were analyzed at different Fe3+concentration and adsorption time usingLagergren-first order kinetic equation,Lagergren-second order kinetic equation,Elovich equation,intraparticular diffusion equation,double constant euqation and index function equation.The kinetic adsorption mechanism was studied.The results showed that the Lagergren-second-order equations,Elovich equation and double constant equation were fitwell and a good agreement between the calculated and experimental data was obtained,which indicated that the adsorption of Fe3+on alginic acid fiber is a complex heterogeneous diffusion chemical adsorption process.The intraparticular diffusion equation indicated that the adsorption rate of Fe3+on alginic acid fiberwas not controlled by the intraparticle diffusion only,but by the combination of film diffusion and intraparticle diffusion.
alginic acid fiber;adsorption;Fe3+;kinetics
TQ342.86 文献识别码:A
1001-0041(2010)02-0001-04
2009-09-01;修改稿收到日期:2010-01-15。
成芳芳 (1984—),女,硕士研究生。从事合成纤维及吸附方面的研究。
国家自然科学基金 (50908120)、山东省自然科学基金(Q2008B04)及泰山学者人才工程资助。
*通讯联系人(xiayzh@qdu.edu.cn)。
