空气污染组分H2O和CO2对乙烯燃烧性能的影响(II)——反应机理和动力学模拟
2010-12-12邵菊香谈宁馨刘伟雄李象远
邵菊香 谈宁馨 刘伟雄 李象远,*
(1四川大学化工学院,成都 610065;2宜宾学院计算物理重点实验室,四川宜宾 644000; 3中国空气动力研究与发展中心,四川绵阳 621000)
超音速燃烧冲压发动机用空气作为燃烧氧化剂从而推动飞行器前进.在高超声速飞行时,空气在燃烧室的停留时间通常只有几毫秒,要在这样短的时间内空气要完成压缩、增压,并与燃料在超声速流动状态快速高效地掺混、点火并燃烧是十分困难的,因此其燃料燃烧的点火延迟时间、燃烧平衡温度和最大压强等重要参数的研究是非常重要的.超音速燃料发动机的推进实验在进行空中飞行实验以前,要进行充分的地面实验,但地面实验的高焓实验空气常常采用燃烧加热方式获得,从而会使实验来流气体中除含有N2和O2外,还含CO2/H2O等污染组分,其污染组分对燃烧的影响具有非线性和理论建模复杂的特点,因此它们对燃烧的影响是很复杂的[1,2].要了解污染成分对燃烧特性的影响需要从化学反应动力学、热力学和流体力学等多方面去研究,并将实验与理论模拟相结合,找到污染组分影响燃烧性能的实质,从而为天地数据转换提供依据.
到目前为止,有不少的实验和理论研究人员报道了CO2/H2O污染组分对发动机燃料燃烧性能影响[1-8],但研究内容主要集中在污染组分对H2和CH4燃烧的影响,而很少报道对乙烯燃烧的影响.
乙烯是内燃机、燃气涡轮发动机和推进设备的烯烃类碳氢燃料.乙烯是碳氢燃料热裂解过程中优选的燃烧性能优良的富能小分子产物,也是碳氢燃料氧化的重要中间体[9-11],它的燃烧速度、反应速率和爆炸性能比绝大多数碳氢燃料大,因此,乙烯是提高爆震发动机和超声速燃料冲压发动机性能的可选燃料,常选用此燃料的燃烧进行实验研究.在以前的研究中[12-20],主要是用激波管研究乙烯的氧化特性.以前用实验方法研究乙烯氧化特性中,通常加入比乙烯和氧气的浓度更高的氩气作为反应的稀释剂,而乙烯-空气混合氧化自动点火特性的实验研究[15,18,20]比较少,乙烯在含有CO2/H2O污染的空气中燃烧的报道就更少.最近,Renard等[21]报道了乙烯-氧气-氩气燃烧时CO2/H2O组分对积碳的影响,刘伟雄等[22]报道了乙烯在含有CO2/H2O污染组分的空气中燃烧地面实验,用实验方法获得了火焰状态和燃烧室壁面压强受污染组分的影响情况,用模拟方法获得初始温度、压强和燃气比为定值,燃烧在均相绝热反应器模型中进行时,其污染组分对C2H4燃烧的影响.到目前为止,我们还没有见到,在初始温度、压强和燃气比改变时,乙烯在活塞流反应器模型中燃烧,其CO2/H2O污染组分对燃烧点火延迟时间和反应温度等的实验和数值模拟的研究报道.
C2H4在H2O/CO2污染的空气中燃烧时,可能有三个方面的原因影响C2H4燃烧性能:第一是空气中增加了H2O/CO2,其混合物的热力学和输运特性会发生改变;第二是H2O/CO2会直接参与化学反应;第三是H2O/CO2的添加会造成热辐射传输特性的改变.在本文中,我们用动力学模拟方法,从化学反应动力学和热力学的角度,研究C2H4在H2O/CO2污染的空气中燃烧时,其点火延迟时间和反应温度等特性.
1 模拟计算
在计算中,我们主要用 University of Southern California燃烧反应动力学实验室发展的H2/CO/C1-C4化合物的燃烧反应数据库(http://ignis.usc.edu/ USC_Mech_II.htm),和文献[23-25]中的动力学数据,模拟乙烯在活塞流绝热反应器中燃烧,燃烧机理包含74个物种和529个反应,其计算由Chemkin2.0完成[26],研究空气中含有H2O/CO2污染组分对乙烯燃烧时的点火延迟时间(τig)、平衡温度和压强等特性的影响.τig可根据燃烧反应的温度或某一中间产物的浓度等的变化情况来定义,本文的定义是在燃烧中,在某一微小的时间段内温度升高为最大值所对应的时间,即活塞流反应器是用化学动力学速率方程与能量、质量、动量和组分流量守恒原理相结合,计算体系从初始态反应物到产物的进程中系统温度、压强和各种组分浓度随距离的变化关系.
在计算中,活塞流反应器的横截面积为18 cm2,气体在反应器中的轴向流动速度为340 m·s-1,O2在空气中的摩尔分数为0.21,分别用不同浓度的H2O/ CO2取代空气中的N2,计算5种不同污染程度的空气组成(来流气体保持氧气摩尔分数为0.21)对乙烯燃烧性能的影响:
(1)纯净空气C:N2(0.79),
(2)水污染空气W1:H2O(0.08)+N2(0.71),
(3)水污染空气W2:H2O(0.20)+N2(0.59),
(4)二氧化碳污染空气D1:CO2(0.08)+N2(0.71),
(5)二氧化碳污染空气D2:CO2(0.20)+N2(0.59).
上面5种空气组成中括号内的数据表示摩尔分数.同时,研究乙烯在含有H2O(0.20)/CO2(0.20)污染物的空气中燃烧,初始压强、温度和燃气比φ(燃料-氧气实际燃烧的体积比再除以燃料-氧气燃烧的化学恰当体积比)改变时,其污染物对点火延迟时间、平衡温度和压强等燃烧特性的影响.
2 结果及讨论
用模拟方法得到,燃气比、初始温度和压强不同时,乙烯与纯净空气在活塞流绝热反应器中燃烧的点火延迟时间(τig(cal))的值,见表1.从表中可以看到,模拟的点火延迟时间与实验拟合值[20]吻合得比较好.我们用此机理和反应器模型研究乙烯在含有H2O/CO2污染的空气中燃烧的包括点火延迟时间在内的燃烧特性.
通过模拟得到,乙烯在含不同浓度的H2O(0.08, 0.20)/CO2(0.08,0.20)污染组分的空气中燃烧,燃气比φ=0.5、初始温度T0=1100 K和初始压强p0=8.08× 105Pa,其污染组分对燃烧的平衡温度、压强和点火延迟时间等特性的影响,见图1和图2.从图1中可以看到,乙烯在含H2O的空气中燃烧时,相比纯净空气,平衡温度和平衡压强都有所下降.H2O的浓度越大,下降的幅度越大.含CO2时,与等浓度的H2O相比,其平衡温度和压强下降的幅度更大,其污染组分对乙烯燃烧压强的影响与实验结果[22]一致.从图2可见,空气中含H2O时,相比纯净空气,燃烧的点火延迟时间有所缩短,H2O的浓度越大,缩短的幅度越大;但空气中含CO2时,其点火延迟时间反而有所增长,CO2的浓度越大,增长的幅度越大.因此,乙烯在含H2O/CO2污染物的空气中燃烧时,H2O和CO2对燃烧特性的影响是不同的,其影响程度随污染物的浓度增大而增大.
乙烯在含H2O(0.20)/CO2(0.20)污染组分的空气中燃烧,在不同初始温度、压强和燃气比的条件下,污染组分对燃烧特性的影响是复杂的.当燃烧在初始压强和燃气比为常数(p0=5.05×105Pa,φ=0.5),初始温度改变(9个不同初始温度,T0=1000、1050、1100、1150、1200、1250、1300、1350、1400 K)的条件下进行,其H2O/CO2对点火延迟时间和平衡压强等的影响如图3和4所示.乙烯在含有H2O的空气中燃烧,相比纯净空气,其点火延迟时间有所缩短,但随着初始温度的升高,缩短的幅度在减少甚至消失.如图3所示,当T0=1000 K,其点火延迟时间缩短了9.5%; T0=1150 K时,缩短了4.2%;当T0=1250 K时,点火延迟时间几乎没改变.而空气中含CO2时,其点火延迟时间略有增长,随着初始温度升高,增长的幅度越来越小.当T0=1000 K时,点火延迟时间增长了3.2%;T0=1250 K时,仅增长了2.1%.因此,燃烧的初始温度改变时,H2O对乙烯的点火有一定促进作用,而CO2对点火有一定抑制作用,但随着初始温度的升高,H2O或CO2对点火的促进或抑制作用逐渐减少甚至消失.

表1 乙烯燃烧点火延迟时间(τig)的模拟值与实验拟合值比较Table 1 Ignition delay time(τig)calculated and experimentally fitted for ethylene combustion

图1 不同浓度的CO2/H2O对乙烯燃烧温度(a)和活塞流反应器中不同位置(d)的压强(b)的影响Fig.1 Influence of concentration of CO2/H2O on ethylene combustion temperature(a)and pressure at different positions(d)of plug flow reactor(b)W1∶H2O(0.08)+N2(0.71),W2∶H2O(0.20)+N2(0.59),C:clear air, D1∶CO2(0.08)+N2(0.71),D2∶CO2(0.20)+N2(0.59); Data in the parentheses are the molar fractions.
当乙烯在初始压强改变(12个不同的初始压强, p0=0.101×105、0.505×105、1.01×105、2.02×105、5.05× 105、7.07×105、10.1×105、12.12×105、15.15×105、20.2× 105、30.3×105、50.5×105Pa),初始温度和燃气比为常数(T0=1100 K,φ=0.5)的条件下燃烧,CO2/H2O污染组分对燃烧特性的影响见图5、6.在图5中可见到,空气中含H2O时,相比纯净空气,燃烧的点火延迟时间缩短了,随着初始压强的增大,其缩短的幅度越来越小,当p0=1.01×104Pa,其点火延迟时间缩短了27.6%,p0=5.05×106Pa,仅缩短5.2%,而空气中含CO2时,CO2对燃烧的点火延迟时间的影响比较小,相对纯净空气,当p0≤5.05×105Pa时,其点火延迟时间几乎没有改变,p0≥7.07×105Pa时,压强越大,点火延迟时间增长的幅度越大,当p0=2.02×106Pa,其点火延迟时间延长了7.3%.因此,对于乙烯燃烧,初始压强改变时,空气中含有H2O时,H2O对点火有促进作用,但随着初始压强的增加其促进作用逐渐减弱;而空气中含有CO2时,对点火有一定的抑制作用,随着压强的增大,对点火的抑制作用略有增大,但总的来说,CO2对点火的抑制作用比H2O的促进作用弱.

图2 CO2/H2O污染组分浓度对点火延迟时间的影响Fig.2 Influence of concentrations for CO2and H2O upon ignition delay timeThe peak of the curve corresponds to τig.
燃气比不同(φ=0.2、0.3、0.5、1.0、1.2),初始温度和压强为常数(T0=1100 K,p0=5.05×105Pa)时,CO2/ H2O对乙烯燃烧特性的影响如图7、8所示.在图7中可见:在不同燃气比的条件下(除φ=0.2外),H2O对点火有促进作用,φ=0.5时,其促进作用最大;而CO2对点火有抑制作用,但随着燃气比增大,CO2对点火延迟时间的影响越来越小.
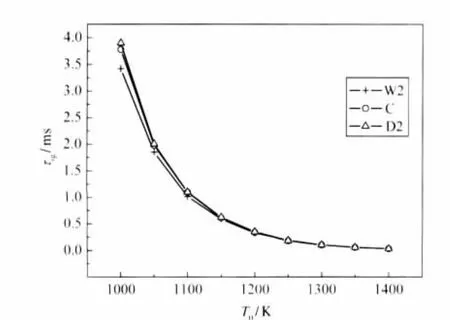
图3 初始温度对点火延迟时间的影响Fig.3 Influence of initial temperature upon ignition delay time
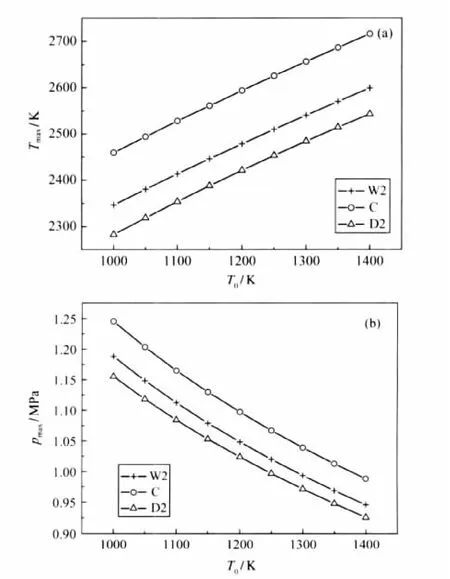
图4 初始温度对燃烧平衡温度(Tmax)(a)和平衡压强(pmax) (b)的影响Fig.4 Influence of initial temperature upon equilibrium temperature(Tmax)(a)and equilibrium pressure(pmax)(b)

图5 初始压强对点火延迟时间的影响Fig.5 Influence of initial pressure upon ignition delay time
在不同的初温、压强和燃气比时,乙烯在含H2O污染的空气中燃烧,相比纯净空气,其平衡温度和平衡压强都有所下降,空气中含CO2污染物时,与相同浓度的H2O相比,其下降幅度更大,见图4、6和8.在研究的温度或压强变化范围内,乙烯在含H2O (0.20)的空气中燃烧,其平衡温度或压强降低约4%,而含CO2(0.20)时,降低约7%.当初始温度或压强改变时,几乎没有改变CO2(0.20)/H2O(0.20)污染组分对平衡温度和压强的影响程度.对于不同的燃气比,空气中含H2O(0.20)和CO2(0.20)时,燃烧的平衡温度和压强较纯净空气都有所下降,但随着燃气比的增大,其下降幅度略有增加,如图8所示,0.2≤φ≤1.2,其平衡温度和压强下降范围分别为2.9%-4.3%和5.2%-7.3%.

图6 初始压强对乙烯燃烧平衡温度(a)和平衡压强(b)的影响Fig.6 Influence of initial pressure upon equilibrium temperature(a)and equilibrium pressure(b)
乙烯在含有H2O污染的空气中燃烧,H2O取代空气中N2时,它将参与燃烧过程的链传递反应.下面列出H2O参与的部分支链传递反应:


图7 燃气比对点火延迟时间的影响Fig.7 Influence of equivalence ratio upon ignition delay time
上述反应有利于H·和OH·自由基浓度快速积累,这些自由基的快速积累是实现点火和燃烧反应的关键.因此,空气中含有H2O时,对H·和OH·活泼自由基浓度积累有加速作用,相对纯净空气,缩短了点火时间.另外,H2O除了参与链传递反应外,在自由基的重组反应A+B+M=C+M(M是碰撞第三体)中,起到碰撞第三体的作用,在绝大多数反应中, H2O碰撞第三体效应因子比N2大[6],在本文的大多数反应中,H2O碰撞第三体的效应因子至少是N2的三倍,甚至更大,自由基复合反应的速率更大,此时H2O表现出对燃烧有抑制作用,当温度升高或压强增大时,其抑制作用更加明显.空气中有CO2时, CO2取代空气中N2,起碰撞第三体的作用,能促进反应(4)的进行,

图8 燃气比对燃烧平衡温度(a)和平衡压强(b)的影响Fig.8 Influence of equivalence ratio upon equilibrium temperature(a)and equilibrium pressure(b)

此反应中CO2碰撞第三体 (M)效应比N2大.另外, CO2还直接参与H·、O·和OH·等自由基的反应,即

从以上的反应可看出,CO2参与的链传递反应中, (7)和(8)是对O·和H·自由基的猝灭反应.降低活泼自由基的浓度[5,27],从而减缓燃烧反应的进行.因此,空气中含CO2时,反应(7)使O·自由基猝灭,而反应(4)、(5)和(8)降低了自由基的活性.这些反应对燃烧有抑制作用,使点火延迟时间增长.
乙烯在含有H2O的空气中燃烧时,相比纯净空气,H2O的热容比N2的大,改变了混合物的热力学特性,因此燃烧的平衡温度和压强比乙烯在纯净空气中燃烧时要低;而空气中含有CO2时,因CO2的分子摩尔质量和热容比H2O的大,与空气中含等浓度H2O相比,乙烯燃烧的平衡温度和平衡压强下降的幅度更大,如图1、4、6和8所示.
3 结 论
通过模拟计算,在本文的研究条件下,乙烯在含H2O污染的空气中燃烧,与纯净空气相比,(1)初始压强和燃气比为常数(p0=5.05×105Pa,φ=0.5)时,初始温度T0≤1200 K,H2O对燃烧点火有促进作用,初温越低其促进作用越强,T0≥1250 K时,H2O对点火的促进作用消失;(2)当初始温度和燃气比为常数(T0= 1100 K,φ=0.5),初始压强改变时,H2O对燃烧点火有促进作用,初始压强越低其促进作用越强;(3)当初始温度和压强为常数(p0=5.05×105Pa,T0=1100 K),燃气比φ=0.2时,H2O污染组分对点火有抑制作用,当φ≥0.3,H2O污染组分对点火有促进作用,其中φ= 0.5时促进作用最大.
乙烯在含CO2污染的空气中燃烧,与纯净空气相比,CO2对燃烧点火有抑制作用:(1)当初始温度改变时,其抑制作用的影响程度几乎没有改变(点火延迟时间增长均为2.5%左右);(2)当初始压强p0≥0.5× 105Pa时,总的来说,其抑制作用随着压强的升高略有增大(点火延迟时间最大增长了7.3%);(3)燃气比越小,其抑制作用越强,φ=0.2时,其点火延迟时间较纯净空气中燃烧增长了11.2%,但总的来说,CO2对点火的抑制作用没有H2O对点火的促进作用强.
空气中含有H2O时,因H2O的热容比N2的高,相比乙烯在纯净空气中燃烧,改变了混合物的热力学特性,其燃烧的平衡温度和平衡压强都有所下降, H2O初始浓度越大,下降的幅度越大.含有CO2时,因CO2的热容和分子摩尔质量比H2O的高,与等浓度H2O相比,其平衡温度和平衡压强下降的幅度更大.同时,当初始温度和压强改变时,几乎没有改变H2O/CO2对平衡温度和平衡压强的下降幅度,但随着燃气比的增大,其下降幅度略有增大.因此,乙烯作为燃料用纯净空气作氧化剂时,发动机尾喷气体可能有较高压强.
1 Pellett,G.L.;Bruno,C.;Chinitz,W.38th AIAA/ASME/SAE/ ASEE Joint Propulsion Conference and Exhibit.Indianapolis,IN. 2002:AIAA-2002-3880
2 Goyne,C.P.;McDaniel Jr.,J.C.;Krauss,R.H.;Whitehurst,W.B. J.Propuls.Power,2007,23:559
3 Liu,W.X.;He,W.;Li,H.B.;Li,X.Y.;Le,J.L.Chin.Sci.Bull., 2008,53:2257
4 Liu,F.S.;Guo,H.S.;Smallwood,G.J.Combust.Flame,2003, 133:495
5 Chernovsky,M.K.;Atreya,A.;Im,H.G.Proc.Combust.Inst., 2007,31:1005
6 Seiser,R.;Seshadri,K.Proc.Combust.Inst.,2005,30:407
7 Cong,T.L.;Dagau,P.T.Proc.Combust.Inst.,2009,32:427
8 Adrian,S.;John,M.;Peter,J.Chem.Eng.Sci.,2006,61:4634
9 Doute,C.;Delfau,J.L.;Akrich,R.;Vovelle,C.Combust.Sci. Technol.,1997,124:249
10 Zeppieri,S.P.;Klotz,S.D.;Dryer,F.L.Proc.Combust.Inst., 2000,28:1587
11 Brezinsky,K.Prog.Energy Combust.Sci.,1986,12:1
12 Mullaney,G.J.;Peh,S.K.;Botch,W.D.AIAA J.,1965,3:873
13 Homer,J.B.;Kistiakowsky,G.B.J.Chem.Phys.,1967,47:5290
14 Baker,J.A.;Skinner,G.B.Combust.Flame,1972,19:347
15 Suzuki,M.;Moriwaki,T.;Okuda,T.;Tanzawa,T.Astronaut.Acta, 1973,18:359
16 Hidaka,Y.;Kataoka,T.;Suga,M.Bull.Chem.Soc.Jpn.,1974,47: 2166
17 Jachimowski,C.J.Combust.Flame,1977,29:55
18 Brown,C.J.;Thomas,G.O.Combust.Flame,1999,117:861
19 Kalitan,D.M.;Hall,J.M.;Petersen,E.L.J.Propul.Power,2005, 21:1045
20 Penyazkov,O.G.;Sevrouk,K.L.;Tangirala,V.;Joshi,N.Proc. Combus.Inst.,2009,32:2421
21 Renard,C.;Dias,V.;Tiggelen,P.J.V.;Vandooren,J.Proc. Combus.Inst.,2009,32:631
22 Liu,W.X.;Yang,Y.;Shao,J.X.;Song,W.Y.;Li,X.Y.;Le,J.L. Acta Phys.-Chim.Sin.,2009,25:1618 [刘伟雄,杨 阳,邵菊香,宋文艳,李象远,乐嘉陵.物理化学学报,2009,25:1618]
23 Javoy,S.;Naudet,V.;Abid,S.;Paillard,C.E.Expt.Thermal Fluid Sci.,2003,27:371
24 Eremin,A.V.;Ziborov,V.S.;Shumova,V.V.;Voiki,D.;Roth,P. Kinet.Catal.(Engl.Transl.),1997,38:1
25 Mayer,S.W.;Schieler,L.J.Phys.Chem.,1968,72:2628
26 Kee,R.J.;Grear,J.F.;Smooke,M.D.;Miller,J.A.Sandia Report No.SAND 85-8240.Livermore,CA:Sandia National Laboratories, 1985
27 Westbtook,C.K.;Dryer,F.L.Prog.Energy Combust.Sci.,1984, 10:1
