南方红豆杉离体胚培养诱导不定芽研究
2010-12-05曾余力林新春桂仁意张翠萍黄丽春
曾余力,林新春,桂仁意,张翠萍,黄丽春
(浙江农林大学 浙江省现代森林培育重点实验室,浙江 临安 311300)
南方红豆杉Taxus chinensis var.mairei属国家一级濒危保护植物之一,集材用、药用、观赏于一体,经济价值极高。由于红豆杉属Taxus植物本身特殊的生物学特性,种子在天然条件下,需要两冬一夏才能萌发并且植株生长缓慢[1],常规育种难以保证市场的需要,故通过离体胚培养技术克服红豆杉种子难以萌发的缺点,以期加快植株生长。近年来,国内外学者对短叶红豆杉Taxus brevifolia,欧洲红豆杉Taxus baccata,杂种红豆杉Taxus×media var.hicksii,东北红豆杉Taxus cuspidata等进行了离体胚培养研究[2-3],从不同角度证实离体胚的萌发、成苗与培养基、种子来源、培养条件等有密切关系,但对南方红豆杉离体胚培养的研究较少,仅见臧新等[4-5]对南方红豆杉离体胚萌发影响因素的研究。本研究在前人的研究基础上以南方红豆杉的成熟胚为外植体,筛选外植体灭菌途径,基本培养基、植物生长调节物质等因子对离体胚生长和分化不定芽的影响。
1 材料与方法
1.1 试验材料
试验材料购自浙江省嵊州市常青花木场,于4℃冰箱中冷藏备用。
1.2 试验方法
1.2.1 外植体灭菌 选取均匀饱满的种子,剥去外种壳,流水冲洗12 h,置于超净工作台内,分别置于 5.0,10.0,25.0 g·L-1的次氯酸钠(NaClO)溶液中真空灭菌 5,10,15 min,无菌水分别冲洗 5遍。最后在解剖显微镜下切除胚乳挑取种胚,接入MS(Murashige and Skoog)培养基中,1个种胚·管-1,各接种100管。接种后先暗培养2 d,然后再光培养。
1.2.2 不同基本培养基与植物生长调节物质对离体胚培养的影响 试验一,挑取种胚分别接种于MS,1/2MS,1/3MS,1/4MS,WPM(woody plant medium)和 B5(Gamborg)等 6种基本培养基中,测试基本培养基的影响;试验二,以WPM为基本培养基,测试不同种类和质量浓度的植物生长调节物质的影响:噻苯隆(TDZ)为 0,0.000 1,0.001 0,0.010 0,0.100 0 mg·L-1,细胞激动素(KT),6-苄氨基腺嘌呤(6-BA),异戊烯基腺嘌呤(2iP)和玉米素(ZT)为 0,0.030 0,0.300 0,1.000 0,3.000 0,10.000 0 mg·L-1。
1.2.3 种胚萌动对离体胚培养的影响 根据种胚大小、颜色分别选取萌动(长度为0.7~0.8 cm,颜色转微黄色)和未萌动(长度为0.4~0.5 cm,颜色白色)的种胚,测试不同发育时期对胚培养的影响。以WPM为基本培养基,附加 0,0.010 0,0.100 0,1.000 0 mg·L-1的 6-BA。以上试验培养条件:温度为(25±2)℃,光照度为2 500~2 800 lx,光周期(昼/夜)16/8 h。对照组(ck)为WPM基本培养基。
1.2.4 驯化移栽 将带根的试管苗置于驯化室中,在强光(2万 lx)下练苗4周,然后取出试管苗,冲净根部培养基,将植株移至泥炭 ∶珍珠岩 ∶蛭石为1∶1∶1的人工基质中。
1.3 统计分析
以上各试验设计3个重复,各试验的结果分析均采用生物统计法将平均值及其标准误差[6]和95%的可信度进行差异显着性分析[7]。
2 结果与分析
2.1 外植体灭菌
培养28 d后调查,结果见表1。最优灭菌处理为25.0 g·L-1次氯酸钠溶液真空灭菌10 min,其污染率仅6%,出苗率达86%。试验结果表明,随次氯酸钠质量浓度升高,污染率显著降低,而灭菌时间加长也能有效降低污染。由于南方红豆杉胚乳较厚,高质量浓度次氯酸钠浸泡不会损伤到离体胚的萌发生长,各处理的萌发率为93%~98%。
2.2 不同基本培养基与植物生长调节剂对离体胚培养的影响
2.2.1 不同基本培养基对离体胚培养的影响 将南方红豆杉离体种胚接于不同基本培养基中,培养2个月后,MS培养基中的胚,叶色淡绿,茎较长较粗,但根较短无侧根,根长约2.0 cm。在不同MS质量浓度(1/3MS,1/2MS,MS)培养基的胚,随无机盐质量浓度升高,芽长增长;在1/3MS中根长最长,根数最多。可能是南方红豆杉茎伸长生长需要高质量浓度的无机盐离子,根生长则以低质量浓度无机盐离子为宜,而茎叶和根的平衡生长则需要大量元素的协调配比。对应MS培养基,WPM培养基中离体胚茎段细长,叶色深绿,并有许多侧根生成,根系好,主根长度达3.8 cm,平均根数达4.3条,是南方红豆杉胚培养的最佳基本培养基;B5培养基由于茎细弱,叶色发黄,不适于南方红豆杉的胚培养(图1~3)。
2.2.2 不同植物生长调节物质对离体胚培养的影响 将离体种胚接种于含有不同质量浓度的6-BA的培养基中,50 d调查结果如表2。与对照组相比,6-BA质量浓度递增时,离体胚抽出茎叶的长度递降,胚根长度变短甚至不萌发,胚轴上有突起发生。在6-BA 0.03 mg·L-1时,胚轴有突起形成,少数有不定芽分化;质量浓度增加至0.10 mg·L-1,不定芽数量增加;但6-BA质量浓度增高到1.00 mg·L-1时,突起变少,且突起不能分化为不定芽,并随之褐化。将离体种胚接种于含有不同质量浓度的KT
的培养基中,50 d调查结果如表3。由表3可知,0.10 mg·L-1KT的培养基中离体胚无茎叶抽出和胚根伸长,但可见丛生不定芽的分化,诱导率达30%。与6-BA相比,KT更优于不定芽的分化,但对茎叶和胚根生长的抑制较明显;当KT质量浓度升高至0.30 mg·L-1时不定芽的诱导率降低,而且随KT质量浓度的升高,对胚根发育的抑制越强;当质量浓度提高至10.00 mg·L-1时,离体胚无生长、褐化。试验发现,接种于含6-BA的培养基中的离体胚仅在胚轴上有突起产生,分化少量不定芽,而接种于含KT培养基中的离体胚在胚轴、子叶和生长点均有不定芽的分化。将离体种胚接种于含不同浓度ZT的培养基中,50 d调查结果如表4。由表4可知,ZT也能有效诱导不定芽的分化。当ZT的质量浓度在0.10~1.00 mg·L-1时,胚轴、生长点和子叶均有不定芽分化,且多为丛生芽,当ZT质量浓度为1.00 mg·L-1时诱导率高达50%,与KT不同的是,ZT对茎叶抽出抑制不明显,KT质量浓度为0.10 mg·L-1时无茎叶抽出,而ZT的质量浓度为1.00 mg·L-1时仍有茎叶抽出,但节间较短,并且有轻微水化现象;当ZT升至3.00 mg·L-1时,水化更为明显。在含不同质量浓度2ip的培养基中,2iP对不定芽的诱导较6-BA强(表5),对南方红豆杉离体胚不定芽的诱导率最高,质量浓度为0.30 mg·L-1时,诱导率高达70%,但仅有1~2个单芽·胚-1,而KT和ZT的不定芽多为丛芽。对茎叶抽出抑制效果低于6-BA,当质量浓度为3.00 mg·L-1茎叶仍有抽出,叶色较绿。添加TDZ的试验处理,都无不定芽分化。低质量浓度TDZ中试管苗生长与对照组相似,质量浓度高于0.100 0 mg·L-1,胚轴膨胀,试管苗有水化现象;当质量浓度增加到1.000 0 mg·L-1,种胚呈黄褐色愈合组织(表6)。

表1 种子表面灭菌对离体种胚培养的影响Table 1 Effect of factorial tests among various concentrations of NaClO vs.its durations on germination of excised embryos
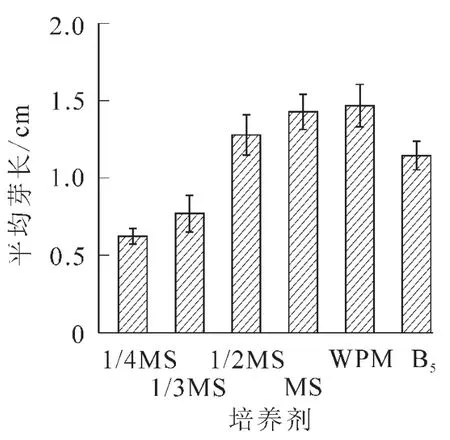
图1 不同基本培养基对芽体生长的影响Figure 1 Effects of basal media on shoot growth of Taxus chinensis var.mairei
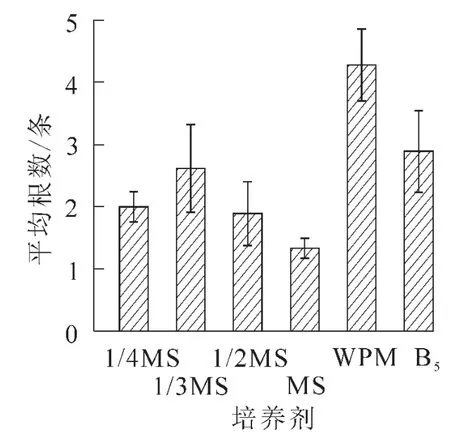
图2 不同基本培养基对根数的影响Figure 2 Effects of basal media on root number of Taxus chinensis var.mairei
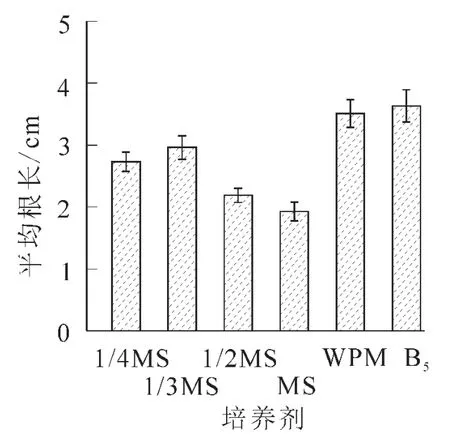
图3 不同基本培养基对根长生长的影响Figure 3 Effect of basal media on root growth of Taxus chinensis var.mairei

表2 6-BA对种胚培养诱导不定芽分化的影响Table 2 Effect of 6-BA on induction of adventitious buds by embryo culture

表3 KT对种胚培养诱导不定芽分化的影响Table 3 Effect of KT on induction of adventitious buds by embryo culture

表4 ZT对种胚培养诱导不定芽分化的影响Table 4 Effect of ZT on induction of adventitious buds by embryo culture
2.3 种胚萌动对离体胚培养的影响
由表7可知,将萌动的种胚接种到含0.10~1.00 mg·L-16-BA的培养基上,离体胚分化出大量不定芽;而且随6-BA质量浓度增高,胚轴分化不定芽的数量呈现先升高后下降的趋势;但是将未萌动的种胚接种到相同的培养基中,仅在胚轴处产生突起,没有不定芽的分化。
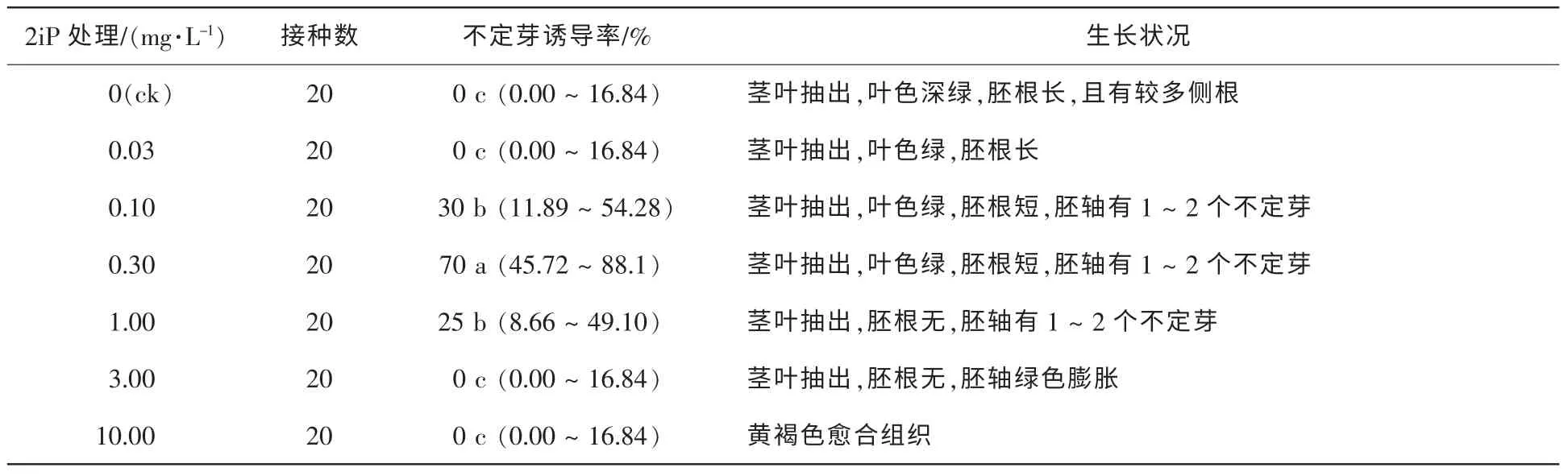
表5 2iP对种胚培养诱导不定芽分化的影响Table 5 Effect of 2iP on induction of adventitious buds by embryo culture

表6 TDZ对种胚培养诱导不定芽分化的影响Table 6 Effect of TDZ on induction of adventitious buds by embryo culture

表7 种胚萌动前后对胚培养的影响Table 7 Effect of with or without breaking seed dormancy on germination of excised embryos
2.4 驯化移栽
将试管苗置于模拟自然环境中,经1个月练苗驯化后,移至混合人工基质中,成活率达到90%。
3 结论与讨论
木本植物组织培养的困难之一是建立无菌材料。在建立无菌材料时,外植体表面灭菌将影响试验成败。本研究采用25.0 g·L-1次氯酸钠溶液真空灭菌10 min,污染率仅为6%,出苗率达86%。而且由于南方红豆杉胚乳较厚,高质量浓度的次氯酸钠溶液不会伤害到内部的胚,对其萌发无影响。试验还发现南方红豆杉种胚在MS培养基上能够较好的萌发生长,萌发率在95%左右,而陈永勤等[8]曾报道红豆杉在MS培养基上的萌发较差,这与本研究结果不一致。
臧新等[5]对MS和B5等培养基进行研究,认为这几种培养基对南方红豆杉的离体胚培养影响差别不大,而我们在研究中发现不同基本培养基对离体胚培养影响较大。WPM培养基能促进根系产生和茎叶生长,是南方红豆杉离体种胚培养最适宜的基本培养基。MS培养基对南方红豆杉茎段生长亦较佳,但不利其根系的生长。B5培养基也不适于南方红豆杉的胚培养。
在不同细胞分裂素对离体种胚培养的影响试验中发现,不加细胞分裂素时试管苗生长最好,添加细胞分裂素不利于种胚的伸长生长,但可诱导不定芽的产生且不需经过愈合组织而直接分化产生不定芽,其中KT和ZT最适于南方红豆杉的不定芽诱导。对于大多数树种,诱导不定芽时,外植体需接种在细胞分裂素与生长素配比的培养基中,但在许多针叶树培养中,单独使用细胞分裂素,足以诱导不定芽发生[9-10],这与本试验研究结果相一致。
萌动后的南方红豆杉种子具有较强的生长势和生理活性,而且此时内源激素含量高于其他时期,而未萌动的种子中发芽抑制物的含量较高[11],抑制种子的萌发生长。南方红豆杉种胚萌动对胚培养的影响,试验得知以萌动后的种胚为外植体更容易诱导出不定芽,这可能与南方红豆杉种胚内源激素随种胚成熟度而发生变化有关。
[1]程广有,唐晓杰,高红兵,等.东北红豆杉种子休眠机理与解除技术探讨[J].北京林业大学学报,2004,26(1):5-10.CHENG Guangyou,TANG Xiaojie,GAO Hongbing,et al.Dormancy mechanism and relieving techniques of seeds of Taxus cuspidata Sieb.et Zucc.[J].J Beijing For Univ,2004,26(1):5-10.
[2]陈永勤,朱蔚华.红豆杉属植物的组织、细胞及胚培养[J].植物生理学通讯,1997,33(3):213-219.CHEN Yongqin,ZHU Weihua.Tissue,cell and embryo culture of Taxus[J].Plant Physiol Commun,1997,33(3):213-219.
[3]王水,贾勇炯,魏峰,等.云南红豆杉的组织培养及植株再生[J].云南植物研究,1997,19(4):407-410.WANG Shui,JIA Yongjiong,WEI Feng,et al.Tissue culture and plant regeneration of Taxus yunnanensis[J].Acta Bot Yunnan,1997,19(4):407-410.
[4]臧新,吕晓辉,杨冬之,等.激素对2种红豆杉离体胚培养的影响[J].华中农业大学学报:自然科学版,2006,25(3):310-312.ZANG Xin,LÜ Xiaohui,YANG Dongzhi,et al.Effects of hormones on the embryo culture of two Taxus species in vitro[J].J Huazhong Agric Univ,2006,25(3):310-312.
[5]臧新,吕晓辉,杨冬之,等.2种红豆杉的离体胚培养[J].郑州大学学报:理学版,2006,38(2):107-112.ZANG Xin,LÜ Xiaohui,YANG Dongzhi,et al.The embryo culture in vitro of two Taxus species[J].J Zhengzhou Univ Nat Sci Ed,2006,38(2):107-112.
[6]COLQUHOUN D.Lectures on Biostatistics[M].Oxford:Clarendon Press,1971.
[7]SNEDECOR G W.Statistical Methods[M].4th Ed.Iowa:Iowa State College Press,1946.
[8]陈永勤,戴均贵,朱蔚华.红豆杉成熟胚的离体培养[J].植物生理学通讯,1998,34(3):191-193.CHEN Yongqin,DAI Jungui,ZHU Weihua.In vitro culture of mature embryos of Taxus chinensis[J].Plant Physiol Commun,1998,34(3):191-193.
[9]成小飞,花晓梅,李文钿.马尾松离体培养条件下的微繁殖和菌根的形成[J].林业科学研究,1995,8(3):241-246.CHENG Xiaofei,HUA Xiaomei,LI Wendian.Micropropagation and mycorrhizae formation of Pinus massoniana Lamb.in vitro[J].For Res,1995,8(3):241-246.
[10]AITEKEN J,HORGAN K J,THORPE T A.Influence of explant selection on the shoot forming capacity of juvenile tissue of Pinus radiata[J].Can J For Res,1981,11(1):112-117.
[11]张艳杰,高捍东,鲁顺保.南方红豆杉种子中发芽抑制物的研究[J].南京林业大学学报:自然科学版,2007,31(4):52-56.ZHANG Yanjie,GAO Handong,LU Shunbao.Germination inhibitors in methanol extract from Taxus chinensis var.mairei seed[J].J Nanjing For Univ Nat Sci Ed,2007,31(4):52-56.
