硫化氢通过抑制p38 MAPK保护PC12细胞对抗化学性缺氧损伤
2010-11-29兰爱平梅卫义孟金兰杨春涛杨战利陈培熹冯鉴强
兰爱平,梅卫义,孟金兰,胡 芬,杨春涛,杨战利,陈培熹,冯鉴强
长期以来,硫化氢(hydrogen sulfide,H2S)被认为是一种有毒的气体。然而,随着对H2S研究的深入,发现体内的一些组织细胞能生成H2S。它是继一氧化氮(NO)和一氧化碳(CO)之后,被发现的体内第3种气体信号分子[1]。近年,不少的研究证实,H2S具有心肌保护作用[2-3],也具有神经保护作用,例如能保护大鼠大脑皮层神经元对抗氧化应激引起的损伤[4],对抗 β-淀粉多肽诱导 PC12 细胞损伤[5]。最近,本研究小组证实[6],H2S能保护具有神经元形态与功能特征的PC12细胞对抗氯化钴(cobalt chloride,CoCl2)引起的损伤。
CoCl2是一种化学性低氧模拟剂,在多种培养细胞能模拟低氧/缺血状况,包括增加活性氧(reactive oxygen species,ROS)生成[6-7],降低线粒体膜电位(mitochondrial membrane potential,MMP)[8]等,并引起 PC12 细胞凋亡[7-9]。Zou 等[9]报道,CoCl2能增加丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族中的成员之一p38MAPK表达,p38MAPK的特异性抑制剂SB302580能抑制CoCl2诱导的PC12细胞凋亡,提示p38MAPK介导CoCl2引起的PC12细胞损伤。但是,H2S是否通过调制p38MAPK表达对抗CoCl2诱导PC12细胞损伤,迄今未见报道。本文旨在探讨:(1)H2S能否抑制CoCl2对p38MAPK表达的上调作用?(2)p38MAPK抑制剂能否产生类似于H2S的神经保护作用,特别是能否抑制CoCl2引起的氧化应激反应。
1 材料与方法
1.1 材料 NaHS、CoCl2、Hochest 33258、DCFHDA、Rh123购自美国Sigma Aldrich公司,CCK-8试剂盒购自日本Dojindo Lab,DMEM-F12培养基购自Gibco公司,抗p38,p-p38和Western blot检测试剂盒SB302580(p38抑制剂)购自Cell Signaling Technoligy Inc(CST)。
这届学术邀请展版块的油画艺术家更有其各自的创作风格。他们是中国国家画院油画院副院长郭北平;中国美术学院绘画艺术学院院长杨参军;北京画院油画创作室主任白羽平;中国写实画派领军人物之一、湖北省文联副主席冷军;中国艺术研究院中国油画院副院长朱春林。这5位艺术家可谓当今油画艺术领域的实力派代表,他们以自己具有经典价值的艺术作品与学术追求,体现出他们对中国油画艺术在新时代如何发展若干现实课题的独特思考,提供了多方位研究油画在当代语境下发展现状与未来趋势问题的经典个案。
1.2 细胞培养和预处理方法 PC12细胞由中山大学实验动物中心提供,置于含20%新生牛血清的DMEM-F12培养基中,于37℃,5%CO2条件下培养,选取对数生长期细胞进行实验。NaHS预处理按如下程序实施:400 μmol·L-1NaHS作用PC12细胞30 min,撤去,用 PBS洗两次,接着给予600 μmol·L-1CoCl2作用24 h。p38抑制剂 SB302580(20 μmol·L-1)在损伤前60 min加入培养液。
北医三院对节能的重视由来已久。医院党委书记金昌晓向记者介绍道,医院在能源管理工作上,逐步完善全面的能源管理组织框架与管理制度,配套节能资金的投入,推动能源管理的平台化发展,实现节能项目从立项到总结形成闭环管控,取得了明显的节能成效。
1.5 Western blot法检测p38蛋白的表达 PC12细胞接种于60 mm培养皿中,各实验组给予不同的处理因素后,用预冷的PBS洗两次,加入细胞裂解液,4℃静置 30 min,12 000 r·min-1离心 10 min,取上清,采用BCA法进行蛋白定量。总蛋白经SDSPAGE分离后,转移到PVDF膜上。用5%脱脂奶粉封闭1.5 h,随后加入 p38、p-p38(1 ∶1 000,4℃ 过夜,用TBST洗3次,10 min/次。将PVDF膜用发光试剂ECL显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。
2.3 H2S和p38MAPK抑制剂对抗CoCl2的致凋亡作用 Fig 3的Hochest 33258核染色法检测结果显示,600 μmol·L-1CoCl2处理 PC12 细胞48 h 后,使凋亡细胞数目明显增多。在 600 μmol·L-1CoCl2处理PC12细胞前,分别应用400 μmol·L-1NaHS预处理细胞30 min或20 μmol·L-1SB302580预处理60 min均能明显的抑制CoCl2诱导的细胞凋亡,使凋亡细胞数目减少。400 μmol·L-1NaHS 30 min或20 μmol·L-1SB302580本身不引起细胞凋亡。上述结果提示,H2S可通过抑制p38MAPK通路来对抗CoCl2的致细胞凋亡作用。
1.3 细胞存活率的检测 PC12细胞取对数生长期细胞,以 1 ×107·L-1接种于 96 孔板,100 μl/孔。在37℃,5%CO2条件下常规培养过夜后,按实验要求给予不同处理,每孔设8个平行孔,处理完后,每孔加入10 μl的 CCK-8,37℃继续孵育 4 h,用酶标仪(450 nm)记录各孔的吸光度(OD)。取4孔OD值的平均数,按公式计算细胞存活率。细胞存活率/%=处理组OD/对照组OD×100%,重复3次
本组20例患者,男8例,女13例,年龄55~65岁,平均59岁,有慢性关节疼痛或肿胀6个月以上,均经X线片或MRI检查提示有膝关节退行性变、关节软骨破坏的表现。排除糖尿病、血液系统疾病、免疫疾病等影响骨质的基础疾病。
1.6 细胞内ROS含量的检测 DCFH-DA本身没有荧光,细胞内的ROS可将无荧光的DCFH氧化成发出绿色荧光的DCFH,绿色荧光的强弱可以间接反映细胞内ROS水平。将细胞接种于35 mm的培养皿中,各实验组给予不同的处理因素后,倒掉培养液,用无血清的低糖培养液洗两次,随后用10 μmol·L-1DCFH-DA染液于37℃孵育60 min。在荧光显微镜下随机选取不重复的区域摄片,用Image J 1.41软件的COLOR Hitogram模块计算出5个视野绿色荧光强度的平均值,再对各组的样本进行统计分析。
商品验收。该环节控制对策主要有三项:其一,针对鱼肉这一类型的食品,需要检查商品检疫合格证、运载工具消毒证明以及来自非疫区证明三项证明。其二,低温库存商品,保存温度处于-18℃以下,需要保证其外表为冻结状态,严格控制中心温度,使其在-8℃以下。常温以及回温化冻食品,首先需要对其进行冻结处理,然后才可以进行入库处理。其三,对于经过盐水浸泡的食品、具备化学腐蚀功能的商品以及液体商品等,应该进行严密包装。
1.8 统计学处理 全部实验数据经SPSS 13.0软件进行统计学分析,所有结果以±s表示,组间比较用单因素方差分析(one-way ANOVA)检验,用LSD进行均数之间的比较。
1.7 细胞内MMP的检测 Rh123是一种能够被线粒体吸收的荧光染料,线粒体对其摄取能力取决于其跨膜电位。根据荧光强度可以间接反映MMP的高低,将细胞接种于35 mm的培养皿中,各实验组给予不同的处理因素后,倒掉培养液,用不含血清的低糖培养液洗两次,随后在含100 mg·L-1Rh123的无血清的培养基中37℃孵育45 min,在荧光显微镜下随机选取不重复的区域摄片,,细胞核周围的绿色亮点即为摄取了Rh123的线粒体。用Image J 1.41软件的COLOR Hitogram模块计算出5个视野绿色荧光强度的平均值,再对各组的样本进行统计分析。
2 结果
2.2 H2S和p38MAPK抑制剂对抗CoCl2诱导的细胞毒性 Fig 2结果显示,600 μmol·L-1CoCl2处理PC12细胞24 h后,使细胞存活率降低至(39.9±2.2)%(P<0.01),提示CoCl2能产生细胞毒性作用。在600 μmol·L-1CoCl2处理 PC12细胞前,分别应用400 μmol·L-1NaHS预处理细胞30 min或20 μmol·L-1SB302580(p38MAPK 抑制剂)预处理60 min均能明显的抑制CoCl2的细胞毒性,使细胞存活率分别升高至(61.3±2.1)%和(74.3±1.7)%,与CoCl2处理组比较,均具有统计学意义(P <0.01)。
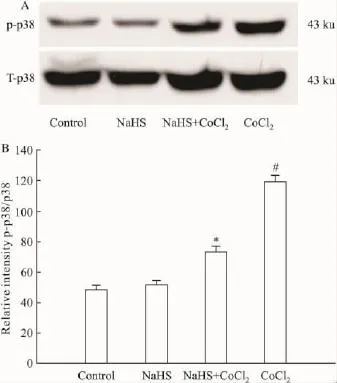
Fig 1 NaHS(400 μmol·L -1)preconditioning inhibited CoCl2induced activation of p38MAPK in PC12 cells#P<0.05 vs control;*P<0.05 vs CoCl2
2.1 H2S阻断CoCl2对p38MAPK表达的上调作用 本文的预实验结果显示,在200~800 μmol·L-1的浓度范围内,CoCl2呈浓度依赖性的抑制PC12细胞存活率,其中600 μmol·L-1CoCl2使 PC12细胞存活率降至(39.9±2.2)%(P<0.01),故本文使用600 μmol·L-1作为CoCl2的损伤浓度,另一方面在12~48 h范围内600 μmol·L-1CoCl2呈时间依赖性的抑制PCl2细胞的存活率,故本文确定24 h作为CoCl2损伤PC12细胞的时间。Fig 1结果显示,应用 600 μmol·L-1CoCl2作用 PC12细胞 120 min,可使磷酸化(P)p38MAPK表达明显升高,是对照组的(2.8±0.27)倍(P<0.05)。在CoCl2处理PC12细胞前应用400 μmol·L-1NaHS预处理细胞30 min,可明显的抑制CoCl2对p-p38MAPK表达的促进作用。

Fig 2 Effects of H2S and p38 MAPR inhibitor on inhibition of cell viability of PC12 cells by CoCl2CoCl2group:PC12 cells were treated by 600 μmol·L-1CoCl2for 24 h;NaHS+CoCl2group:PC12 cells were pretreated by 400 μmol·L-1NaHS for 30min,followed by exposure of cells to 600 μmol·L-1 CoCl2for 24h;SB302580+CoCl2group:PC12 cells were pretreated by 20 μmol·L-1SB302580(p38 MAPK inhibitor)for 60min,followed by exposure of cells to 600 μmol·L-1CoCl2for 24 h.*P < 0.05 vs CoCl2;#P<0.05 vs control
1.4 Hochest 33258核染色观察凋亡细胞形态和数量 将PC12细胞(1×107·L-1)接种于35 mm的小号培养皿中,各实验组按要求给予不同的处理因素后,加入新鲜配置的4%多聚甲醛(pH=7.4)于4℃固定细胞10 min,用 PBS洗两次,加入5 mg·L-1Hochest 33258染色液染色10 min,用PBS洗两次,加入适量的PBS后用荧光显微镜观察,摄片。正常细胞核出现弥散均匀的低密度荧光;细胞核呈固缩形态或颗粒状荧光,计为凋亡细胞。
方法1:肥皂水鉴别法。分别用两支洁净的试管取等量水样,再向两支试管中分别滴加等量肥皂水,振荡。泡沫多、浮渣少的水样为软水;反之,泡沫少、浮渣多的水样为硬水。
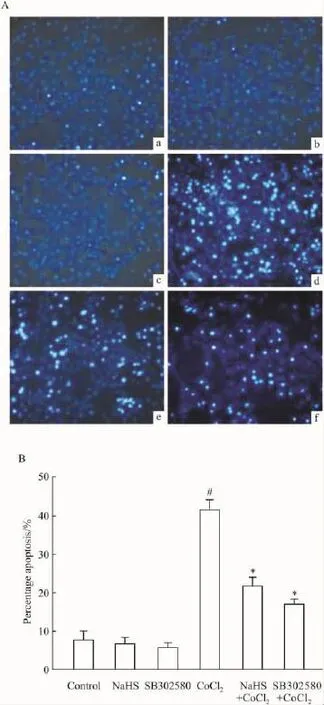
Fig 3 Influences of H2S and p38 MAPK inhibitor on CoCl2-induced apoptosis in PC12 cellsA-a:Control group;A-b:NaHS(400 μmol·L-1)alone had also no effect on apoptosis of PC12 cells;A-c:The inhibitor of p38 SB302580(20 μmol·L-1)itself had no effect on apoptosis of PC12 cells;A-d:CoCl2 group:exposure of cells to 600 μmol·L-1CoCl2for 48 h,significantly increased the quantities of apoptotic cells;A-e:NaHS+CoCl2group:The increased quantities of apoptotic cells induced by CoCl2were markedly decreased by NaHS pretreatment;A-f:SB302580+CoCl2group:The increased quantities of apoptotic cells induced by CoCl2were markedly decreased by SB302580(20 μmol·L-1)pretreatment.B:showing the statistical results from A.#P<0.05 vs control;*P<0.05 vs CoCl2
2.4 H2S和 p38MAPK抑制剂对抗 CoCl2对MMP的损伤作用 Fig 4结果显示,600 μmol·L-1CoCl2处理PC12细胞24 h后,使细胞内的平均荧光强度(MFI,为 MMP大小的指标)从55.2±2.7(对照组)降到31.5±2.2(P<0.01),提示CoCl2能损伤线粒体,使 MMP降低。然而,在600 μmol·L-1CoCl2处理PC12细胞前,分别应用400 μmol·L-1NaHS预处理细胞30 min或20 μmol·L-1SB302580预处理60 min均能阻断CoCl2降低MMP的作用,MFI分别升高至41.5±2.1(P<0.05)和46.2±2.3(P <0.01)。
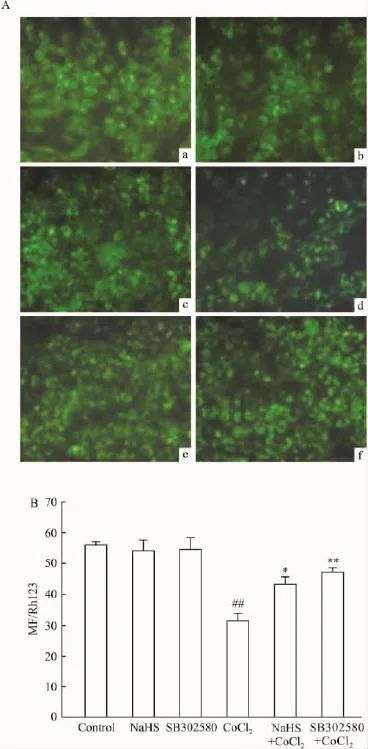
Fig 4 Effects of H2S and p38 MAPK inhibitor on the loss of MMP induced by CoCl2in PC12 cells(n=3)MMP of PC12 cells was detected by using the fluorescent dye Rh123.##P<0.01 vs control;*P<0.05,**P<0.01 vs CoCl2
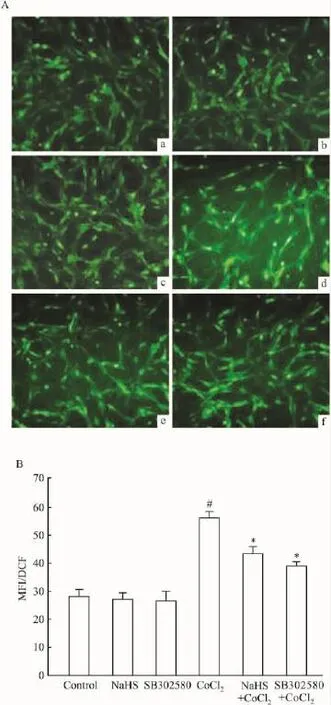
Fig 5 Effects of H2S and p38 MAPK inhibitor on CoCl2-induced intracellular ROS generation in PC12 cells(n=3)ROS of PC12 cells was detected by using the fluorescent dye DCFHDA.#P<0.05 vs control;*P<0.05 vs CoCl2
2.5 H2S和p38MAPK抑制剂抑制CoCl2引起的ROS过度生成 Fig 5结果显示,600 μmol·L-1CoCl2处理PC12细胞6 h后,使细胞内ROS水平比正常对照组高1.8倍(MFI为56.1±1.4)(P<0.05)。在600 μmol·L-1CoCl2处理PC12 细胞前,分别应用400 μmol·L-1NaHS预处理细胞30 min或 20 μmol·L-1SB302580 预处理 60 min,均能抑制CoCl2促进 ROS生成作用,分别使 MFI降低至43.5±2.2(P<0.05)和39.3±1.4(P<0.05)。400 μmol·L-1NaHS 或 20 μmol·L-1SB302580 本身对细胞内ROS水平无明显影响。
3 讨论
本文再次证实化学性低氧模拟剂CoCl2能诱导类似于缺氧/缺血性损伤,使PC12细胞存活率降低,凋亡细胞数量增多,MMP丢失及ROS生成增多,这与前文[6-9]的报道一致,另一方面,本文观察到CoCl2能促进p38MAPK表达,p38MAPK抑制剂SB302580不仅能减弱CoCl2的细胞毒性,而且能抑制它的致凋亡作用,提示p38MAPK可能介导CoCl2引起的细胞毒性及致凋亡作用。在 PC12细胞,p38MAPK被认为是多种伤害性刺激引起细胞凋亡的信号分子之一[10]。p38MAPK也与低氧引起的成骨细胞的凋亡成正相关关系[11]。有趣的是,我们发现p38MAPK抑制剂能改善线粒体的功能,使CoCl2引起的MMP丢失减少,并抑制胞内ROS过度生成,提示CoCl2损伤PC12细胞的机制之一是通过上调p38MAPK进而促进胞内氧化应激反应,使ROS生成增多,MMP丢失。Zou等[9]也观察到 p38MAPK可通过激活caspase-3介导CoCl2诱导PC12细胞凋亡。由此可以看出,CoCl2诱导类似缺氧缺血反应的机制是比较复杂的。
重要的是,本研究证实H2S在保护PC12细胞对抗化学性缺氧损伤的同时,能明显的抑制CoCl2对p38MAPK表达的上调作用,提示通过抑制p38MAPK表达是H2S的神经保护机制之一。在人的粒细胞,H2S可通过抑制p38MAPK和caspase-3来提高细胞存活率[12]。在小胶质细胞的实验模型,H2S可通过抑制p38MAPK表达来对抗脂多糖引起的炎症反应[13]。这些研究均支持本文的实验结果。
综上所述,本文在PC12细胞,首次证实H2S通过抑制p38MAPK信号通路来对抗化学性缺氧引起的神经损伤作用,使细胞存活率升高,细胞凋亡数量降低,MMP丢失及ROS生成均减少,这为深入阐明H2S的神经保护机制提供了新的实验资料,为防治缺血缺氧性神经损伤提供了新的治疗靶点。
[1]Wang R.Two′s company,three′s a crowd:can H2S be the third endogenous gaseous transmitter[J]?FASEB J,2002,16(13):1792-8.
[2]徐 刚,季 永,汪 莉,曾因明.内源性硫化氢参与缺血后处理减轻离体大鼠心脏缺血/再灌注损伤[J].中国药理学通报,2008,7(20):910-4.
[2]Xu G,Ji Y,Wang L,Zeng Y M.Endogenous hydrogen sulfide participating in the ischemic postconditioning against cardiac ischemia/reperfusion injury[J].Chin Pharmacol Bull,2008,7(20):910-4.
[3]廖新学,杨春涛,杨战利等.硫化氢对抗化学性缺氧引起的心肌细胞损伤及其机制[J].中国药理学通报,2009,8(25):1012-7.
[3]Liao X X,Yang C T,Yang Z L,et al.Hydrogen sulfide protects H9C2 cells against chemical hypoxia-induced injury and the underlying mechanisms[J].Chin Pharmacol Bull,2009,8(25):1012-7.
[4]Kimura Y,Kimura H.Hydrogen sulfide protects neurons from oxidative stress[J].Faseb J,2004,18(10):116-7.
[5]Tang X Q,Yang C T,Chen J,et al.Effect of hydrogen sulphide on beta-amyloid-induced damage in PC12 cells[J].Clin Exp Pharmacol Physiol,2008,35(2):180-6.
[6]孟金兰,兰爱平,杨春涛,杨战利.热休克蛋白90在硫化氢保护PC12细胞对抗化学性缺氧损伤中的作用[J].中国药理学通报,2010,26(1):103-7.
[6]Meng J L,Lan A P,Yang C T,Yang Z L.Role of heat shock protein 90 in protective efect of hydrogen sulfide against PC12 cells injuries induced by chemical hypoxia[J].Chin Pharmacol Bull,2010,26(1):103-7.
[7]Ji Y J,Mo H C,Yang K H,et al.Inhibition by epigallocatechin gallate of CoCl2-induced apoptosis in rat PC12 cells[J].Life Sci,2007,80:1355-63.
[8]Zou W G,Zeng J P,Zhuo M,et al.Cobalt chloride induces PC12 cells apoptosis through reactive oxygen species and accompanied by AP-1 activation[J].J Neurosci Res,2001,64:646-53.
[9]Zou W G,Zeng J P,Zhuo M,et al.Involvement of caspase-3 and p38 mitogen-activated protein kinase in cobalt chloride-induced apoptosis in PC12 cells[J].J Neurosci Res,2002,67:837-43.
[10]Han O J,Joe K H,Kim S W,et al.Involvement of p38mitogen-activated protein kinase and apoptosis signal-regulating kinase-1 in nitric oxide-induced cell death in PC12 cells[J].Neurochem Res,2001,26(5):525-32.
[11]Oh G S,Pae H O,Lee B S,et al.Hydrogen sulfide inhibits nitric oxide production and nuclear factor-kappaB via heme oxygenase-1 expression in RAW264.7 macrophages stimulated with lipopolysaccharide[J].Free Radic Biol Med,2006,23:133-52.
[12]Rinaldi L,Gobbi G,Pambianco M,et al.Hydrogen sulfide prevents apoptosis of human PMN via inhibition of p38 and caspase-3[J].Lab Invest,2006,86(4):391-7.
[13]Hu L F,Wong P T,More P K,Bian J S.Hydrogen sulfide attenuates lipopolysaccharde-induce inflammation by inhibition of p38 mitogen-activated protein kinase in microglia[J].J Neurochemisty,2007,100(4):1121-8.
