ErbB2高表达的人乳腺癌原位移植瘤裸鼠模型的建立
2010-11-29沈国栋张安莉宋礼华
沈国栋,赵 婷,张安莉,凌 斌,刘 兢,宋礼华,,魏 伟
ErbB2/HER2是细胞生长因子受体(EGFR)家族中的重要成员,它在乳腺癌、胃癌等恶性肿瘤中的高表达预示肿瘤易发生转移及预后不良,且与放化疗、内分泌治疗抵抗高度相关[1-3]。由于ErbB2表达于肿瘤细胞的表面,而在成人正常组织中不表达或者仅有极低表达,使得它成为一个良好的药物靶点。第一个抗ErbB2的人源化单克隆抗体药物曲妥珠单抗(trastuzumab,商品名Herceptin)在10余年的临床治疗中展示了独特的功效,然而还存在单药有效率低及大部分初始接受曲妥珠单抗治疗有效的病人常在1年内产生耐药的现象,这促使人们不断研究与开发针对ErbB2受体的治疗药物[4]。
本实验室在国内较早开展了这方面工作,对制备的抗ErbB2鼠源性单克隆抗体A21进行人源化改造得到了嵌合抗体chA21,前期实验发现它具有特异性地抗ErbB2高表达的肿瘤的作用,并能够提高肿瘤细胞对紫杉醇等化疗药物的敏感性[5-7]。为了寻找一种适于进行chA21等抗体药物药效评价的人乳腺癌移植瘤模型,本研究分别采用乳房垫内原位接种、胁部皮下及腋窝接种3种方法制备了BT-474细胞的裸鼠移植瘤模型,并对它们在肿瘤生长与ErbB2受体表达等方面进行了比较。
1 材料与方法
1.1 实验动物 裸鼠(BALB/c-nu/nu)购于上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2009-0002,SPF级,32只,♀4~5周龄;饲养于中国科技大学SPF级动物房中,按中国科技大学实验动物伦理委员会批准的方案进行实验。
1.2 细胞系 人乳腺浸润性导管癌细胞株BT-474,购自美国ATCC,接种前经流式细胞仪检测其细胞表面高表达ErbB2受体。
1.3 试剂 免疫组化方法检测用的ErbB2试剂盒HercepT-est购于丹麦Dako公司,BrdU、VEGF试剂盒购于北京中杉公司,Ki-67、CD31、CD34试剂盒购于武汉博士德公司;17β雌二醇60天缓释片购于美国IRA公司;matrigel胶购于德国BD公司;RPMI 1640培养液及胎牛血清购于美国Gibco公司。
1.4 肿瘤细胞接种 36只裸鼠随机分为乳房垫内原位接种和胁部皮下接种二组,接种前1 d均在颈部皮下埋植0.5 mg 17β雌二醇缓释片,然后将处于对数生长期的BT-474细胞经胰酶消化,以无血清1640培养液洗涤,调整活细胞浓度为5×1010·L-1,取0.1 ml细胞悬液与matrigel胶1 ∶1 混匀后,分别接种于裸鼠左侧第二乳房垫内或者胁部皮下,次日记为接种第1天。
1.5 肿瘤体积测量与给药处理 肿瘤细胞接种后,每周2次用游标卡尺测量肿瘤长径(L)和短径(W),肿瘤体积(TV)的计算公式为:TV=0.5×L×W2。计算每组裸鼠的移植瘤体积平均值和标准方差。为考察制备的裸鼠原位移植瘤模型对抗ErbB2抗体处理的反应,在肿瘤细胞接种第2周后荷瘤裸鼠随机分为3组,每组7只,分别按下述方法给药处理:生理盐水对照组注射剂量为10 g·kg-1,曲妥珠单抗组注射剂量为20 mg·kg-1,chA21组注射剂量为30 mg·kg-1,紫杉醇组注射剂量为10 mg·kg-1,各组均采用尾静脉注射给药,除紫杉醇组给药频率是每周1次外,其余组为每周2次,连续5周,实验结束时称量各组裸鼠所荷肿瘤质量。
1.6 免疫组化检测与结果判断 自全部成瘤日起每2周处死3只裸鼠,摘取移植瘤,福尔马林固定,石蜡包埋,进行免疫组化染色SP法,DAB显色,苏木精复染。每张切片按试剂盒说明书加入适当比例的一抗如ErbB2(即用型)、Ki-67(1 ∶100)、VEGF(即用型)、CD31(1 ∶100)等抗体,并用 PBS代替一抗作为阴性对照。二抗采用辣根过氧化物酶标记,然后加新鲜配制的DAB溶液进行显色。ErbB2染色结果判定根据美国临床肿瘤学会(ASCO)和美国病理家协会(CAP)2007年发布的《ErbB2检测临床实践指南》标准,细胞膜棕黄色的染色结果被分为0~+++(四级):染色为+++,即>30%浸润性癌细胞膜呈全周的强着色代表ErbB2阳性表达;染色为,即指至少10%肿瘤细胞有完整的胞膜染色,但是不均匀或强度较弱代表结果不确定;染色为0或+,即任何比例的肿瘤细胞有微弱的、不完整的膜染色或无着色代表ErbB2阴性表达。Ki-67、VEGF标记结果根据试剂盒说明书,以切片中细胞核或细胞质中出现棕黄色颗粒者为阳性细胞。CD31标记微血管,参考文献[8]的判断标准,凡呈现棕色单个内皮细胞或内皮细胞簇均作为一个血管计数。
1.7 统计学分析 所有数据均使用统计软件SPSS 12.0处理;方差分析后进行q检验。
2 结果
2.1 成瘤率和成瘤时间 采用乳房垫内原位接种的裸鼠1周后全部长出体积大于100 mm3的肿瘤,且形状、大小较整齐;而胁部皮下与腋窝接种的裸鼠1周后的成瘤率虽然也为100%,但形状和大小不一致,肿瘤平均体积也明显小于原位组(P <0.05,Fig 1)。
2.2 肿瘤生长曲线 3组裸鼠均从接种后1周起,统计每周的肿瘤体积做肿瘤生长曲线。如Fig 2所示,乳房垫内原位接种的裸鼠移植瘤第1周至第2周生长平稳,从第3周起生长迅速,且所有肿瘤生长速度较一致;相比而言,胁部皮下与腋窝接种7周后的肿瘤平均体积明显小于原位组(P<0.05),而且组内肿瘤体积差异很大,提示这两种方法接种形成的肿瘤生长速度不一致。
2.3 肿瘤的病理组织学特点 3组移植瘤切面均为灰白色、半透明、质实的实性区。HE染色后观察,组织内微血管多见,肿瘤细胞大,不规则团块状排列,细胞胞质丰富,细胞核大小不一,深染,核分裂相多见,核仁清楚(Fig 3 HE);进一步采用免疫组化染色方法对肿瘤切片中细胞增殖标志物Ki-67及新生血管标记分子VEGF与CD31进行了检测,代表性结果如Fig 3所示,Ki-67、VEGF与CD31分子均呈阳性表达,提示移植瘤具有细胞增殖活跃、血管生成能力强的特点。通过对这些标记分子的量化分析,结果如Fig 4所示,原位组移植瘤组织中VEGF表达的细胞数明显高于胁部皮下和腋窝组(P<0.05),Ki-67表达的细胞数与微血管密度(microvessel density,MVD)虽和胁部皮下及腋窝组之间的差异无显著性(P>0.05),但标准方差明显增加,提示原位组肿瘤和对照组相比,其病理组织学特点也更为一致。

Fig 1 The xenograft volume of BT-474 cell inoculation by three methods after 1 week

Fig 2 Tumor growth curve of BT-474 xenografts prepared by three methods*P<0.05 vs flank or axilla group

Fig 3 The pathological observation of BT-474 xenografts
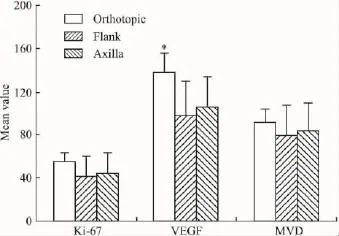
Fig 4 Quantification of expression of Ki-67,VEGF and MVD of BT-474 xenografts prepared by two methods*P<0.05 vs flank or axilla group
2.4 肿瘤的ErbB2表达情况及对治疗药物的反应 对3组移植瘤的ErbB2表达进行动态监测,光学显微镜下观察免疫组化染色的移植瘤切片,可见ErbB2阳性染色细胞膜定位准确,条状棕色或深棕色带清晰环绕整个肿瘤细胞细胞膜(Fig 5)。根据材料与方法中描述的ErbB2表达判定标准予以评分,结果发现,3组移植瘤组织ErbB2表达均为阳性(染色为+++),且在动态监测期间表达稳定,提示我们制备的BT-474细胞移植瘤保持了ErbB2阳性表达的生物学特性。为考察制备的裸鼠原位移植瘤模型对抗ErbB2抗体处理的反应,我们在人乳腺癌裸鼠原位移植瘤模型上分别进行了抗ErbB2抗体曲妥珠单抗和chA21的药效学实验,连续给药5周后,结果发现chA21、曲妥珠单抗和紫杉醇处理组的肿瘤质量分别是注射生理盐水对照组质量的63%、42%及19%,单药处理组与对照组之间差异均有统计学意义(P<0.01,Fig 6);表明制备的裸鼠原位移植瘤模型对治疗药物有着良好的反应性,适合我们进行工程抗体chA21等药物的药效评价。

Fig 5 ErbB2-positive expression of BT-474 xenografts by IHC method
3 讨论

Fig 6 Decreased weight of BT-474 xenografts treated by chA21,PTX or TraPTX:paclitaxel;Tra:trastuzumab.**P<0.01 vs control
裸鼠是一种先天性T、B细胞功能缺陷的实验动物,具有移植瘤容易成活、价格相对便宜等优点,而成为目前最常使用的实验动物之一。在多数裸鼠移植瘤保持原发肿瘤特性的同时,研究也发现有少数移植瘤生物学特性发生了改变,如人肺癌移植瘤与原发肿瘤相比,α1-抗胰蛋白酶、促肾上腺皮质激素、铁蛋白、癌胚抗原、降钙素等标记物丢失[9]。虽然采用BT-474细胞株建立的荷瘤裸鼠模型已有报道[10],但其细胞接种部位为颈部皮下,而此部位同时需要埋置雌激素缓释片,从而影响移植瘤的生长及其体积的测量;另外该部位与人乳腺癌发生的微环境也相差甚远,为此我们采用乳房垫内原位接种BT-474细胞建立了人乳腺癌裸鼠移植瘤模型,并以胁部皮下和腋窝两种接种部位作为对照,对其移植瘤的生长速度、一致性及ErbB2表达等特点作了比较。结果发现乳房垫内原位组比对照组的移植瘤生长更为快速、一致,且高表达ErbB2的生物学特性保持稳定。鉴于Ki-67是一种增殖细胞相关的核抗原,其功能与有丝分裂密切相关,Ki-67阳性表达表明癌细胞增殖活跃[11];而血管生成使肿瘤能够获得足够的营养物质,是促成肿瘤快速生长与侵袭转移的关键环节[12-13];通过对各组移植瘤上述标志物表达的比较,结果证实原位接种形成的移植瘤病理组织学的一致性也好于对照。
实际建模过程中,我们发现为了建立成瘤率高、成瘤齐、肿瘤大小一致的荷瘤裸鼠,还要注意以下几点:(1)激素水平:BT-474为人乳腺癌细胞株,因此选用♀裸鼠,但BT-474细胞株需要与matrigel胶混匀接种及外源添加雌激素才能在裸鼠体内成瘤;然而在雌激素药物的选择上也要多加注意,我们通过实验发现苯甲酸雌二醇、戊酸雌二醇及己烯雌酚等短效雌激素虽能促进BT-474移植瘤生长,但不容易掌握给药剂量与时间间隔,血药浓度低则达不到促进生长的效果,高了易造成小鼠靶器官中毒甚至导致死亡。参照文献[10]方法,在裸鼠颈部皮下埋置0.72 mg 17β雌二醇60 d缓释片,结果发现该剂量缓释片埋置1个月后可致小鼠出现体重下降,影响药物安全性评价;研究发现埋置的17β雌二醇60 d缓释片剂量减至0.5 mg效果更好。(2)动物年龄:裸鼠并非毫无免疫力,与普通小鼠相比甚至有更高的NK细胞比例,且其NK细胞数随年龄增长而增加,4~5周龄NK细胞开始显示细胞杀伤作用,至4~5月龄达到高峰[14]。因而选择5周左右的裸鼠肿瘤移植成功率较高。(3)实验环境:裸鼠接触到病原微生物可能造成感染死亡,病毒、细菌等抗原刺激可能激活非T细胞依赖免疫活性造成移植成功率降低,因此饲养和实验过程中要严格无菌操作。(4)接种部位:不同接种部位成瘤率不同,本研究通过对裸鼠胁部皮下、腋窝以及乳房垫3个接种部位的比较,发现BT-474细胞接种于乳房垫内效果最好,具有成瘤早、生长快且形状均匀等优点,这可能和乳房垫具有天然的囊状结构以及微血管丰富等特点有关。
综上所述,我们建立了ErbB2高表达的人乳腺癌裸鼠原位移植瘤模型,这为工程抗体chA21等治疗药物进行药理作用的研究提供了一个很好的实验平台。
[1]Burstein H J.The distinctive nature of HER2-positive breast cancers[J].N Engl J Med,2005,353(16):1652 -4.
[2]Wainberg Z A,Anghel A,Desai A J,et al.Lapatinib,a dual EGFR and HER2 kinase inhibitor,selectively inhibits HER2-amplified human gastric cancer cells and is synergistic with trastuzumab in vitro and in vivo[J].Clin Cancer Res,2005,16(5):1509 -19.
[3]师以康,张胜华,黄云虹,等.乳腺癌细胞的HER2过表达降低其对紫杉醇的药物敏感性[J].中国药理学通报,2009,25(4):448-52.
[3]Shi Y K,Zhang S H,Huang Y H,et al.HER2 overexpression in breast cancer cells reduces the sensitivity to taxol[J].Chin Pharmacol Bull,2009,25(4):448 -52.
[4]沈国栋,刘 兢,宋礼华,等.抗ErbB2抗体曲妥珠单抗的耐药机制与展望[J].中国药理学通报,2010,26(8):981 -4.
[4]Shen G D,Liu J,Song L H,et al.Mechanism and prospect of resistance to anti-ErbB2 antibody trastuzumab[J].Chin Pharmacol Bull,2010,26(8):981 -4.
[5]Hu S,Zhu Z,Li L,et al.Epitope mapping and structural analysis of an anti-ErbB2 antibody A21:Molecular basis for tumor inhibitory mechanism[J].Proteins,2008,70(3):938 -49.
[6]薛 花,吴 强,胡向阳,等.抗HER-2嵌合抗体chA21对SKBR3细胞的增殖抑制及凋亡诱导作用[J].中国药理学通报,2007,23(11):1463 -6.
[6]Xue H,Wu Q,Hu X Y,et al.Effects of anti-HER-2 chimeric antibody chA21 on p roliferation and apop tosis of SKBR3 cells[J].Chin Pharmacol Bull,2007,23(11):1463 -6.
[7]朱娟娟,赵 斌,刘 兢.抗ErbB2嵌合抗体chA21对SKBR3细胞的增殖抑制以及对PI3K/Akt和Erk1/2信号转导途径的影响[J].中国药理学通报,2009,25(11):1442 -5.
[7]Zhu J J,Zhao B,Liu J.Anti-proliferation role and effect on PI3K/Akt and Erk1/2 signal pathways of a chimeric anti-erbB2 antibody(chA21)on SKBR3 cells[J].Chin Pharmacol Bull,2009,25(11):1442-5.
[8]Polcher M,Rudlowski C,Friedrichs N,et al.In vivo intratumor angiogenic treatment effects during taxane-based neoadjuvant chemotherapy of ovarian cancer[J].BMC Cancer,2010(10):137.
[9]Campling B G,Haworth A C,Baker H M,et al.Establishment and characterization of a panel of human lung cancer cell lines[J].Cancer,1992,69(8):2064 -74.
[10]van Slooten H J,Bonsing B A,Hiller A J,et al.Outgrowth of BT-474 human breast cancer cells in immune-deficient mice:a new in vivo model for hormone-dependent breast cancer[J].Br J Cancer,1995,72(1):22 -30.
[11]Ooi S M,Vivian J B,Cohen R J.The use of the Ki-67 marker in the pathological diagnosis of the epithelioid variant of renal angiomyolipoma[J].Int Urol Nephrol,2009,41(3):559 -65.
[12]Laakkonen P,Waltari M,Holopainen T,et al.Vascular endothelial growth factor receptor 3 is involved in tumor angiogenesis and growth[J].Cancer Res,2007,67(2):593 -9.
[13]Koukourakis M I,Manolas C,Minopoulos G,et al.Angiogenesis relates to estrogen receptor negativity,c-erbB-2 overexpression and early relapse in node-negative ductal carcinoma of the breast[J].Int J Surg Pathol,2003,11(1):29 -34.
[14]Hioki K,Maruo K,Suzuki S,et al.Studies on beige-nude mice with low natural killer cell activity.1.Introduction of the bg gene into nude mice and the characteristics of beige-nude mice[J].Lab Anim,1987,21(1):72 -7.
