废催化剂焙烧水浸渣中硫酸浸取钴的动力学研究
2010-11-29冯其明邵延海欧乐明张国范卢毅屏
冯其明,邵延海,欧乐明,张国范,卢毅屏
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
钴是一种十分重要的有色金属,常以钴粉、氧化钴和钴化合物等形式应用于电池、石油化工、机械制造、陶瓷、油漆等行业[1−3]。我国是钴资源贫乏国家,钴主要是从铜、镍、铁等矿物资源综合利用中以副产品的形式得到回收。目前,我国主要是靠进口钴精矿、钴渣等原料来生产钴产品。自2000年以来,国内钴的年均年消费增速达到19.7%,预计到2010年,中国钴消费量将达到1.85万t,居世界第1位[3]。钴消费量的猛增引起钴资源的供应短缺,近年来,从废催化剂、废旧电池和冶炼渣等二次资源中回收钴引起了世界各国的广泛关注[4−7]。含钴的催化剂广泛用于石化行业的石油精炼处理过程,催化剂在使用中因中毒而造成永久失效,成为废催化剂而被排放[8]。由于含有大量的有价金属,废催化剂成为钴等金属的重要二次资源。废催化剂中钴的回收主要采用酸溶−沉淀法[9−15],得到的钴产品主要为氧化钴,其次还有钴粉[16]和环烷酸钴[17]。采用这些方法在一定程度上回收钴、镍等金属,但对钒、钼、铝等其他有价金属的回收不理想;有些工艺流程复杂,成本过高,不利于工业化。目前,人们对回收过程中钴浸出动力学方面的研究较少[18]。在此,本文作者在对某废催化剂中综合回收铝、钒、钼、镍、钴等有价金属进行研究基础上,以废催化剂处理过程中得到的镍钴渣为对象,研究硫酸浸出过程中相关工艺条件对钴浸出的影响,并对浸出钴的动力学进行探讨。
1 实验
1.1 原料和试剂
实验使用的原料来源于石化行业生产过程中废弃的固体催化剂,载体是刚玉型氧化铝。将该废催化剂按如下方式进行处理:废催化剂与一定量的烧碱混合后,在高温下焙烧反应一段时间,再用热水浸取焙烧产物。过滤后,铝、钒、钼等进入浸出液,而镍、钴则富集在水浸渣(镍钴渣)中,物料中主要成分的含量如表 1所示。在焙烧−水浸过程中,镍、钴向氧化物的转化以及大部分氧化铝的溶出为后序硫酸浸取镍钴渣创造了极为有利的条件。实验中所用的硫酸为分析纯,产自株洲市化学工业研究所,浓度为18.4 mol/L,密度为 1.84 g/mL。实验前,先配制几种不同浓度的硫酸。
1.2 实验方法
浸出实验在500 mL 三颈瓶中进行。将三颈瓶置于恒温水浴中,并与电动搅拌机相连。按固液比1:10加入一定浓度的硫酸溶液,开启搅拌并加热,达到预定温度后,迅速加入30 g 镍钴渣。在浸出过程中,温度波动范围为±1 ℃,搅拌速度控制在0~1 500 r/min范围内。每隔一段时间从取样口吸取上层清液2 mL,定容后用PS−6真空型ICP-AES分析液体中的Co2+浓度。为保持三颈瓶内液体体积不变,每次取样后补充相同体积的水。钴的浸取率按下式计算:式中:x(Co)为钴的浸出率,%;iρ为第i次取样液的钴质量浓度,g/L;i为取样次数;m为镍钴渣的质量,g。
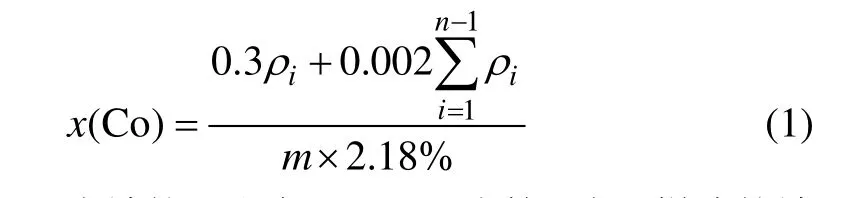
2 结果与讨论
2.1 镍钴渣的硫酸浸出
镍钴渣的硫酸浸出属液−固相非催化反应,在浸出过程中,发生的主要化学反应有:
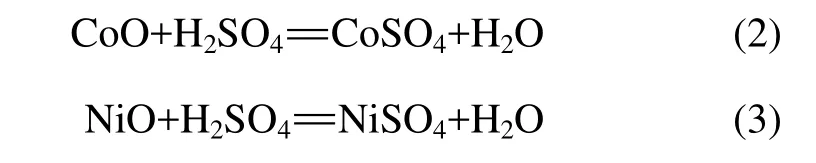
影响钴浸出率的因素有很多,本研究主要考查物料粒度、搅拌速度、硫酸浓度、反应温度及时间对钴浸出率的影响。
2.1.1 物料粒度对钴浸出率的影响
在浸出过程中,粒度是一个非常重要的因素。本研究制备了3种粒径的镍钴渣:0.100~0.200,0.074~0.100和0.043~0.074 mm。图1所示为物料粒度与镍钴渣中钴浸出率的关系,浸出条件是:硫酸浓度为4 mol/L,温度为60 ℃,搅拌速度为800 r/min。
由图1可看出:粒度对钴的浸出有很大的影响,钴的浸出率与原料的粒度有很好的对应关系,粒度为0.043~0.074 mm的原料具有最佳的浸出效果,然而,在这种条件下浸出体系的固液分离较为困难,因此,在后续的实验中采用 0.074~0.100 mm作为浸出的适宜粒度。
2.1.2 搅拌速度对钴浸出率的影响
许多细粒物料的浸出过程都需要通过搅拌来分散悬浮颗粒并使浸出液充分混匀。搅拌速度对钴浸出效果影响的实验按以下条件进行:镍钴渣粒度为0.074~0.100 mm,硫酸浓度为4 mol/L,温度为60 ℃,搅拌速度控制在400~1 200 r/min,实验结果如图2所示。从图2可看出,钴的浸出率与搅拌速度的关系不大,这表明反应物H2SO4和产物CoSO4在溶液和颗粒表面的外扩散速度较快,因此,钴的浸出率与转速无很大关系。为保证搅拌速度的一致性,选用搅拌速度为800 r/min。
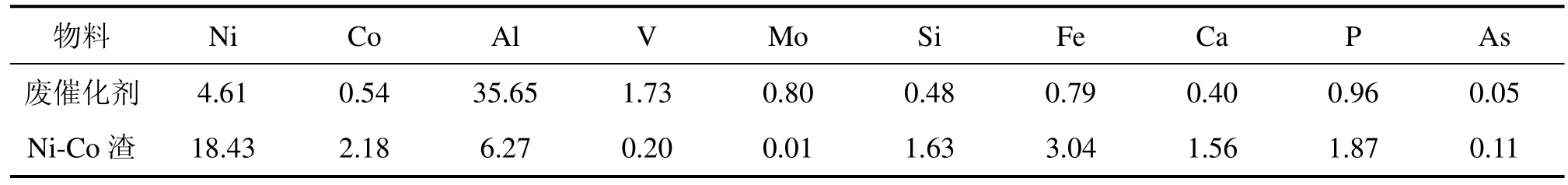
表1 物料的主要化学组成Table 1 Main chemical composition of materials w/%

图1 物料粒度对钴浸出率的影响Fig. 1 Effect of particle size on extraction of cobalt
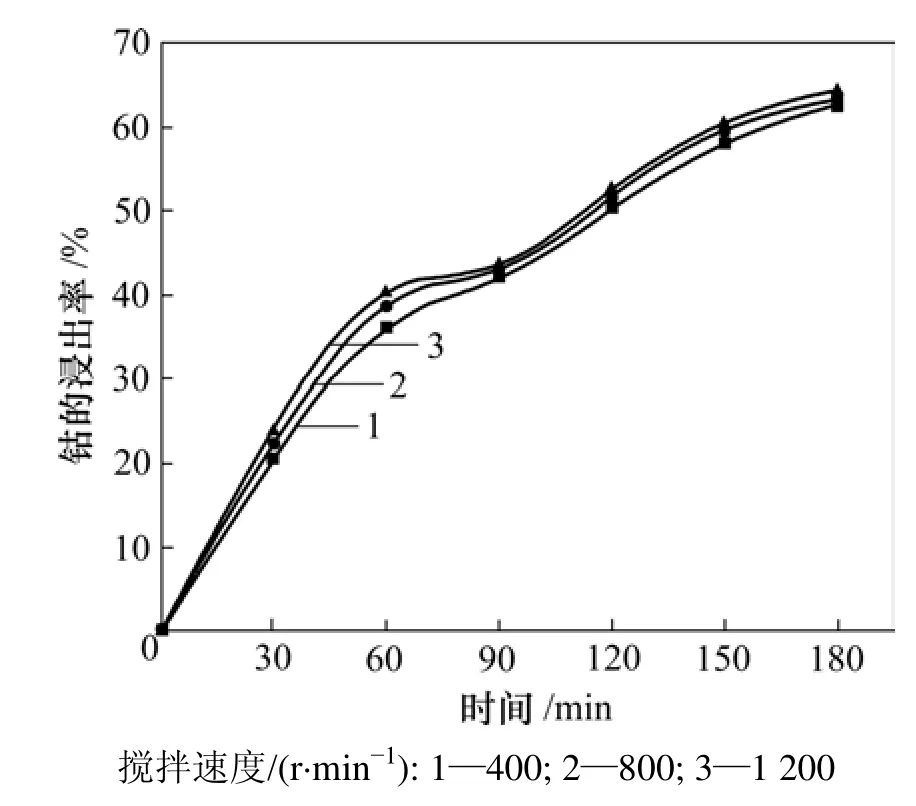
图2 搅拌速度对钴浸出率的影响Fig. 2 Effect of stirring speed on extraction of cobalt
2.1.3 硫酸浓度对钴浸出率的影响
硫酸浓度对钴浸出率的影响如图3所示,浸出条件是:镍钴渣粒度为0.074~0.100 mm,温度为60 ℃,搅拌速度为800 r/min。由图3可知:硫酸浓度对钴浸出率的影响较大,钴浸出率随着硫酸浓度的升高而显著增加;当反应时间为180 min, 硫酸浓度为2,4,6 mol/L时,镍钴渣中钴的浸出率则分别为24.3%,63.0%和85.7%。因此,选择硫酸浓度为6 mol/L。
2.1.4 反应温度对钴浸出率的影响
考查温度对浸出效果的影响可以估计反应的表观活化能、活化焓及反应的活化熵。反应温度对钴浸出率的影响如图4所示,浸出过程采用的原料粒度为0.074~0.100 mm,硫酸浓度为 6 mol/L,搅拌速度为800 r/min,浸出温度的变化范围为40~80 ℃,浸出的固液比为1:10。从图4可以看出:反应温度对钴浸出率有一定影响,钴的浸出率随着反应温度的升高而有所增加。反应时间对钴浸出效果的影响较大;在同一温度下,钴浸出率随反应时间的延长而增加。当浸出温度为80 ℃,反应时间为180 min时,钴的浸出率可达94.2%。

图3 硫酸浓度对钴浸出率的影响Fig.3 Effect of acid concentration on extraction of cobalt

图4 反应温度对钴浸出率的影响Fig.4 Effect of temperature on extraction of cobalt
2.2 镍钴渣硫酸浸出动力学
2.2.1 反应速率控制模型
在液−固反应系统中,反应速率通常是由以下步骤中最慢的一步控制:液膜表面的外扩散、产物/反应物表面的内扩散或反应粒子表面的化学反应[19]。在化学反应中,主要有3种控制模型:粒子表面的化学反应控制模型、扩散控制模型和混合控制模型。
液−固相非催化反应最常见的反应模型为缩芯模型(Shrinking core model)[20]。缩芯模型又分为粒径不变缩芯模型和颗粒缩小缩芯模型。粒径不变缩芯模型的特点是有固相产物层生成,反应过程中颗粒粒径不变。颗粒缩小缩芯模型的特点是在反应过程中,反应物颗粒不断缩小,无固相产物层,产物溶于溶液中。在镍钴渣与硫酸反应过程中,以刚玉形式存在的铝不参与反应,同时还有固体产物CaSO4生成。可采用粒径不变缩芯模型研究其反应动力学。
当化学反应为控制步骤时,缩芯模型动力学方程为[19−20]:

式中:x(Co)为钴的浸出率;t为反应时间;tf为完全反应时间;ρ为镍钴渣密度;r为镍钴渣颗粒初始反应半径;k为反应速率常数;b为氧化钴计量系数;M为氧化钴相对分子质量;k'为反应速率常数;c为流体反应物(硫酸)浓度。对于某一固定体系,且流体反应物浓度近似不变时,tf可视为常数,1/tf则可表示为表观反应速率常数k。
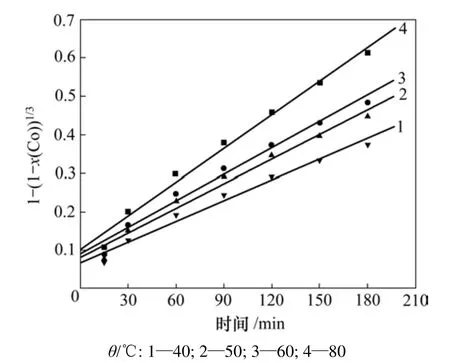
图5 不同反应温度下1−(1−x(Co))1/3与反应时间的关系Fig. 5 Relationship between 1−(1−x(Co))1/3 and reaction time at different temperatures
将图4中的数据代入式(4),绘制出不同反应温度下1−(1−x(Co))1/3与反应时间的关系曲线,如图5所示。由图5可以看出:图中的数据与式(4)的线性关系不明显且直线都不通过原点,因此,推断该浸出反应不符合化学反应控制模型。
当固体产物层内扩散为控制步骤时,缩芯模型动力学方程为[19,21−22]:

式中:D为钴离子在多孔介质中的扩散系数。将图4中的数据代入式(6),绘制出不同反应温度下1−2/3x(Co)−(1−x(Co))2/3与反应时间的关系曲线,如图6所示。由图6可以看出,图中的数据与式(6)呈良好线性关系,且相关系数R2均大于0.999,这表明镍钴渣硫酸浸出反应受产物层内扩散的速率控制。

图6 不同反应温度下 1−2/3x(Co)−(1−x(Co))2/3与反应时间的关系Fig. 6 Relationship between 1−2/3x(Co)−(1−x(Co))2/3 and reaction time at different temperatures
2.2.2 反应活化能的计算
在化学反应中,反应速率常数k是温度的函数,温度对反应速率常数的影响可用阿累尼乌斯公式表示:
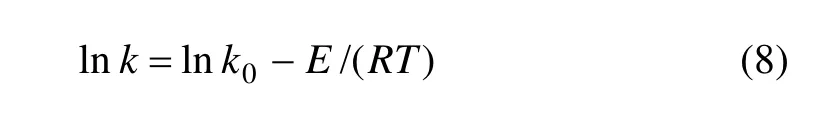
图6中求出的各直线斜率即为不同温度下的反应速率常数k。以lnk对1/T作图,结果如图7所示。根据图7求出直线斜率,由式(8)可得表观活化能 E为16.34 kJ/mol,说明该浸出反应受扩散控制[23−24],与前面控制模型推断结果相一致。反应速率常数k与温度的关系式为:k=0.334 exp(−1 965.7/T)。

图7 lnk与1/T关系图Fig.7 Relationship between lnk and 1/T
2.3 钴镍的回收
通过对镍钴渣的硫酸浸出条件实验,确定浸出的适宜条件如下:H2SO4浓度为 6 mol/L,反应温度为80 ℃,反应时间为 180 min,原料的粒度为0.074~0.100 mm,搅拌速度为 800 r/min,固液比为1:10。浸出过程中,镍也随钴一同被浸出。由分析结果计算得知,在该浸出条件下,钴和镍的浸出率分别达到 94.2%和 93.5%。得到的镍钴酸性浸出液可采用常规的溶剂萃取技术使镍钴分离,这在工业上已是比较成熟的工艺[25−26]。
3 结论
(1) 镍钴渣硫酸浸出过程中,物料粒度、硫酸浓度和反应温度等因素对钴浸出率有较大影响,而搅拌速度为400~1 200 r/min时对钴浸出率的影响非常小。
(2) 采用硫酸浸出镍钴渣,当反应温度为80 ℃,反应时间为180 min,原料的粒度为0.074~0.100 mm,H2SO4浓度为6 mol/L,搅拌速度为800 r/min,固液比为 1:10时,钴的浸出率为 94.2%,镍的浸出率则为93.5%。
(3) 镍钴渣中钴的浸出受产物层内扩散控制,该浸出反应的表观活化能为16.34 kJ/mol。
[1]Cote G. Hydrometallurgy of strategic metals[J]. Solvent Extraction and Ion Exchange, 2000, 18(4): 703−727.
[2]曹异生. 世界钴工业现状及前景展望[J]. 中国金属通报,2007(42): 30−34.CAO Yi-sheng. Current situation and development prospect of global cobalt industry[J]. China Metal Bulletin, 2007(42):30−34.
[3]赵武壮. 应重视钴资源的战略地位[J]. 世界有色金属,2007(10): 6.ZHAO Wu-zhuang. Attach importance to the strategic function of cobalt resources[J]. World Nonferrous Metals, 2007(10): 6.
[4]陈云, 冯其明, 张国范, 等. 废铝基催化剂综合回收现状与发展前景[J]. 金属矿山, 2005(7): 55−58.CHEN Yun, FENG Qi-ming, ZHANG Guo-fang, et al. Current situation and development prospect of comprehensive recovery of spent Al2O3-based catalyst[J]. Metal Mine, 2005(7): 55−58.
[5]Yoo J S. Metal recovery and rejuvenation of metal- loaded spent catalyst[J]. Catalysis Today, 1998, 44(1): 27−46.
[6]李啊林, 梁勇, 程琍琍, 等. 从废旧电池中回收钴镍的研究进展[J]. 中国有色冶金, 2008(3): 57−60.LI A-lin, LIANG Yong, CHENG Li-li, et al. Development of Co-Ni recovery from spent battery[J]. China Nonferrous Metallurgy, 2008(3): 57−60.
[7]喻正军. 从镍转炉渣中回收钴镍铜的理论与技术研究[D]. 长沙: 中南大学资源加工与生物工程学院, 2007.YU Zheng-jun. The study of theory and technology of recovery of Co, Ni and Cu from nickel converter slag[D]. Changsha:School of Resource Processing and Bioengineering, Central South University, 2007.
[8]Kar B B, Murthy B V R, Misra V N. Extraction of molybdenum from spent catalyst by salt-roasting[J]. International Journal of Mineral Processing, 2005, 76(3): 143−147.
[9]Jackson E, Lloyd K J. Enhanced hydrochloric acid leaching of cobalt[J]. Minerals Engineering, 1999, 12(10): 1201−1212.
[10]Valverde I M, Paulino J F, Afonso J C. Hydrometallurgical route to recover molybdenum, nickel, cobalt and aluminum from spent hydrotreating catalysts in sulphuric acid medium[J]. Journal of Hazardous Materials, 2008, 160(2/3): 310−317.
[11]FENG Qi-ming, CHEN Yun, SHAO Yan-hai, et al. New technique of comprehensive utilization of spent Al2O3-based catalyst[J]. Journal of Central South University of Technology,2006, 13(2): 151–155.
[12]潘志信. 湿法回收废催化剂中的钴和钼[J]. 烟台师范学院学报: 自然科学版, 1994, 10(3): 214−216.PAN Zhi-xin. Wet recovering cobalt and molybdenum from waste catalyst[J]. Yantai Teachers University Journal: Natural Science, 1994, 10(3): 214−216.
[13]崔燕, 胡宝兰, 王雄, 等. 钴−钼废催化剂综合利用研究[J].无机盐工业, 2002, 34(1): 36−38.CUI Yan, HU Bao-lan, WANG Xiong, et al. The comprehensiveutilization of spent Co-Mo catalyst[J]. Inorganic Chemicals Industry, 2002, 34(1): 36−38.
[14]林河成. 用含钴催化剂废料制取氧化钴的研究[J]. 江西有色金属, 2000, 14(3): 20−22.LIN He-cheng. A study on preparing cobalt oxide from cobalt-catalyst waste[J]. Jiangxi Nonferrous Metals, 2000, 14(3):20−22.
[15]Rane M V, Bafna V H, Sadanandam R, et al. Recovery of high purity cobalt from spent ammonia cracker catalyst[J].Hydrometallurgy, 2005, 77(3/4): 247−251.
[16]王犇, 孟韵, 段春生. 废钴钼系催化剂中金属的全回收新工艺研究[J]. 现代化工, 2005, 25(S1): 204−206.WANG Ben, MEN Yun, DUAN Chun-sheng. A novel process to comprehensively recover metals from spent Co-Mo catalyst[J].Modern Chemical Industry, 2005, 25(S1): 204−206.
[17]秦玉楠. 利用废钴催化剂生产环烷酸钴新工艺[J]. 中国钼业,2000, 24(5): 30−32.QIN Yu-nan. New technology for producing cobalt napthenate[J].China Molybdenum Industry, 2000, 24(5): 30−32.
[18]Deng C H, Feng Q M, Chen Y. Studies on the leaching kinetics of cobalt from spent catalyst with sulphuric acid[J]. Mineral Processing and Extractive Metallurgy, 2007, 116(3): 159−162.
[19]Levenspiel O. Chemical reaction engineering[M]. New York:Wiley, 1972: 367−383.
[20]朱炳辰. 化学反应工程[M]. 北京: 化学工业出版社, 1993:173−188.ZHU Bing-chen. Chemical reaction engineering[M]. Beijing:Chemical Industry Press, 1993: 173−188.
[21]Abdel-Aal E A, Rashad M M. Kinetic study on the leaching of spent nickel oxide catalyst with sulfuric acid[J].Hydrometallurgy, 2004, 74(3): 189−194.
[22]Mulak W, Miazga B, Szymczycha A. Kinetics of nickel leaching from spent catalyst in sulphuric acid solution[J]. International Journal of Mineral Processing, 2005, 77(4): 231−235.
[23]Souza A D, Pina P S, Lima E V O, et al. Kinetics of sulphuric acid leaching of a zinc silicate calcine[J]. Hydrometallurgy, 2007,89(3/4): 337−345.
[24]Lozano L J, Juan D. Leaching of vanadium from spent sulphuric acid catalysts[J]. Minerals Engineering, 2001, 14(5): 543−546.
[25]LUO Lin, WEI Jian-hong, WU Gen-yi, et al. Extraction studies of cobalt (Ⅱ) and nickel (Ⅱ) from chloride solution using PC88A[J]. Transactions of Nonferrous Metals Society of China,2006, 16(3): 687–692.
[26]Tsakiridis P E, Agatzini S L. Process for the recovery of cobalt and nickel in the presence of magnesium and calcium from sulphate solutions by Versatic 10 and Cyanex 272[J]. Minerals Engineering, 2004, 17(4): 535–543.
