SGLT2抑制剂Dapagliflozin的全合成*
2010-11-27赵桂龙王玉丽徐为人汤立达
邵 华, 赵桂龙, 刘 巍, 王玉丽, 徐为人, 汤立达
(1. 天津药物研究院 a. 天津市新药设计与发现重点实验室; b. 药效学与药代动力学省部共建国家重点实验室,天津 300193)
2型钠葡萄糖共转运子(SGLT2)是近年来发现的一个治疗糖尿病的新靶点,由672个氨基酸组成。血浆葡萄糖在肾小球中被过滤,并在近端小管被主动再吸收返回到血液中。SGLT2分布在肾脏,是控制这一过程的主要蛋白,其作用是吸收原尿中的葡萄糖,并将其返回到血液中。因此抑制SGLT2的活性就能够增加尿中葡萄糖的排泄从而降低血糖浓度,这个方法从与以往不同的途径降低了血糖水平。由于SGLT2抑制剂不介入葡萄糖代谢,它可以作为一种新颖的血糖控制方法[1,2]。
Dapagliflozin(Ⅰ)是由Bristol-Myers Squibb公司[3]开发的一种SGLT2抑制剂,目前处于Ⅲ期临床阶段,预计2011年或2012年上市。我们在研究SGLT2抑制剂的过程中[4],全合成了Ⅰ(Scheme 1)用作药理学实验的阳性对照。在全合成过程中对文献方法[3]进行了改进,大幅度提高了收率并简化了操作过程。
1 实验部分
1.1 仪器与试剂
X-4型数字显示显微熔点仪;Bruker AV-400型核磁共振谱仪(DMSO-d6为溶剂,TMS为内标)。所用试剂均为分析纯。
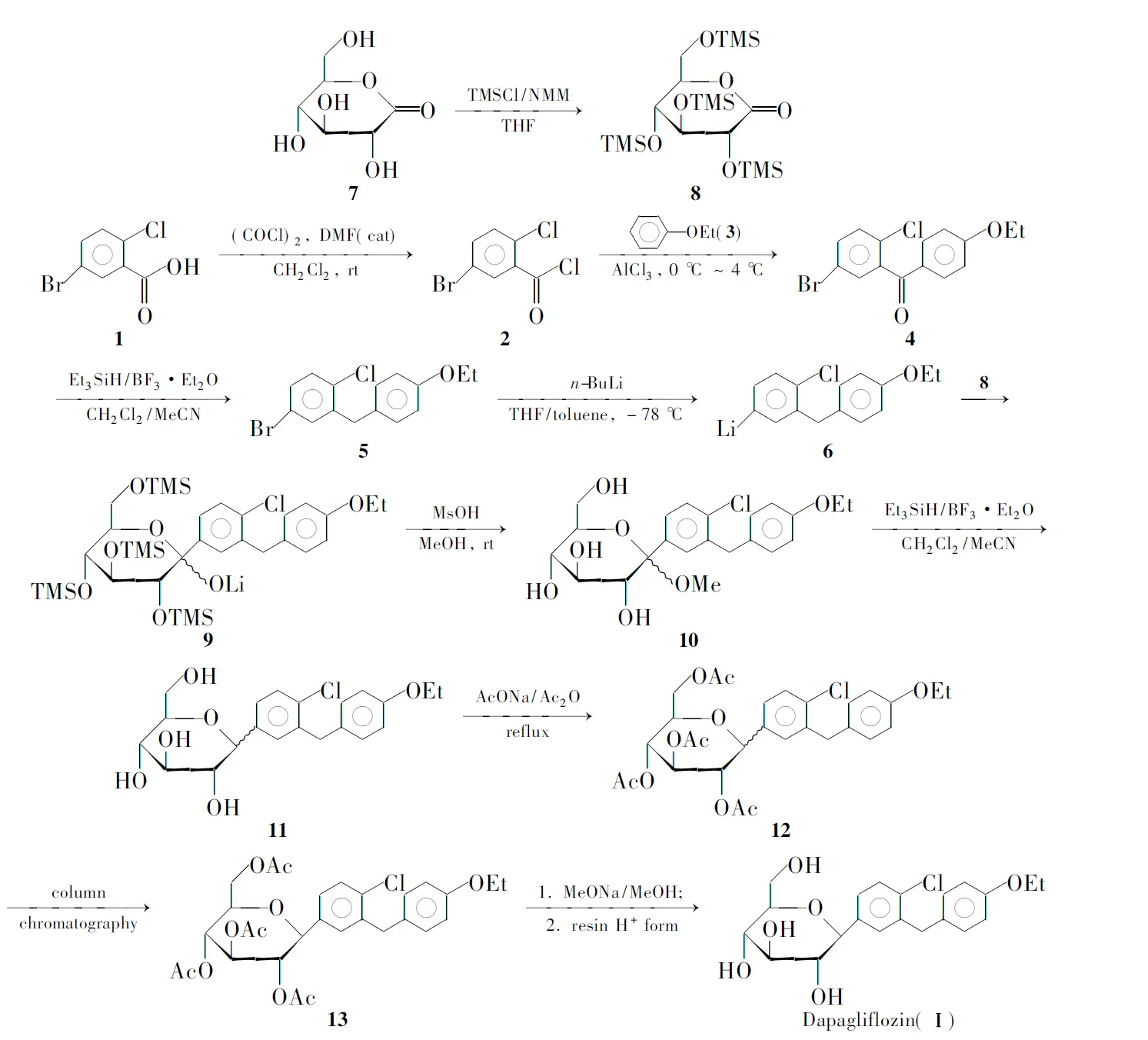
Scheme 1
1.2 合成
(1) 2,3,4,6-四-O-三甲基硅烷基-D-葡萄糖酸内酯(8)的合成
在烧瓶中依次加入D-葡萄糖酸内酯(7) 4.81 g(27.0 mmol),N-甲基吗啡啉(NMM)25 mL(217.5 mmol) 和干燥THF 50 mL,冰水浴冷却,搅拌下缓慢滴加三甲基氯硅烷(TMSCl) 20 mL(167.4 mmol),滴毕,于室温反应过夜。加入甲苯200 mL稀释,冰水冷却下小心滴加100 mL水,分出有机相,依次用饱和磷酸二氢钠水溶液和饱和食盐水各50 mL洗涤,无水硫酸钠干燥,减压蒸除溶剂得淡黄色油状物812.60 g,产率100%;1H NMRδ: 4.19~4.21(m, 1H), 4.02(d,J=8.0 Hz, 1H), 3.67~3.84(m, 4H), 0.06~0.28(m, 36H)。
(2) (5-溴-2-氯苯基)(4-乙氧基苯基)甲酮(4)的合成
在烧瓶中依次加入5-溴-2-氯苯甲酸(1) 4.71 g(20.0 mmol),干燥的二氯甲烷10 mL,草酰氯2 mL(23.6 mmol)和二甲基甲酰胺1滴,瓶口加装CaCl2干燥管,搅拌下于室温反应过夜。减压蒸去二氯甲烷和过量的草酰氯得红色透明液体即为5-溴-2-氯苯甲酰氯(2)的粗品。以干燥二氯甲烷5 mL溶解,加入苯乙醚(3) 2.50 g(20.5 mmol)。冰水浴冷却,搅拌下分批加入无水三氯化铝2.80 g(21.0 mmol),搅拌下于室温反应2 h(TLC跟踪)。小心倒入搅动的冰水(100 mL)中,用二氯甲烷(3×50 mL)提取,合并有机相,依次用10%稀盐酸,10%氢氧化钠水溶液和饱和食盐水各50 mL洗涤,无水硫酸钠干燥,减压蒸去溶剂得4的粗品,经硅胶柱层析[洗脱剂:A=V(乙酸乙酯) ∶V(石油醚)=1 ∶20]分离得无色棱柱状晶体44.80 g,产率70.6%, m.p. 69 ℃~70 ℃(60 ℃[3]);1H NMRδ: 7.71~7.76(m, 2H), 7.67(d,J=8.8 Hz, 2H), 7.54(d,J=8.4 Hz, 1H), 7.06(d,J=8.8 Hz, 2H), 4.13(q,J=7.0 Hz, 2H), 1.34(t,J=7.0 Hz, 3H);13C NMRδ: 191.10, 163.43, 140.45, 133.96, 132.15, 131.66, 131.01, 128.81, 127.99, 120.26, 114.75, 63.76, 14.36。
(3) (5-溴-2-氯苯基)(4-乙氧基苯基)甲烷(5)的合成
在烧瓶中依次加4 4.80 g(14.1 mmol),干燥二氯甲烷2 mL,乙腈2 mL和三乙基硅烷5 mL(31.4 mmol),冰水浴冷却,搅拌下缓慢滴加三氟化硼乙醚3 mL(23.8 mmol),滴毕,瓶口加装CaCl2干燥管,搅拌下于室温反应过夜(TLC跟踪)。冷却下小心加入10%氢氧化钾水溶液50 mL,搅拌10 min后再加水100 mL稀释,用二氯甲烷(3×50 mL)提取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩后的黄色油状物经硅胶柱层析(洗脱剂:A=1 ∶40)纯化得淡黄色晶体53.76 g,产率81.8%, m.p.40 ℃~41 ℃(37 ℃[3]);1H NMRδ: 7.49(d,J=2.4 Hz, 1H), 7.42, 7.44(dd,J=2.4 Hz, 8.4 Hz, 1H), 7.38(d,J=8.4 Hz, 1H), 7.11(d,J=8.4 Hz, 2H), 6.84(d,J=8.4 Hz, 2H), 3.94~3.99(m, 4H), 1.29(t,J=7.0 Hz, 3H);13C NMRδ: 157.05, 141.47, 133.46, 132.31, 131.20, 130.72, 130.34, 129.66, 120.02, 114.39, 62.85, 14.60。
(4) 1-{4-氯-3-[(4-乙氧基苯基)甲基]苯基}-α/β-D-吡喃甲基葡萄糖苷(10)的合成
在烧瓶中加入53.76 g(11.6 mmol),干燥THF 5 mL和甲苯10 mL,氮气保护,用橡胶塞封口,用液氮-无水乙醇降温至-78 ℃,搅拌下用注射器滴加1.6 mol·L-1正丁基锂正己烷溶液8 mL,滴毕,反应30 min得含6的溶液。用注射器滴加8 12.60 g(27.0 mmol)的甲苯(20 mL)溶液,反应30 min后再加入甲基磺酸2.0 g(20.8 mmol)的无水甲醇(20 mL)溶液,于室温反应12 h。加水100 mL,用乙酸乙酯(3×50 mL)提取,合并有机相,依次用饱和碳酸氢钠水溶液和饱和食盐水各50 mL洗涤,无水硫酸钠干燥,减压蒸除溶剂得黄色油状物10(未经纯化直接用于下一步反应) 4.54 g,产率89.6%。
(5) 2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)甲基]苯基}-1-脱氧-β-D-吡喃型葡萄糖(13)的合成
在烧瓶中依次加入104.54 g(10.4 mmol),干燥二氯甲烷20 mL,干燥乙腈5 mL和三乙基硅烷2 mL(12.6 mmol),冰水冷却下缓慢滴加三氟化硼乙醚2 mL(15.9 mmol),滴毕,于室温反应过夜。加饱和碳酸氢钠水溶液100 mL,用二氯甲烷(3×50 mL)提取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩得黄色油状物粗品11。加入乙酸酐50 mL,无水乙酸钠2.0 g(24.4 mmol),搅拌下回流反应1 h。冷却至室温后倒入100 mL冰水中,搅拌2 h,用二氯甲烷(3×50 mL)提取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩得黄色油状物12,经硅胶柱层析(洗脱剂:A=1 ∶3)纯化得白色晶体13 3.98 g,产率66.7%, m.p.130 ℃(120 ℃[3]);1H NMRδ: 7.41(d,J=8.0 Hz, 1H), 7.24(d,J=8.4 Hz, 1H), 7.21(d,J=0.8 Hz, 1H), 7.05(d,J=8.4 Hz, 2H), 6.81(d,J=8.4 Hz, 2H), 5.34(t,J=9.6 Hz, 1H), 5.06(t,J=9.6 Hz, 1H), 4.93(t,J=9.6 Hz, 1H), 4.65(d,J=9.6 Hz, 1H), 4.01~4.14(m, 3H), 3.92~3.98(m, 4H), 2.00(s, 3H), 1.99(s, 3H), 1.91(s, 3H), 1.68(s, 3H), 1.28(t,J=7.0 Hz, 3H);13C NMRδ: 170.03, 169.55, 169.34, 168.43, 156.94, 138.45, 136.20, 132.93, 130.88, 130.10, 129.57, 129.35, 126.49, 114.30, 77.28, 74.55, 73.18, 72.29, 68.37, 62.87, 62.24, 37.37, 20.47, 20.37, 20.24, 19.97, 14.61。
(6) Ⅰ的合成
在烧瓶中加入无水甲醇20 mL,金属钠0.10 g(4.3 mmol),搅拌使其溶解后加入13 3.98 g(6.9 mmol), 搅拌下于室温反应3 h(TLC跟踪)。加入适量强酸性阳离子交换树脂,搅拌过夜至pH 7时,加入甲醇100 mL,抽滤,滤液减压蒸除溶剂,室温下真空干燥得类白色固体Ⅰ 2.82 g,产率100%, 纯度高于99%;1H NMRδ: 7.36(d,J=8.4 Hz, 1H), 7.31(d,J=1.6 Hz, 1H), 7.21, 7.23(dd,J=1.8 Hz, 8.2 Hz, 1H), 7.08(d,J=8.4 Hz, 2H), 6.82(d,J=8.4 Hz, 2H), 4.91, 4.92(dd,J=1.4 Hz, 4.6 Hz, 2H), 4.79(d,J=5.6 Hz, 1H), 4.41(t,J=5.8 Hz, 1H), 3.92~4.02(m, 5H), 3.67~3.71(m, 1H), 3.41~3.46(m, 1H), 3.07~3.28(m, 4H), 1.29(t,J=7.0 Hz, 3H);13C NMRδ: 156.87, 139.65, 137.77, 131.88, 131.18, 130.77, 129.53, 128.62, 127.31, 114.27, 81.18, 80.67, 78.29, 74.68, 70.28, 62.86, 61.34, 37.63, 14.65。
2 结果与讨论
在用三乙基硅烷/三氟化硼乙醚还原4的过程中,我们对反应条件进行了改进,大幅度减少了溶剂的用量,提高了反应物的浓度,使反应在较短时间和较低温度(室温)下即可进行完全,避免了原先需要加热才能使反应完全进行的状况。
文献[3]方法对10的纯化大大降低了产率;本文直接使用10的油状物粗品,减少了损失提高了产率。
在11的全乙酰化反应中彻底改进了文献[3]方法,用无水乙酸钠为催化剂,用乙酸酐为酰化试剂在140 ℃完成酰化,实验操作和产品后处理都较文献[3]方法简便易行,且收率较高,避免了使用昂贵的4-二甲氨基吡啶。
13的脱乙酰化反应在含有催化量甲醇钠的无水甲醇溶液中室温下顺利进行,而后经过离子交换树脂脱钠离子,避免了加热反应和涉及酸碱的后处理,使该步收率大幅度提高到接近100%。
[1] 埃尔斯沃斯·B,沃什伯恩·W·N,谢尔·P·M.C-芳基葡糖苷SGLT2抑制剂和方法[P].CN 03 811 353.8,2005.
[2] Francisco C, Kinne R K H, Wilhelm B. Thioglycosides as pharmaceutically active agents[P].EP 1 854 806, 2007.
[3] Meng W, Ellsworth B A, Nirschl A A,etal. Discovery of dapagliflozin:A potent,selective renal sodium-dependent glucose cotransporter 2(SGLT2) inhibitor for the treatment of type 2 ciabetes[J].J Med Chem,2008,51:1145-1149.
[4] 王致峰,赵桂龙,王玉丽,等. 苯萘基糖苷类化合物的合成及其治疗糖尿病的活性[J].合成化学,2009,17(5):570-573.
