稀有酮糖中间体的合成*
2010-11-27方志杰
李 松, 方志杰, 程 杰
(南京理工大学 化工学院,江苏 南京 210094)
稀有酮糖是指自然界中少量存在的酮糖及其衍生物,这类物质通常都具有很高的生物活性:如从鳄梨果实中提取的D-甘露庚酮糖[1],可以通过调节生物体内的胰岛素分泌达到治愈肥胖的目的,同时还具有抗癌、预防和治疗一些先天免疫疾病的功效[2,3];利用蛋白质中的氨基与D-阿洛酮糖结合,增加水溶性促进分子间交联,是目前新兴的研究热点[4];此外大多稀有己酮糖还是新型低热量吸收甜味剂[5,6]。
虽然稀有酮糖具有如此优秀的生物活性,但是由于天然分布极少,单纯依靠分离提取远不能满足人们的需要。Robert和Horace[7]以低碳的赤藓糖或树胶醛糖为原料,与二羟基丙酮或硝化甘油醇进行亲核加成增长碳链制备高碳酮糖。由于加成的立体选择性较差,导致差向异构产物较多,分离难度大;Dieter课题组[8]通过非糖物质分子间的羟醛缩合反应,制备稀有己酮糖,但是此过程需要多个手性中心的构建,对反应条件及试剂要求较为苛刻。本课题组近期也利用烯烃选择性氧化得到α-羟基酮结构合成D-甘露庚酮糖[9]。如何找到一种通用简便的方法合成稀有酮糖及衍生物一直是有机合成工作者的努力目标。
Morin课题组[10]报道了一种通过甲基锂与二碘甲烷对内酯羰基加成,从而增长碳链的方法。我们在其工作基础上进行了改进,选择较甲基锂更易制得的正丁基锂,与二碘甲烷生成碘甲基锂对糖酸内酯羰基进行加成增长碳链,再在碱性环境中水解即可得到重要稀有酮糖中间体(3a~3e, Scheme 1),其结构经NMR确认。3不仅可通过进一步脱保护得到稀有酮糖,还可以直接用作其它重要天然产物的合成砌块。
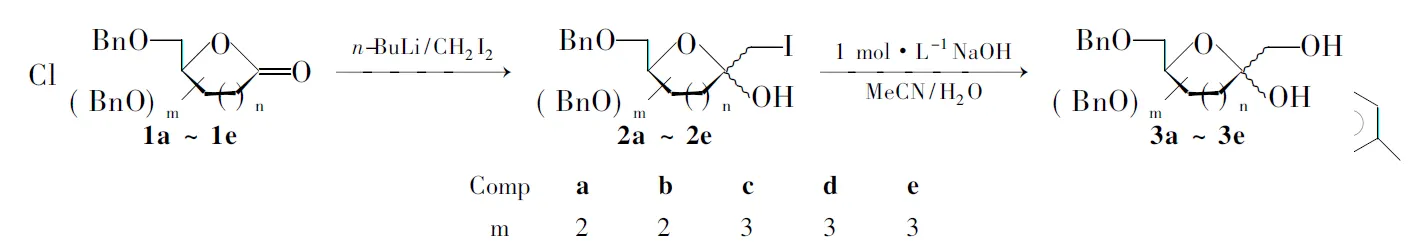
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker DRX300型核磁共振仪(CDCl3为溶剂,TMS为内标)。
全苄基保护的糖酸内酯(1a~1e)按文献[11]方法自制;其余所用试剂均为分析纯。
1.2 合成
在三口瓶中加入1 2.79 mmol,无水甲苯60 mL,二碘甲烷0.53 mL(6.39mmol),搅拌下于-78 ℃冷却10 min, N2保护下缓慢滴加1.6 mol·L-1正丁基锂(5.60 mmol)的正己烷溶液3.5 mL,滴毕,于-65 ℃反应1.5 h。加入饱和NH4Cl溶液15 mL,于室温搅拌10 min后用二氯甲烷(2×20 mL)萃取,合并有机相,用无水Na2SO4干燥,浓缩得淡黄色糖浆状液体2。
2用乙腈(35 mL)溶解后加入1 mol·L-1氢氧化钠溶液15 mL,水10 mL,搅拌下于室温反应3 h。用1 mol·L-1盐酸调节至pH 8,用乙酸乙酯(3×20 mL)萃取,合并萃取液,用无水Na2SO4干燥,浓缩后经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶2]分离得淡黄色糖浆状液体3。
3,4,6-三-O-苄基-阿洛酮糖(3a): 总产率32%;1H NMRδ: 1.26(br, 1H), 2.09(br, 1H), 3.50~3.84(m, 3H), 4.00~4.14(m, 1H), 4.21~4.28(m, 1H), 4.32~4.44(m, 1H), 4.48~4.54(m, 1H), 4.56~4.64(m, 3H), 4.67~4.80(m, 1H), 4.90(dd,J=12.21 Hz, 27.54 Hz, 1H), 5.05~5.10(m, 1H), 7.18~7.39(m, 15H);13C NMRδ: 60.53, 67.02, 71.53, 72.66, 73.32, 73.59, 74.07, 75.85, 97.36, 127.54, 127.56, 136.84, 137.11, 137.36。
3,4,6-三-O-苄基-山梨酮糖(3b): 总产率41%;1H NMRδ: 2.18(br, 1H), 2.57(br, 1H), 3.23~3.51(m, 2H), 3.58~3.79(m, 3H), 3.88~4.14(m, 2H), 4.45~4.69(m, 4H), 4.73~5.09(m, 2H), 7.18~7.34(m, 15H);13C NMRδ: 60.66, 65.02, 71.16, 73.07, 74.26, 75.17, 75.40, 78.26, 97.10, 126.72, 129.26, 137.98, 137.62, 137.48。
3,4,5,7-四-O-苄基-葡萄庚酮糖(3c): 总产率42%;1H NMRδ: 2.13(br, 1H), 2.78(br, 1H), 3.46(d,J=12.90 Hz, 1H), 3.54(d,J=9.42 Hz, 1H), 3.60~3.67(m, 2H), 3.75~3.88(m, 1H), 3.97(m, 1H), 4.03(d,J=9.42 Hz, 1H), 4.08~4.13(m, 1H), 4.43~4.55(m, 3H), 4.58~4.67(m, 1H), 4.74(s, 1H), 4.82(d, J=10.92 Hz, 1H), 4.87~4.95(m, 2H), 7.00~7.29(m, 20H);13C NMRδ: 65.51, 68.82, 71.13, 73.30, 74.83, 75.32, 75.56, 78.30, 78.94, 83.32, 97.36, 127.55, 128.41, 138.54, 138.34, 138.12, 137.72。
3,4,5,7-四-O-苄基-甘露庚酮糖(3d): 总产率40%;1H NMRδ: 1.86(br, 1H), 2.61(br, 1H), 3.26(d,J=11.37 Hz, 1H), 3.40~3.62(m, 1H), 3.65~3.71(m, 2H), 3.79(d,J=9.18 Hz, 1H), 3.88(d,J=9.42 Hz, 1H), 3.94~4.02(m, 1H), 4.11(dd,J=2.67 Hz, 9.18 Hz, 1H), 4.46~4.54(m, 3H), 4.57~4.67(m, 2H), 4.82(d,J=10.68 Hz, 1H), 4.88(d,J=4.41 Hz, 1H), 4.94(d,J=11.64 Hz, 1H), 7.16~7.38(m, 20H);13C NMRδ: 65.34, 68.80, 71.39, 71.80, 72.29, 73.41, 73.97, 74.48, 75.33, 80.65, 96.27, 126.58, 127.47, 137.09, 137.35, 137.43, 137.52。
3,4,5,7-四-O-苄基-半乳庚酮糖(3e): 总产率41%;1H NMRδ: 1.68(br, 2H), 3.34~3.54(m, 3H), 3.59~3.70(m, 2H), 4.00(d,J=1.62 Hz, 2H), 4.10~4.15(m, 1H), 4.30~4.40(m, 1H), 4.44(d,J=3.36 Hz, 1H), 4.49~4.78(m, 5H), 4.94(d,J=11.28 Hz, 1H), 7.20~7.38(m, 20H);13C NMRδ: 65.69, 68.62, 70.04, 72.36, 73.18, 74.28, 74.32, 75.23, 75.43, 80.52, 97.47, 127.31, 128.20, 137.60, 137.72, 138.13, 138.46。
2 结果与讨论
由于甲基锂的制备原料碘甲烷是气体,在实验室中很难进行定量操作,因而我们选择了较甲基锂更易制得的正丁基锂作为反应试剂,两步反应取得了中等产率。
碘甲基锂试剂热稳定性差,反应需要在-60 ℃下进行,否则会分解失效;第一步加成完毕得到中间体极性与原料相近,给分离带来一定难度,因此我们采取不经提纯直接水解的方法,大大降低了分离难度;由卤素转变为羟基方法很多,其中以强碱环境下水解最为简便有效[12],所以我们采取在1 mol·L-1氢氧化钠溶液环境下,对碘代亚甲基进行水解,即得到重要稀有己酮糖及庚酮糖中间体,这五种苄基保护稀有己酮糖和庚酮糖中间体均系首次由此方法合成。
[1] Stankovic L, Bilik V. Occurrence and preparation of D-manno-heptulose[J].Chemicke Listy,1986,80:520-527.
[2] Board M, Colquhoun A, Newsholme E A. High km glucose-phosphorylating(glucokinase) activities in a range of tumor cell lines and inhibition of rates of tumor growth by the specific enzyme inhibitor mannoheptulose[J].Cancer Research,1995,55:3278-3285.
[3] Xu L Z, Weber I T, Harrison R W,etal. Sugar specificity of humanb-cell glucokinase:Correlation of molecular models with kinetic measurements[J].Biochemistry,1995,34:6083-6092.
[4] Yuanxia S, Shigerru H, Ken I. Modification of ovalbumin with a rare ketohexose through the Maillard reaction:Effect on protein structure and gel properties[J].J Agric Food Chem,2004,52:1293-1299.
[5] Matuso T, Baba Y, Hashiguchi M,etal. Dietary D-psicose, a C-3 epimer of D-fructose,suppresses the activity of hepatic lipogenic enzymes in rats[J].Asia Pacific J Clin Nutr,2001,10:233-237.
[6] Buetusiwa T M, Wayoon P, Khim L,etal. Efficient biosynthesis of D-allose from D-psicose by cross-linked recombinant L-rhamnose isomerase:Separation of product by ethanol crystallization[J].Journal of Bioscience and Bioengineering,2006,4:340-345.
[7] Schaffer R, Sbell H S. Synthesis of higher ketoses by aldol reactions.Ⅰ.Three D-heptuloses[J].J Org Chem,1962,27:3268-3270.
[8] Dieter E, Christoph G. Direct organocatalyst De novo synthesis of carbohydrates[J].Angew Chem Int Ed,2005,44:1210-1212.
[9] Cheng J, Fang Z J, Li S,etal. An effcient synthesis of D-mannoheptulose via oxidation of an olefnated sugar with potassium permanganate in aqueous acetone[J].Carbohydr Res,2009,344:2093-2095.
[10] Bernard B, Christophe M. Iodomethylation of lactones;application to the synthesis of 1-deoxy-1-iodo-2-uloses[J]. Synlett,2000,11:1691-1693.
[11] Hiroyoshi K, Hewitt G. Synthesis with partially benzylated augars.Ⅷ.Substitution at C-5 in an aldose.The synthesis of 5-O-methyl-D-glucofuranose derivatives[J].J Org Chem,1967,32:2531-2534.
[12] Kampf A, Dimant E. Hydroxymethylation of 2,3 ∶5,6-di-O-isopropylidene-D-mannono-1,4-lactone.A synthesis of D-manno-heptulose[J].Carbohydr Res,1974,32:380-382.
