新型4-羟基香豆素衍生物的合成
2010-11-26董小萍
黄 维, 董小萍, 邵 培, 韩 波
(1. 成都中医药大学 药学院,四川 成都 610017; 2. 成都363医院,四川 成都 610041)
研究发现,一些4-取代香豆素类化合物具有令人意想不到的抗肿瘤或抗HIV活性[1~3]。4-羟基香豆素类化合物作为香豆素类化合物家族的重要成员,因其具有抗凝血、抗真菌、消炎[4,5]等多种重要生理活性,而被广泛应用于医药、农药及染料中间体的生产,具有较高的经济价值和医药价值。对该类化合物的构效关系研究表明,在香豆素的苯环上引入羟基、烃基、呋喃、单糖等取代基能不同程度地改善该类化合物的活性,因此,对4-羟基香豆素衍生物的合成及其构效关系进行研究具有重要的科学意义和现实意义。
本文以7-位单取代的4-羟基香豆素为研究对象,对其苯环进行结构修饰,合成了7个新型的7-位具有不同性质取代基的香豆素类衍生物(1b~1h),希望能通过对不同取代基的此类化合物的合成、生物活性与构效关系进行研究,寻找到具有优良生物活性的4-羟基香豆素衍生物。目前,相关药理特性研究正在进行中。
目前合成4-羟基香豆素(1a)的方法主要有4种:酚法、乙酰水杨酸法、水杨酸甲酯法和2-羟基苯乙酮法。其中酚法的反应收率较低,试剂较昂贵[6];乙酰水杨酸法反应路线较长,操作繁琐[7];水杨酸甲酯法反应温度很高,同时反应过程中金属钠的使用增加了工业生产的危险度[8]。本文选择2-羟基苯乙酮法[9]为研究路线。以4-取代基-2-羟基苯乙酮(1a~1h, Scheme 1)为原料,碳酸二乙酯为酰化试剂,在碱催化下经一步反应合成了2a~2h(Scheme 1),其结构经1H NMR表征。
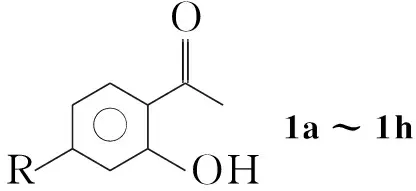
Scheme1
1 实验部分
1.1 仪器与试剂
Bruker AC-E400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Waters Q-TOF MS型高分辨质谱仪。所用试剂和溶剂均为市售分析纯。
1.2 2的合成(以2a为例)
在反应瓶中加入2-羟基苯乙酮(1a)1.4 mL(12 mmol),碳酸二乙酯2.1 mL(18 mmol)及DMSO 3 mL,搅拌下滴加氢化钠1.4 g(60 mmol)的DMSO(30 mL)溶液,滴毕,于100 ℃反应2 h(TLC跟踪)。加入乙酸乙酯50 mL,有机层用水洗三次,蒸出乙酸乙酯,浓缩、析晶、抽滤,滤饼用水洗数次后用67%乙醇重结晶得淡黄色晶体2a;1H NMRδ: 12.48(br s, 1H), 7.82(d,J=7.20, 1H), 7.67~7.58(m, 1H), 7.38~7.30(m, 2H), 5.88(s, 1H)。
用类似的方法(DMSO 6 mL)合成2b~2h。
2a~2h的实验结果见表1;2b~2h的1H NMR和ESI-HR-MS数据见表2。

表1 2a~2h的实验结果*Table 1 The experimental resuts of 2a~2h
*反应条件同1.2
2 结果与讨论
2.1 取代基对产率的影响
2-羟基苯乙酮衍生物α-氢的活泼性与产率相关。因此当R为供电子基团时,R的供电效应使得α-氢的活泼性降低,反应较慢,产率较低;当R为吸电子基团时,α-氢的活泼性较高,碱容易拉掉该质子,反应易于发生,产率较高(表1)。
反应所用碱(NaH)的量应是底物的2倍以上,保证α-氢顺利离去而形成碳负离子,同时2-位酚羟基也能在碱作用下脱去质子,进攻酯的羰基而环合生成4-羟基香豆素衍生物。
2.2 合成
合成2a,文献[9]所用溶剂和碱分别是甲苯和氢化钠。由于甲苯毒性较大,沸点较高,后处理时较难除去;氢化钠后遇水会短时放出大量的热等缺点。我们将溶剂和碱分别换为四氢呋喃和叔丁醇钾,反应温度控制在60 ℃。结果表明,虽然叔丁醇钾的碱性略大于氢化钠,但反应温度较低,只有当反应时间延长到4 h才能获得80%以上的产率;合成取代基为供电子基的衍生物时,产率仅为30%~45%。DMSO因其水溶性较好,后处理水洗即可,毒性较甲苯低,而且与氢化钠形成更强的碱(CH3SOCH2Na),能迅速拉掉1a的α-氢使反应速度加快。结果表明,将DMSO和氢化钠作为反应条件,反应时间较文献缩短1 h,收率由82%[9]增加到88%。
反应中滴加氢化钠的DMSO溶液时,速率应控制在2 mL·s-1左右,滴加过快会使碱液的局部浓度过高,生成深色物质,从而影响产品质量与反应收率;反应完毕后,加水萃取时会出现乳化现象,可用10%NaCl代替蒸馏水;在合成中,重结晶将文献的纯乙醇改成67%乙醇,缩短了重结晶的时间并减少重结晶的损失。
该法通过“一锅煮”的方式反应,操作较简便,反应时间较短,可用于合成7-取代基-4-羟基香豆素的衍生物。

表2 2b~2h的1H NMR和ESI-HR-MS数据Table 2 1H NMR and ESI-HR-MS data of 2b~2h
[1] Karen A Nolan, He Zhao, Paul F Faulder,etal. Coumarin-based inhibitors of human NAD(P)H:Quinone oxidoreductase-1.Identification,structure-activity,off-target effects and In vitro human pancreatic cancer toxicity[J].J Med Chem,2007,50:6316-6325.
[2] Alison C Donnelly, Jared R Mays, Joseph A Burlison,etal. The design,synthesis,and evaluation of coumarin ring derivatives of the novobiocin scaffold that exhibit antiproliferative activity[J].J Org Chem,2008,73:8901-8920.
[3] Paul Cos, Louis Maes, Dirk Vanden Berghe,etal. Plant substances as anti-HIV agents selected according to their putative mechanism of action[J].J Nat Prod,2004,67:284-293.
[4] Mladen Deželiĉ, Mladen Trkovnik. Syntheses of some 4-hydroxycoumarins and their condensation products with aldehydes and carboxylic acids.The anticoagulant activity of some 4-hydroxycoumarin derivatives[J].J Med Chem,1964,7(3):284-288.
[5] Soroush S, Yokim, Kiyoshi H. Synthesis and antifungal activity of coumarins and angular furanocoumarins[J].Bioorg Med Chem,1999,7:1933-1940.
[6] Shah V R. New synthesis of 4-hydroxycoumarins[J].J Org Chem,1960,25:677.
[7] Tomek B, Indruch M, Gabriel J S. 4-Hydroxycoumarin[J].Czech,1974:153829.
[8] Mark Arnold Stahmann, Ivan Wolff, Karl Paul Link. Studies on 4-hydroxycoumarins.Ⅰ.The synthesis of 4-hydroxycoumarins[J].J Am Chem Soc,1943,65:2285-2287.
[9] Jung J C, Jung Y J, Park O S A. Convenient one-pot synthesis of 4-hydroxycoumarin,4-hydroxythiocoumarin,and 4-hydroxyquinolin-2(1H)-one[J]. Synth Commun,2001,31:1195.
