以尿液毒性羰基物质测评亚健康状态的简捷方法
2010-11-26谢伏霞刘圣林陈珂珂朱泽瑞李国林印大中
谢伏霞,刘圣林,陈珂珂,朱泽瑞,李国林,印大中
(湖南师范大学生命科学学院,蛋白质化学与发育生物学重点实验室,湖南 长沙 410081)
在能量代谢或种种应激状态下,机体内的生物分子往往会遭遇氧应激或糖应激.这些应激的水解产物主要有丙二醛(malondialdehyde, MDA)、4-羟基壬烯醛(4-hydroxynonenal,4-HNE)或甲基乙二醛(methyglyoxal)等不饱和毒性羰基类物质(reactive carbonyl substances,RCS).这些不饱和羰基类物质具有广泛的生物活性,在生理pH条件下能进一步与含氨基的生物大分子(如: 神经递质、蛋白质、核苷酸等)自发反应,造成它们的结构改变和功能丧失,进而导致一系列与衰老和疲劳相关的损变或老年退行性疾病.如:冠心病、糖尿病、动脉粥样硬化、心肌梗塞和自身免疫性疾病等.另外,体内的这些不饱和毒性羰基类物质还是谷胱甘肽下降、细胞膜损坏、酶功能抑制、免疫混乱、遗传变异、细胞复制受阻等病理变化的重要原因和主要测定指标[1].现有的研究和文献报道大多侧重在对于血清或血浆和机体组织样本中RCS的测定[2-3].尿液是高等动物体内最重要的内循环代谢产物,同时也是最易被受检者接受的可以无损采集的样本.尿液中含有能全面系统地反映生物体健康状况的信息,但目前对尿液中RCS的测定方法仍较为繁琐,例如最常用的硫代巴比妥酸反应物法(TBARS法)或称TBA法[4].TBA法或与之配套的荧光检测为了追求检测灵敏度而采用煮沸反应液,并对煮沸产生的大量蛋白质沉淀物需进行有机溶剂抽提等操作,造成了许多繁琐的操作过程和误差源头.例如,1)反应中的煮沸反应过程容易造成铁离子或铜离子诱导的脂质过氧化反应和蛋白质羰基的离解反应;2) 也容易造成溶液沸腾汽化而操作失误;3)尤其是需要配置较昂贵的仪器设施等,不便社区医院等基层单位展开简单快速地大样本检测.本文研究并介绍一种新的RCS-585 方法,本方法的反应过程无需煮沸(只需45 ℃水浴),操作简便,无需双液相抽提离心操作,对MDA和4-羟基烯醛特异性高,反应物稳定性好,方法学检验和临床应用都获得了令人满意的结果.
1 实验原理
一分子RCS,如MDA或4-HNE可与二分子N-甲基-2-苯基吲哚(N-methyl-2-phenylindole)在轻微加热的条件下反应生成稳定的紫蓝色物质,这些物质在585 nm处有最大的吸收峰,在分光光度计上读取585 nm处的吸光值,从而可以计算RCS的含量.
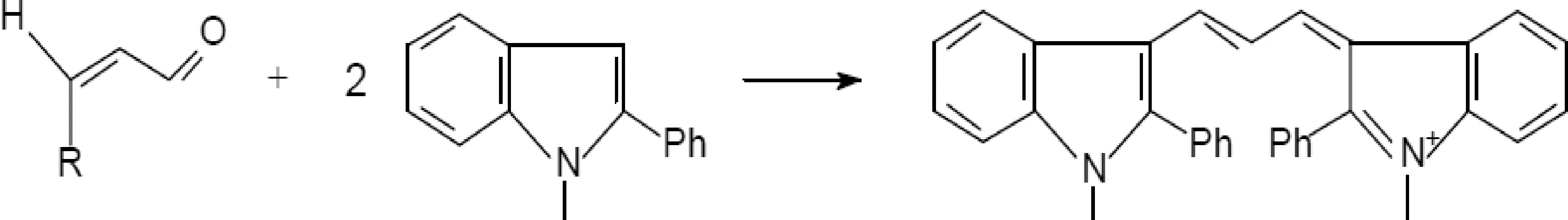
MDA,R=OH;4-hydroxyalkenal,R=hydroxyalkyl
2 实验方法
2.1 仪器与试剂
(1)仪器: Lambda Bio45紫外可见分光光度计(美国PE公司);Milli-Q Academic A10超纯水器(美国Millipore公司);电热恒温水浴锅(北京长源实验设备厂);旋涡混合器(海门麒麟医用仪器厂).(2) 试剂:N-甲基-2-苯基吲哚(生化试剂,北京成宇化工有限公司);1,1,3,3,-四甲氧基丙烷(1,1,3,3-tetramethoxypropane, TMP;Sigma-aldrich公司,美国,purity=99%,d=0.997);甲磺酸(methanesulfonic acid,Fluka公司,ρ=1.481 g/mL,Assay Spec≥99.0%);乙腈(分析纯,湖南师大化学试剂厂);甲醇(分析纯,湖南师大化学试剂厂).
2.2 测定方法[5]
(1)样品:收集晨尿中段.(2)配制N-甲基-2-苯基吲哚反应液:精密称取0.015 5 g N-甲基-2-苯基吲哚,溶于7.5 mL的乙腈,含量即为10 mmol/L,然后和甲醇溶液按体积比V(N-甲基-2-苯基吲哚溶液)∶V(甲醇)= 3∶1的比例混合,即为N-甲基-2-苯基吲哚反应液.(3)样品测定:取澄清尿液0.60 mL(空白管以超纯水代替),加入1.95 mL的N-甲基-2-苯基吲哚溶液,漩涡振荡3~4 s,再加入0.45 mL的甲磺酸(15.4 mol/L),充分混匀后,将反应体系置于45 ℃的水浴锅中反应40 min,反应完毕后,取出放到冰浴上冷却,于585 nm处测定吸光值.(4)毒性羰基类物质含量按下式计算.
C(mol/L) = (A-A0)×5/ε,
其中,A为样品的吸光值;A0为空白管的吸光值;5为样品稀释倍数;ε是摩尔消光系数,其值为1.1×105mol-1·L·cm-1.
2.3 统计学方法
所有数据采用SPSS 18.0 统计软件进行统计学分析.先对各组数据进行正态性检验和方差齐性检验,绘制散点图.
3 结果
3.1 实验条件选择
3.1.1 加热温度与反应时间的影响 用上述方法,采用两因子五水平的试验,考察加热温度与反应时间两个因子对MDA溶液(浓度分别为30、40、50 μmol/L)和两个尿液样本测定的影响.结果表明:以温度45 ℃、时间40 min为临界点,在温度0~45 ℃,时间0~40 min内吸光值均随变量X的增加而增加;45 ℃、40 min以后吸光值基本恒定(见图1、2).

图1 加热温度对吸光值的影响(注:固定反应时间为40 min;n=3;585 nm检测)
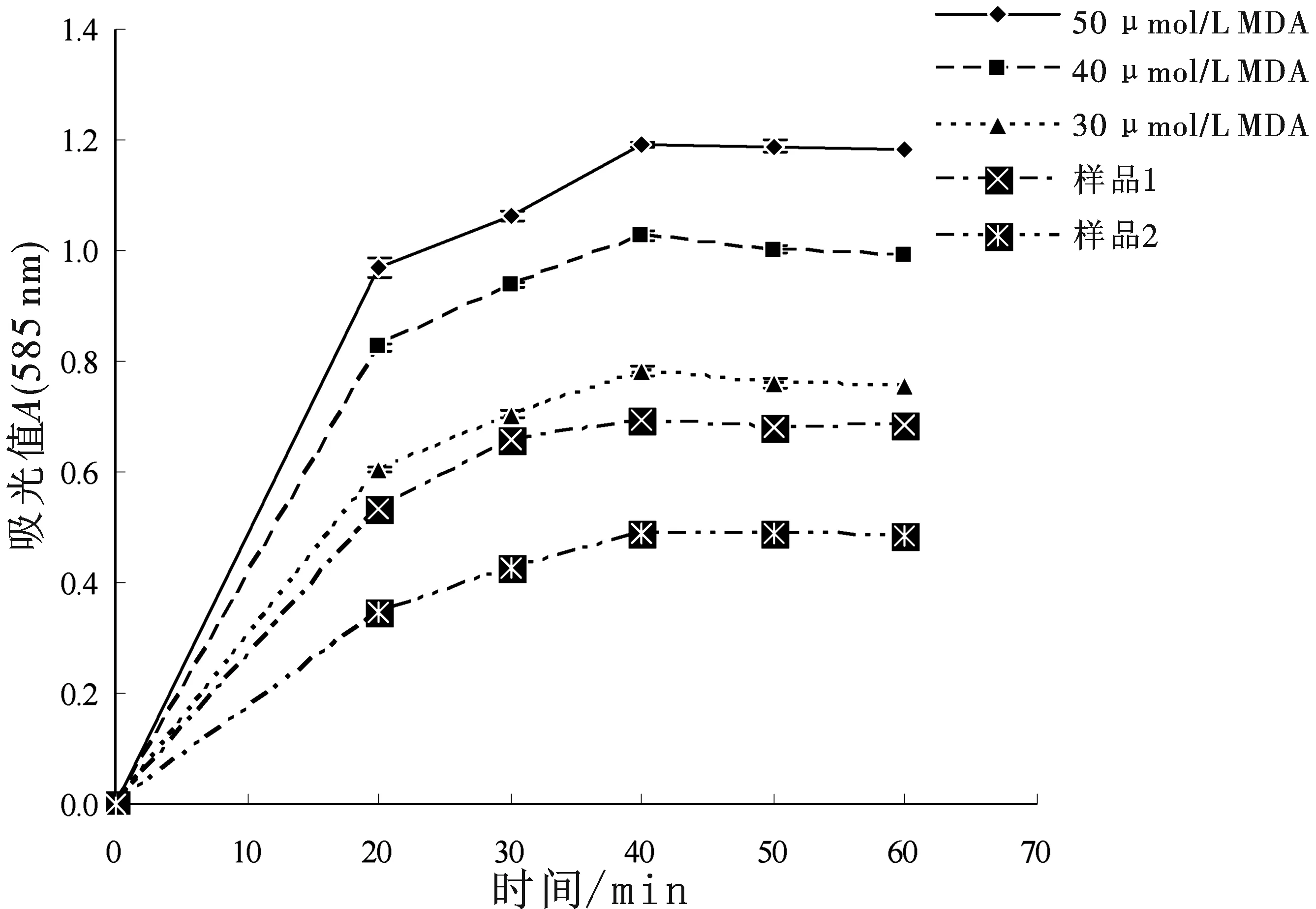
图2 加热时间对吸光值的影响(注:固定反应温度为45 ℃;n=3;585 nm检测)
这表明在45 ℃下反应40 min是该测定方法最佳的反应条件.
3.1.2 离心操作对测定的影响 测定方法同前.随机取7个尿样,每一样品分为2份,一组加热冷却后直接测定吸光值,另一组在15 000 g下离心10 min后取上清液测定吸光值,结果见表1.

表1 离心处理对吸光值的影响
对上面2组测定结果的平均数进行配对数据t检验,得:t=1.646,P>0.05,n=7;表明未离心组与离心组之间的差异不显著.故加热冷却后可以直接进行测定,无需过滤.
综上所述,本方法的最佳实验条件应为:尿样0.6 mL,N-甲基-2-苯基吲哚溶液1.95 mL,甲磺酸0.45 mL,在45 ℃水浴锅中反应40 min,冰浴冷却后于585 nm处测定吸光值.
3.2 标准曲线
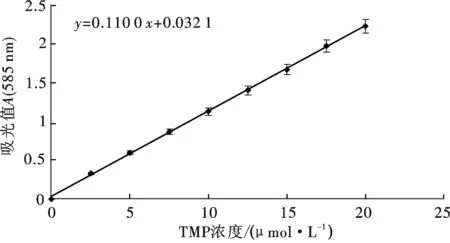
图3 标准曲线(585 nm检测;n=3)
于9支EP管中各加入TMP 0.60 mL,分别按浓度为0,2.5,5.0,7.5,10.0,12.5,15.0,17.5,20.0 μmol/L (3次重复), 再加入N-甲基-2-苯基吲哚溶液1.95 mL,按上述方法进行测定,结果如图3.
图3中可见,TMP浓度在20 μmol/L以下时曲线的线性关系配合良好,回归方程为:Y=0.11X+0.03 (r=0.999 8;t=197.085,P>0.01).
3.3 灵敏度
按照国际应用化学联合会的规定,化学检测方法的置信水平应达到99.86%.检测方法学的置信水平由下式算出.
检测极限=3δ空白/ 标准曲线斜率,
式中δ空白为测定空白值的标准误差.以双蒸水调零,测定10个尿样空白管 (各管均不加入N-甲基-2-苯基吲哚反应液),结果见表2.
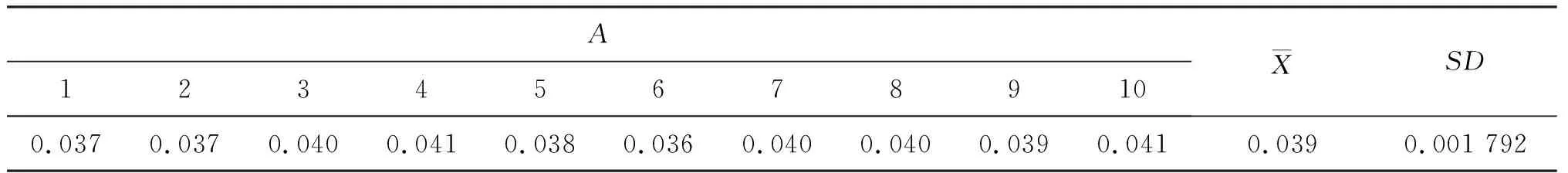
表2 尿液样本吸光值与标准差
表2的结果说明采用本方法检测,检测极限为:0.013 655 μmol/L.灵敏度为:1-0.013 655=98.63%.
3.4 回收率
在两份尿液样品中分别加入不同浓度的TMP溶液,回收结果见表3.
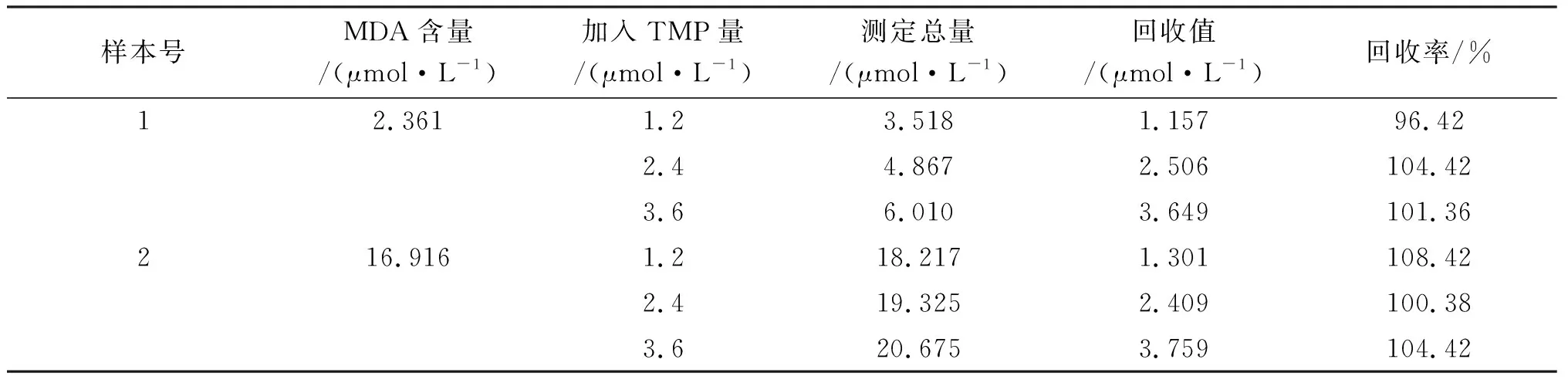
表3 回收率实验测定结果
表3的结果说明,采用本方法测定平均回收率为102.57%.
3.5 精密度
对低、中、高3个样品进行6批测定,每批重复3次,结果如表4.
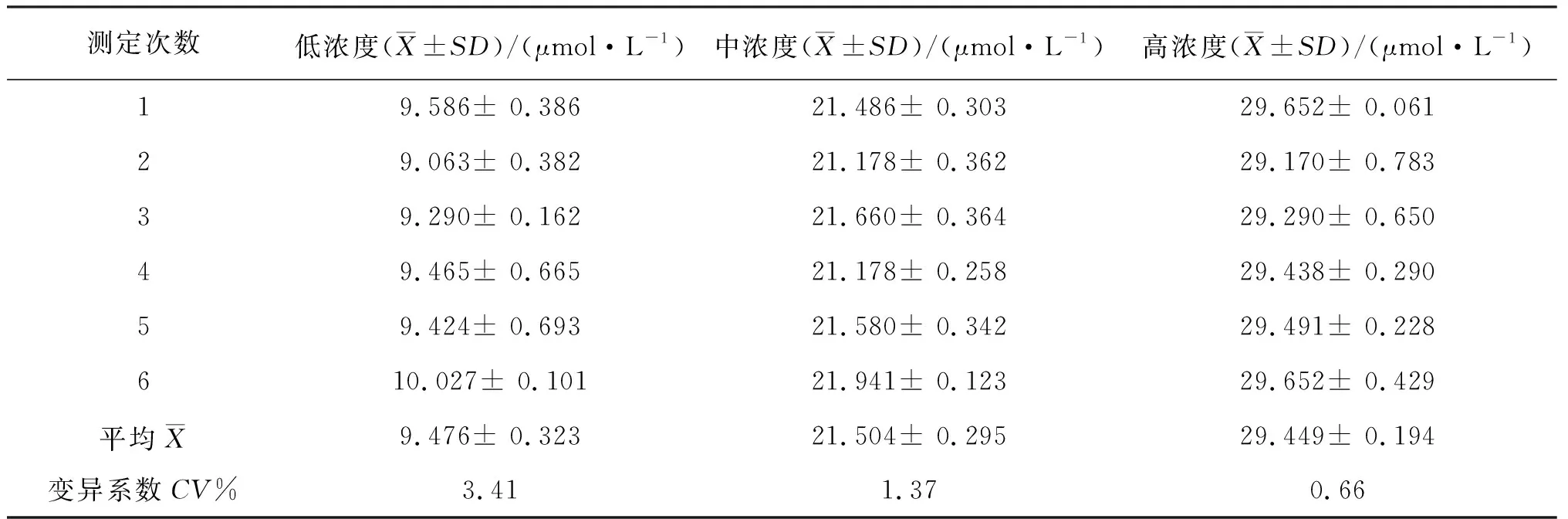
表4 精密度实验结果
3.6 正常人尿中RCS水平的参考范围
采用上述方法测定了1 283例正常成年人尿液中的RCS水平,结果见表5和图4.
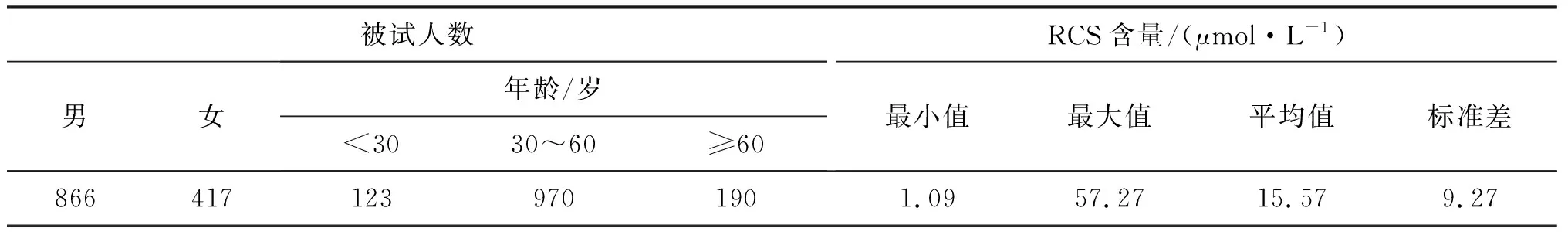
表5 正常成年人(1 283例)尿液中的RCS含量
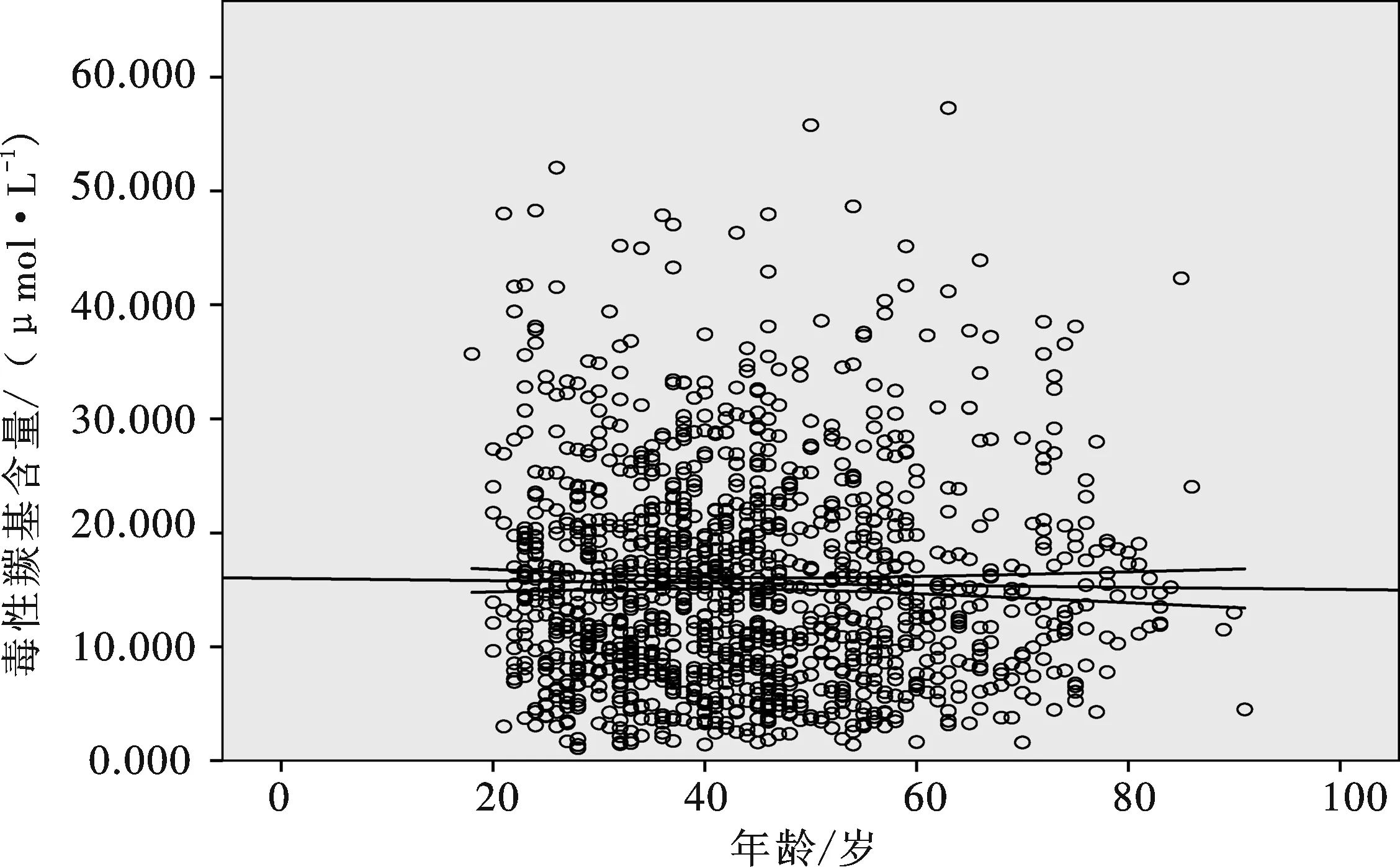
图4 正常成年人(1 283例)尿液中RCS的分布情况
4 讨论
4.1 尿液中RCS测定的意义
机体内的氧应激和糖应激与衰老及许多重要疾病的病理有着千丝万缕的联系[6].大量研究表明,不饱和毒性羰基类物质是脂质过氧化物的水解产物,是自由基氧化过程中不可避免地产生的活性“生物垃圾”.在此类研究中往往可通过检测脂质过氧化反应的程度,即从应激代谢或降解产生的二级或中期产物RCS入手.非酶糖基化也是造成类似的生物活性垃圾RCS的重要应激过程.这些RCS作为应激中期产物一般能被机体识别和清除,而它们的长期积累则会形成脂褐素(老年色素)和晚期糖基化高级产物.这些高级产物在生物体内不可修复,难以去除,最终导致衰老和多种疾病如肿瘤、休克、心肌梗塞、动脉粥样硬化以及自身免疫性疾病等[7].因此,监测种种RCS,可以反映机体内脂质过氧化和非酶糖基化的水平,也可作为体内应激性“垃圾”产物积累的信息指数,从而为判断机体是否处于健康状态提供依据.
尿液虽由肾脏产生,但与体内的诸多系统及其状态均密切相关.尿液中的成分受饮食、运动、情绪、机体代谢、人体内环境及内脏处理各种物质的能力等因素的影响而改变.当人体处于疲劳应激状态时,其循环系统、神经系统和内分泌系统等就会出现异常,进而引起系统生物学指标改变,代谢组学指标异常,这些都使得尿液的质和量发生改变,例如产生与疲劳应激相关的各种不饱和醛酮类和老年色素前体(ceroid)物质的积累等,我们通过检测尿液样品中不饱和醛酮类物质来作为体内应激性产物积累的信息指数,进而为判断机体是否处于健康状态提供依据.
另外,尿样是从人体最容易取得,且对人体无损伤的样本,若以它代替血清和组织样本,应用于自由基生物学、衰老生物化学研究工作、亚健康状态和临床疾病的诊断,将具有非常重要的意义.
4.2 RCS-585比色法与TBA反应法的比较
RCS在生物体内的含量,如MDA和4-HNE,常常是作为衡量氧化应激和非酶糖基化水平的检测指标[8-9].目前,对MDA的测定以TBARS法应用最广,虽有许多研究者对此方法进行了改良[2-3,10-11],但仍然存在其他几个方面的缺陷:例如, 样本需经过酸加热处理(60 min, 100 ℃)因而手续较复杂,预处理时间较长,造成结果不够稳定;酸加热过程中会产生MDA, 从而学术界对检测到的MDA 含量有不同的看法;生物体系中还含有其他能与硫代巴比妥酸(thiobarbituric acid, TBA)反应的物质, 如胆红素、唾液酸、糖类等[12],这些物质都会或多或少干扰MDA与TBA反应[13].
本文所介绍的RCS-585比色法操作简便,无需加热煮沸,不产生煮沸过程中可能发生的难于预知的当场氧化或离解反应,尤其是煮沸过程中因蛋白质沉淀造成的实验误差及相关萃取离心过滤的麻烦,避免了实验操作过程中的诸多干扰.
另外,此方法利用N-甲基-2-苯基吲哚与MDA和4-羟基烯醛发生特异性地反应,反应有较高的专一性,生成物在跟踪观察的数小时至一天内均显稳定.根据相关研究,该反应对于丙烯醛、甲基乙二醛不灵敏,对于己醛可产生在505 nm附近的最大吸收,均对本测定波长585 nm无干扰.根据反应原理及相关研究的结果亦可基本相信,在此温度下,因为不会产生大量交联性生化衍生物,其他生化物质亦不会产生可观的干扰[14].
由于尿样采集方便,而且容易获取大量样本,因此本方法取用0.60 mL尿样(是常规血清样本量的30倍)进行反应,进而以可见光吸收比色就可以进行简捷测定,而无须以通常应用来提高检测灵敏度的TBA荧光检测方法,可节省实验室的人力、物力和财力.
尽管本方法的灵敏度较TBARS法略差,但根据作者对数以千计的人群样本的测定,观察到了尿液对代谢垃圾的明显的富集现象,该富集现象对于应激或亚健康状态的人群尤甚,例如,感冒人群或睡眠剥夺人群尿液中的RCS含量(30~50 μmol/L)就大大高于正常人群血清中RCS的浓度(2~4 μmol/L)[2].一般尿液中毒性不饱和醛酮的含量可高达血清含量的1~25倍,因而,本方法可以适用于科研和临床上对于样本量较大和浓度较高的样本的检测需求.
从另外一个角度来讲,本研究以检测可发生交联反应的生物毒性“垃圾”为检测目标,任何可能与反应试剂产生交联共轭的代谢“垃圾”,均为可能导致蛋白质和核酸等交联变性的“毒性”物质,均是造成“亚健康”生物变态的“罪犯”分子,一并捕获该类“嫌疑”分子是本研究的宗旨所在,也是结合中、西医学各自的优势——还原分析合并归纳综合思维——相得益彰的创新之处.作者认为,此类“归类检测思维”应该成为相关系统生物学研究很好的参照模式和思维创新模式,而非固守传统的“专一性”检测模式.
总之,此测定方法原理简单,反应可靠,操作方便,快捷易行.在一定浓度范围线性较好、回收率和精密度均较高,对设备和实验室条件要求低,便于推广,适用于代谢应激和亚健康相关的临床及临床前常规检测.
致谢:本研究得到了湘雅健康管理中心生化检验科诸多医务工作者的帮助和指导,特此一并致谢.
参考文献:
[1] 李国林, 印大中. 衰老分子生物化学中的羰基应激[J].生命科学研究,2003,7(2):116-122.
[2] 张秀丽, 严面娟, 柴建开, 等. 改良硫代巴比妥酸荧光法测定血清过氧化脂质[J].生物化学和生物物理进展,1996,23(2): 175-179.
[3] 杨 李, 唐 瑛, 左 娟, 等. 硫代巴比妥酸测定血清脂质过氧化物的改进[J].华南国防医学杂志,2004,18(1):30-32.
[4] BOTSOGLOU N A. Rapid, sensitive, and specific thiobarbituric acid method for measuring lipid peroxidation in animal tissue, food and feedstuff samples[J]. Agric Food Chem,1994, 42 (9): 1 931-1 937.
[5] Oxis International, Inc. Bioxytech LPO-586 colorimetric assay for lipid peroxidation procedure manual[P]. Portland patent: 97217-3935, 1996.
[6] BAYNES J W. From life to death—the struggle between chemistry and biology during aging: the Maillard reaction as an amplifier of genomic[J].Biogerontology, 2000, 1(3): 235-246.
[7] 汤学民, 李毓琦, 何 俊. 尿中脂质过氧化物测定方法的探讨[J].广西医学,2003,25(4):515-517.
[8] KADIISKA M B, GLADEN B C, BAIRD D D,etal. Biomarkers of oxidative stress study Ⅲ. Effects of the nonsteroidal anti-inflammatory agents indomethacin and meclofenamic acid on measurements of oxidative products of lipids in CCl4poisoning[J].Free Radic Biol Med, 2005, 38(6): 711-718.
[9] ESTERBAUER H, SCHAUR R J, ZOLLNER H,etal. Chemistry and biochemistry of 4-hydroxynonenal, malonldehyde and related aldehydes[J]. Free Radic Biol Med, 1991, 11(1): 81-128.
[10] 杨国光, 黄 雯. 血中过氧化脂质降解产物丙二醛(MDA)含量简易测定[J].广东卫生防疫,2000, 26(2):16-17.
[11] 刘仲奇, 胡永芳. 脂质过氧化产物-丙二醛的简便测定[J].甘肃中医学院学报,2001, 26(2):13-14.
[12] 邓峰美, 冯 光, 王树人. 生物体系中过氧化物(LPO) 测定方法现状及其研究进展[J].生物医学工程学杂志,2001,18(4):633-637.
[13] 李国林, 李 莉, 印大中. TBARS 的新应用——表征羰基紧张[J].激光生物学报,2003,12(2):113-116.
[14] TADAMICHI I, KEN A, KIYOMI K. Specific determination of malonaldehyde by N-methyl-2-phenylindole or thiobarbituric acid[J].J Am Oil Chem Soc, 1998, 75(5): 597-600.
