乌龟缺氧潜水呼吸的耐受性及巴西龟血液生理生化特性的研究
2010-11-26朱泽瑞印大中
詹 球,高 军,李 烨,胡 慧,朱泽瑞,印大中
(湖南师范大学生命科学学院,蛋白质化学与发育生物学教育部重点实验室,中国 长沙 410081)
龟类是世界上最长寿的动物之一,龟的长寿可能与它抵御各种恶劣环境伤害的潜能有关[1-2].淡水龟类的抗缺氧生存能力极强,尤其是它的大脑[2-3].例如,巴西龟(Trachemysscripta)在3 ℃下缺氧潜水能存活约44 d[4],美国锦龟(Chrysemyspicta)在同等温度下缺氧潜水的存活时间可长达5个月[5].外界环境对龟类的缺氧潜水生存起着决定性作用.其中,温度的影响最为明显.Jackson的研究表明:淡水龟在3℃下缺氧潜水90 d仍可恢复正常,但当水温上升至20 ℃时,潜水仅12 h后就无法恢复正常[6].而龟类在不同水温下缺氧潜水时单位时间耗氧量和缺氧耐受极限及其变化规律迄今未见报道.
目前在探索龟类抗缺氧生存的分子机理方面已做了初步研究,其机理可概括为3点:(1)龟在缺氧时的能量代谢率大幅度降低,减少了能量消耗[3];(2)龟体内有一套特殊的酸碱平衡机制,能够缓解甚至避免因厌氧代谢终产物—乳酸的积累所造成的酸中毒现象[7];(3)龟体内储存了丰富的糖原,能在缺氧时为机体提供能量[3].但前人未对龟类在缺氧潜水时与能量代谢相关的生化指标进行深入的研究,例如对与能量代谢相关的酶类的研究.
本实验的目的是通过研究乌龟缺氧潜水的耐受极限和潜水不同时段巴西龟血液的生理生化指标,探索龟类缺氧潜水时生理生化变化以及这些变化与龟类长寿所具有的相关性.
1 材料与方法
1.1 材料
1.1.1 实验动物 乌龟(Geoclemys reevesii)由湖南四进生物股份有限公司(衡阳市)提供;巴西龟(Trachemys scripta)购买于长沙市西长街杨记水产总部.于实验室内自然条件下培养,筛选出10只3周岁体重350 g左右的健康乌龟和12只3周岁体重1 200 g左右的健康巴西龟,实验前一个星期开始禁食.
1.1.2 器材和设备 CL-8000 日本津岛自动生化分析仪;AVL COMPACT3血气分析仪(瑞士);康乐电热恒温水浴箱;CONTEC AV2000数字视频脑电地形图(美国);TD5A-WS低速台式离心机;2 mL一次性无菌注射器;真空抽血器(7号)等.
1.2 方法
1.2.1 乌龟缺氧潜水呼吸实验装置(图1) 将乌龟置于容器的底层(网孔隔板以下),注满水,容器盖用凡士林密封,用3个铁夹子分三方夹紧容器盖接合面,防止漏气;测定前用氩气将容器内的空气排干净,待容器内外压力平衡时,关闭气压平衡阀.使乌龟的耗氧仅来源于容器中7 L自来水溶解的氧.用虹吸法经1号管取水样,定时检测水样溶氧量.巴西龟缺氧潜水呼吸的实验装置与图1一致.
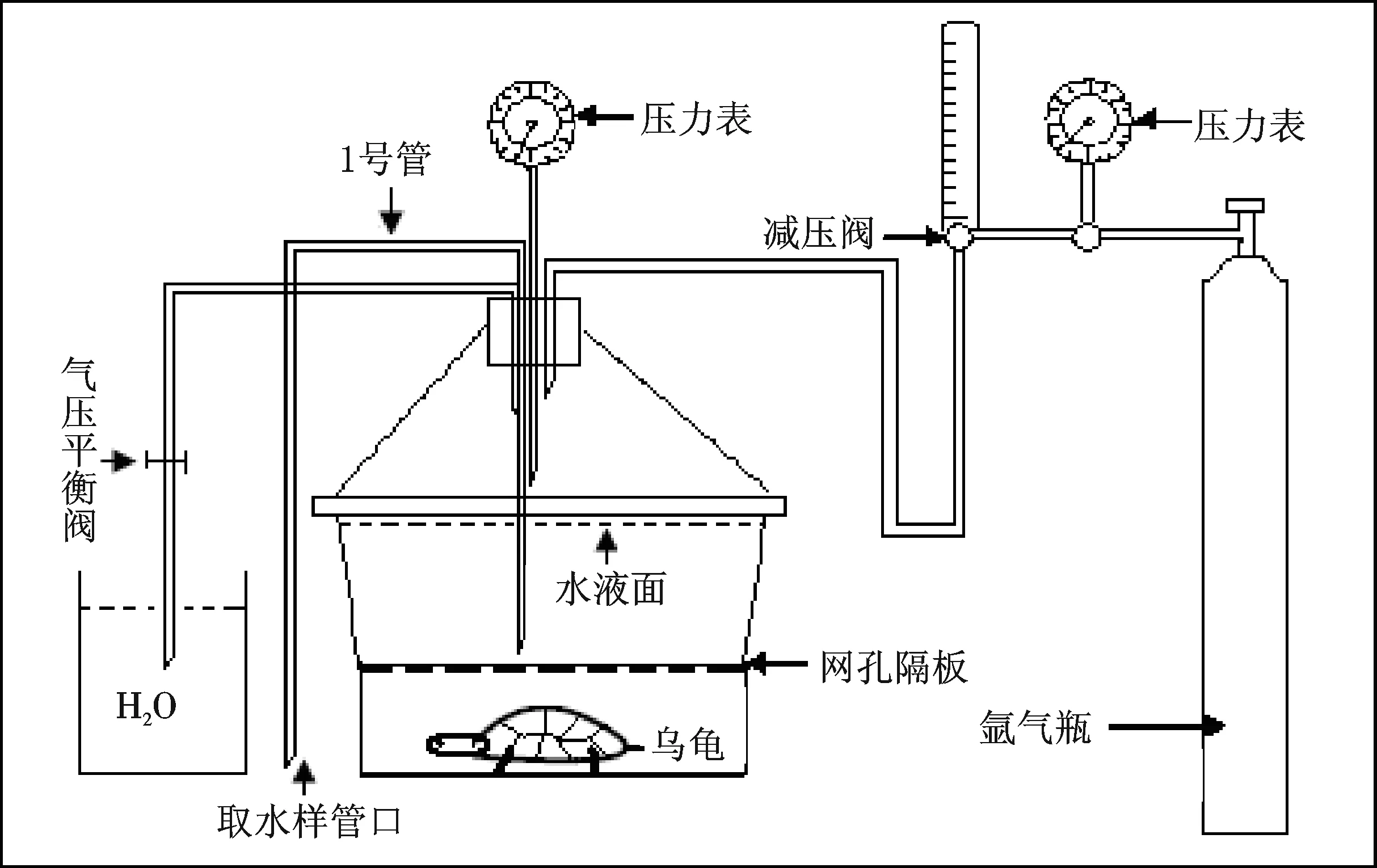
图1 乌龟缺氧潜水呼吸的装置示意图
1.2.2 水中溶氧量的测定方法 采用经典的化学碘量法.在水样中加入硫酸锰和碱性碘化钾,生成的氢氧化锰迅速与水中溶氧生成锰酸锰.高价锰在强酸性条件下氧化碘离子成为I2.以淀粉为指示剂,用1 mol/L Na2S2O3标准溶液滴定,根据消耗Na2S2O3标准溶液的体积来计算水中溶氧量(CDO).
CDO=8C标准溶液V标准溶液/V水样×1 000,
式中:CDO为水样溶氧量(mg/L);C标准溶液为Na2S2O3标准溶液的浓度(mol/L);V标准溶液为消耗Na2S2O3标准溶液的体积(mL);V水样为水样体积(mL);系数8为O2相对分子质量/4.
每次测试取300 mL水样,分3次滴定,结果取平均值.
1.2.3 判断乌龟死亡的方法 1)通过水样溶氧量的变化进行初步判断,如相邻两个测试时间点所测得的水样溶氧量基本相同,则初步判定乌龟死亡.2)通过检测乌龟的脑电活动证明死亡.将初步判定已死亡的乌龟从装置中取出,检测脑电信号.当脑电图呈现典型的空白波,则表明乌龟死亡.
1.2.4 巴西龟颈动脉取血方法 将巴西龟背部朝下固定于手术台上,沿竖直方向剪开颈部右侧皮肤,钝性分离皮下组织和肌肉,剥离颈动脉.抽取约1 mL血液后,针尖立刻插入小橡皮塞内,隔绝空气防止血液氧化,即刻进行血气指标检测(24 ℃,5 min以内).同时,从颈动脉抽取约4 mL血液置于真空贮血管中进行生化测定.
1.2.5 血液生化指标 将巴西龟的全血置于37 ℃下恒温水浴30 min,以3 000 r/min离心5 min,分离血清.用全自动生化分析仪检测血清的生化指标(仪器设置温度:37 ℃).
1.2.6 血气指标的测定方法 用血气分析仪检测血气指标(仪器设置温度:37 ℃).
2 结果与分析
2.1 温度对乌龟潜水呼吸的影响
将经过逐渐降温锻炼的3只(5只冻死2只)乌龟和逐渐升温锻炼的5只乌龟分别置于4 ℃冰箱和30 ℃温箱中培养10 d,然后分别置于4 ℃和30 ℃水中进行12 h缺氧潜水实验,定时测定水中溶氧量和单位时间耗氧量.发现30 ℃下水中溶氧量的下降速率比4 ℃下快得多(图2A),且30 ℃下乌龟每分钟的耗氧量(平均数:0.033 9 mg/min)比4 ℃下(平均数:0.013 7 mg/min)高得多(图2B).

图2 4 ℃和30 ℃下乌龟缺氧潜水时水中溶氧量(A)和单位时间耗氧量(B)随潜水时间的变化
将30 ℃和4 ℃下各时间点所测得的数据进行统计处理,分析结果见表1.

表1 30 ℃与4 ℃条件下乌龟缺氧潜水时水中溶氧量和单位时间耗氧量平均数t值比较
表1说明,两种温度处理比较,水中溶氧量的下降速率差异达到高度显著水平,t=-95.035 3***,P<0.001;乌龟单位时间耗氧量差异达到极显著水平,t=3.201 9**,P<0.01.
这说明,在0~30 ℃条件下水温越高,乌龟单位时间耗氧量越大,水中溶氧量的下降速度越快.因此,在本实验供氧受限的环境下,乌龟的生存时间会随着水温的升高而缩短.反之,水温越低,乌龟缺氧潜水的生存时间会越长.
2.2 缺氧乌龟潜水的极限状态
将3只乌龟置于30 ℃水中进行缺氧潜水实验,直至死亡.定时测定水中溶氧量及单位时间耗氧量,探索乌龟缺氧潜水的生存极限.得平均数结果如图3.
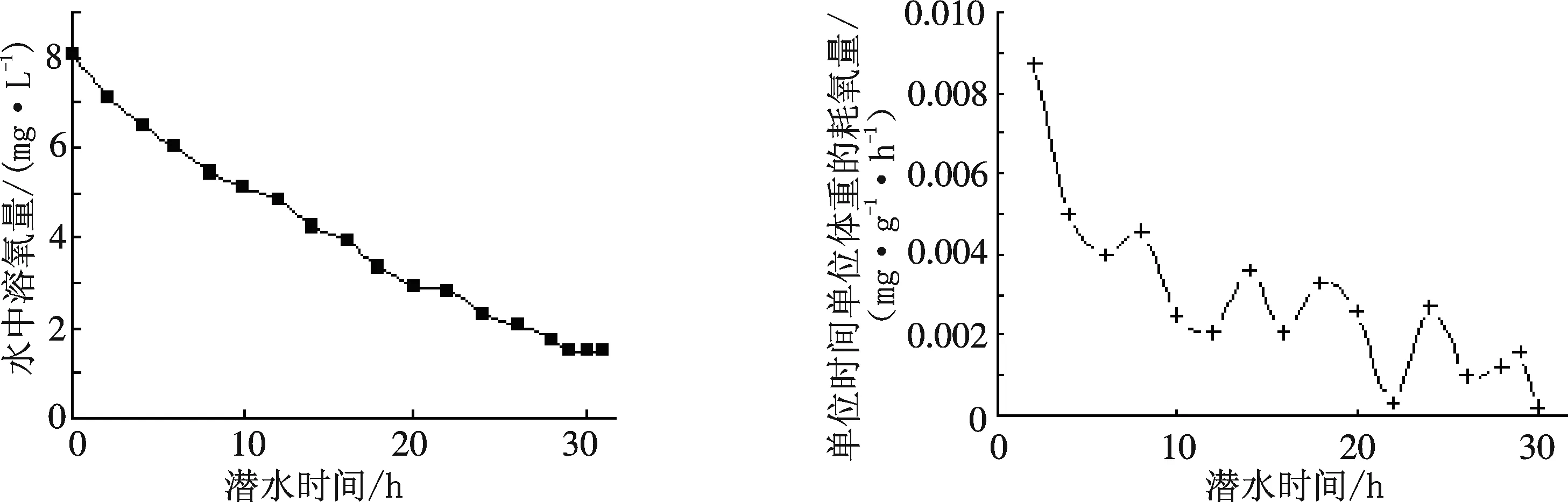
A.水中溶氧量随潜水时间的变化 B.乌龟单位时间单位体重平均耗氧量随潜水时间的变化图3 乌龟缺氧潜水的生存极限(水温30 ℃)
从图3可知,乌龟在30 ℃、7 L水中缺氧呼吸时,3只乌龟平均存活时间为:(30±1.15) h;水中溶氧量随着潜水时间的延长而降低(Y=-0.201 4X+7.601 1,P<0.01),当溶氧量降低至(1.458±0.028) mg/L时,乌龟的生命迹象基本消失.
2.3 巴西龟缺氧潜水时,血液的生理生化指标分析
由于乌龟个体小,颈动脉太细,血流速度慢,采血十分困难,而巴西龟个体大,颈动脉较粗,采血较为容易.经预实验结果显示乌龟和巴西龟在潜水前后的血液指标基本一致,且巴西龟的抗缺氧能力更强,它能在30 ℃、7 L水中存活约40 h.因此,本研究选用巴西龟在缺氧潜水时的血液生化指标为代表来观察和研究龟类与抗缺氧生存相关的分子机理.
预备实验结果表明,巴西龟潜水10 h、20 h后四肢及头部仍可有力地收缩;而40 h后全身肌肉松弛,头部自然下垂,四肢瘫软,生命迹象微弱.说明缺氧潜水40 h时,巴西龟的耐低氧程度已达到极限,机体正处于极度缺氧状态.
2.3.1 巴西龟缺氧潜水时血液生化指标和血气指标的统计结果 用全自动生化分析仪和血气分析仪测定巴西龟缺氧潜水0(对照),10,20,40 h时的生化指标和血气指标(共12只巴西龟:4个处理,每个处理3个重复).结果列于表2.
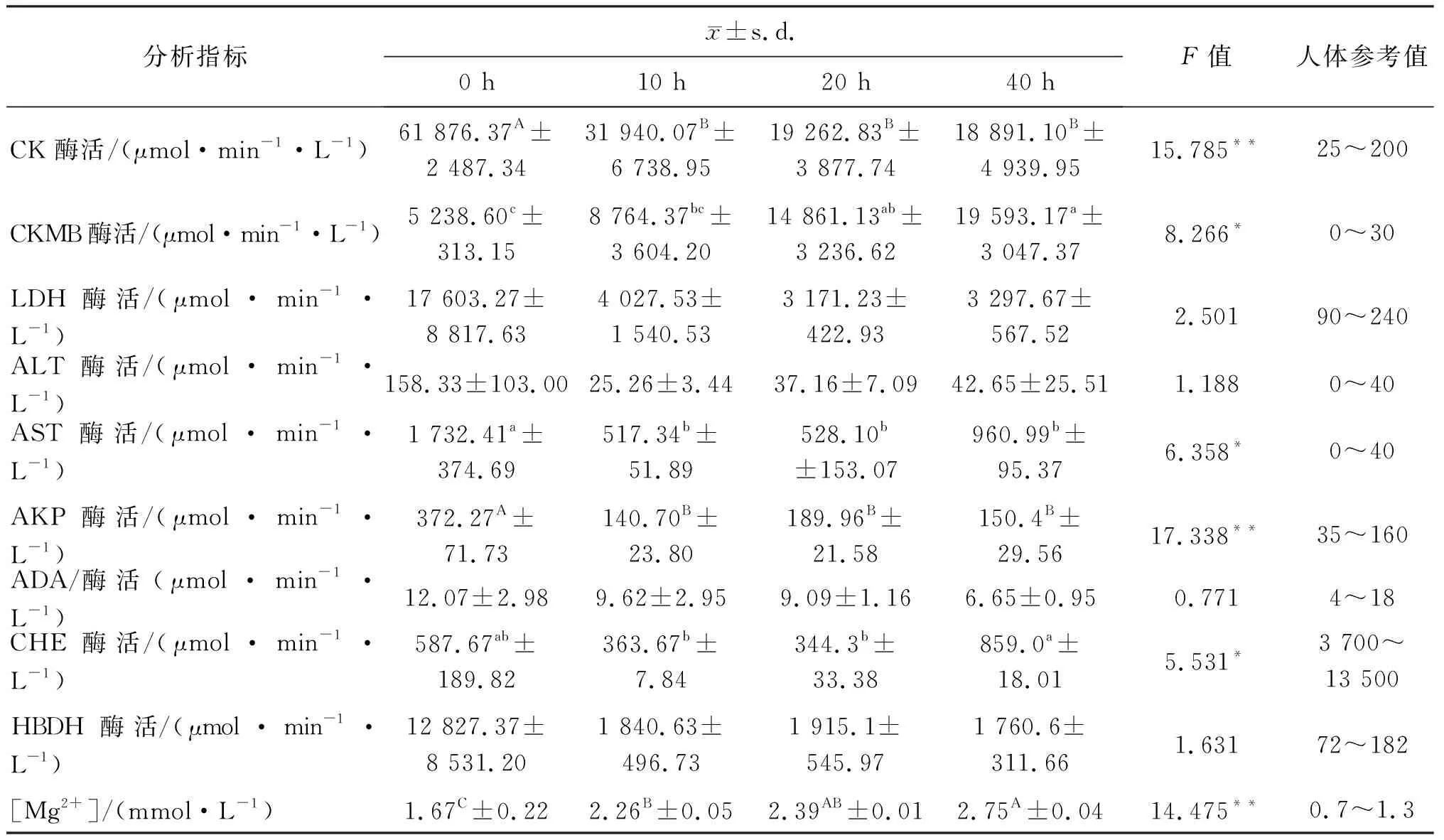
表2 巴西龟潜水前(0 h),潜水10,20,40 h血液生化指标和血气指标的方差分析(体重:(1 246.9±175.1)g)
续上表

分析指标x±s.d.0 h10 h20 h40 hF值人体参考值[Cl-]/(mmol·L-1)96.73±10.3797.63±3.7887.1±2.6260.4±26.681.15897~110[K+]/(mmol·L-1)6.80±1.426.46±1.425.26±0.107.46±0.700.6033.5~5.5[Na+]/(mmol·L-1)136.90±6.12139.10±6.45130.3±4.10129.7±5.723.367135~145[Ca2+]/(mmol·L-1)1.38D±0.031.99C±0.162.70B±0.243.55A±0.2521.000**1.1~1.4[Ca]/(mmol·L-1)2.75D±0.073.99C±0.315.41B±0.497.10A±0.5021.000**2.1~2.9[P]/(mmol·L-1)2.88±0.343.01±0.563.30±0.203.17±0.170.2360.8~1.7[BGlu]/(mmol·L-1)5.83C±2.5123.31B±1.9326.2B±2.4040.1A±1.9730.317**3.9~6.1[BUN]/(mmol·L-1)6.68±3.1523.02±16.196.14±0.662.68±0.381.3882.5~7.1[CR]/(μmol·L-1)14.27±6.8123.17±1.0729.6±15.3625.9±16.740.67344~133[UA]/(μmol·L-1)405.77±223.35426.50±79.50516.2±94.77410.3±117.250.12090~420ρ(TP)/(g·L-1)63.43±1.8253.11±5.1253.8±2.4849.9±7.251.68960~80ρ(ALB)/(g·L-1)28.96±0.7922.17±2.5622.51±0.9323.10±5.961.01735~55ρ(GLB)/(g·L-1)34.44±1.5730.93±3.0531.36±2.3826.83±2.681.88120~30ρ(ALB)/ρ(GLB)0.85±0.040.71±0.060.72±0.060.87±0.210.5261.5~2.5ρ(BMG)/(mg·L-1)0.17±0.020.79±0.290.30±0.170.29±0.163.0391.0~3.0ρ(APOA)/(g·L-1)0.31±0.300.05±0.030.04±0.030.04±0.030.9601.0~1.6ρ(APOB)/(g·L-1)0.04±0.030.00±0.000.06±0.050.03±0.031.0480.6~1.1[CHOL]/(mmol·L-1)5.72±2.143.69±0.254.13±0.844.98±1.360.7213.2~5.7[TG]/(mmol·L-1)3.25±2.082.37±0.665.55±1.489.13±0.474.2770.6~1.7[HDL]/(mmol·L-1)2.00±0.931.10±0.221.17±0.241.04±0.070.6981.1~2.0[LDL]/(mmol·L-1)2.11±0.861.38±0.132.08±0.521.83±0.940.3671.6~3.1[TB]/(μmol·L-1)5.76±2.925.17±2.581.81±0.351.87±0.432.0505.10~17.1[DB]/(μmol·L-1)1.71±0.691.49±0.360.44±0.140.65±0.172.6110.0~6.0[IB]/(μmol·L-1)4.05±2.333.68±2.481.37±0.431.23±0.271.4250.0~15血液pH值7.19A±0.036.84B±0.056.66C±0.036.52D±0.04151.504**7.35~7.45P(CO2)/kPa10.97C±0.9017.17B±1.5623.07A±0.3123.00A±0.2441.907**4.65~6.00P(O2)/kPa24.06A±3.622.16B±0.291.68B±0.171.86B±0.3635.701**9.97~13.30标准F值F3,6,0.05=4.757; F3,6,0.01=9.780
注:巴西龟缺氧潜水前(0 h),潜水10,20,40 h时的水中溶氧量分别为:(8.13±1.97),(6.40±1.06),(5.05±1.17),(2.27±0.05)mg/L.
方差分析表明,血液指标:巴西龟血清中肌酸激酶、碱性磷酸酶、镁离子、钙离子、总钙和葡萄糖6项生化指标的差异达到极显著水平(P<0.01);肌酸激酶同工酶、谷草转氨酶、胆碱酯酶3项生化指标的差异达到显著水平(P<0.05).血气指标:血液pH值、二氧化碳分压和血氧分压3项血气指标差异达到极显著水平(P<0.01).
2.3.2 巴西龟缺氧潜水时血液生化指标和血气指标平均数的多重比较 将以上有差异的血液生化指标和血气指标(共12项指标)进行平均数多重比较,分析结果如图4~6.
从表2、图4A可知,对照组血清中肌酸激酶、肌酸激酶同工酶和乳酸脱氢酶的活性极高,分别为(61 876.37A±2 487.34),(5 238.60c±313.15),(17 603.27±8 817.63)μmol·min-1·L-1,高达人体的几百倍或几十倍.当巴西龟缺氧潜水时,肌酸激酶活性急剧下降至(18 891.10B±4 939.95)μmol·min-1·L-1,处理组与对照组比较差异均达到极显著水平(P<0.01);乳酸脱氢酶活性也下降,但未达到显著水平(P>0.05);肌酸激酶同工酶活性随着缺氧潜水时间延长而大幅度升高,从(5 238.60c±313.15)μmol·min-1·L-1上升至(19 593.17a±3 047.37)μmol·min-1·L-1,其中潜水40 h与对照组比较差异极显著(P<0.01),潜水20 h与对照组比较差异显著(P<0.05),而潜水10 h与对照组比较差异不显著(P>0.05). 以上数据表明,无论处于什么生理状态龟血都含有活性极高的与能量代谢相关的酶,这些酶通过肌酸磷酸去磷酸化或糖酵解途径提供能量.在缺氧潜水初期,肌酸激酶活性大幅度降低,后期趋于平缓;而肌酸激酶同工酶活性却持续升高.

图4 巴西龟缺氧潜水0 h、10 h、20 h、40 h时部分酶活性的变化
从图4B可知,谷草转氨酶活性在潜水20 h内极显著地降低(P<0.01),至40 h又显著地升高(P<0.05);碱性磷酸酶活性在3个处理时间点上都极显著地降低(P<0.01);胆碱酯酶活性在20 h内显著地降低(P<0.05),到40 h又极显著地升高(P<0.01).
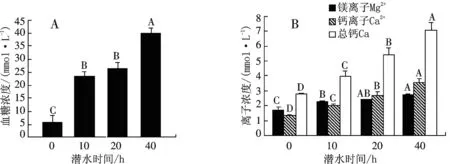
图5 巴西龟缺氧潜水0 h、10 h、20 h、40 h时血糖浓度和钙、镁离子浓度的变化
从图5A可知,对照组血糖浓度较低,为(5.83C±2.51)mmol/L.当缺氧潜水时,血糖浓度大幅度升高至(40.1A±1.97)mmol/L,处理与对照比较差异均达到极显著水平(P<0.01),但处理间的差异未达到显著水平(P>0.05).这说明缺氧巴西龟潜水初期,糖原大量分解成葡萄糖,释放到血液中.而后该过程仍然持续,但血糖含量基本维持在恒定的高水平.
从图5B可知,镁离子、钙离子和总钙浓度处理比对照均显著(P<0.05)或极显著(P<0.01)地升高.
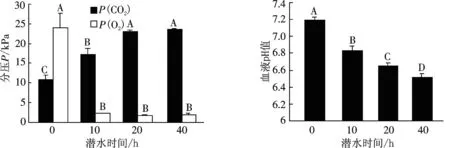
图6 巴西龟缺氧潜水0,10,20,40 h时血气指标的变化
从表2、图6A可知,正常时龟血的氧分压和二氧化碳分压约为人的2倍.当缺氧潜水时,处理组的血氧分压均极显著(P<0.01)地降低,二氧化碳分压显著(P<0.05)或极显著(P<0.01)地升高.
从表2、图6B可知,对照组血液pH值较正常人血稍低,约为7.2.当巴西龟缺氧潜水时,血液pH值均极显著(P<0.01)地降低.
3 讨论
3.1 温度对乌龟缺氧潜水呼吸的影响
温度对乌龟缺氧潜水呼吸有极显著的影响,随着水温降低,乌龟单位时间耗氧量减少,缺氧存活时间延长,这与国外的研究一致.低温能引发一系列抗低氧生存的生理机能变化,如心肌收缩减弱,血氧亲合力增强等[8-9].冬眠是乌龟应对自然条件下低温逆境的最佳应激措施,冬眠时,乌龟机体代谢极度抑制,能量消耗维持最低水平,这有利于适应恶劣环境,节约能量,延长寿命.
3.2 乌龟缺氧潜水的生存极限
大多数鱼类生存的水环境溶氧量不能低于4 mg/L,虾、蟹、螺丝不能低于3 mg/L[10],而乌龟在30 ℃、7 L水中能缺氧生存30 h,当水中溶氧量降至1.5~2 mg/L时,乌龟仍然能以约0.001 mg/(g·h)的微弱呼吸维持生命3~4 h.这说明乌龟具有极强的抗缺氧生存能力和特殊的抗低氧应激机制.本实验结果表明:乌龟缺氧潜水呼吸的单位时间耗氧量随着水中溶氧量的减少呈现较大的波动.这种根据水中溶氧量主动或被动调节机体代谢水平的机理尚不清楚,有待于进一步研究.本实验室的相关研究还表明[11],乌龟缺氧潜水时可通过非肺呼吸途径从水中获取氧.咽部、泄殖腔和皮肤都可以是乌龟重要的呼吸器官,甚至连龟壳也能进行水下气体交换.
3.3 巴西龟缺氧潜水的能量代谢机制
随着缺氧潜水时间的延长,巴西龟血清中肌酸激酶的活性降低,而肌酸激酶同工酶的活性升高,提示在缺氧状态下巴西龟体内存在着独特的能量代谢机制.同正常的人体血清比较(表2),肌酸激酶和肌酸激酶同工酶比人体高出上百倍,乳酸脱氢酶比人体高出几十倍.人体中这些酶类均属于细胞内酶,在血清中测得的活性较低[12],而巴西龟血清中这些酶类的活性如此强,暗示除三羧酸循环外,巴西龟还可能存在其它的循环供能途径.这条途径可能是组织中的肌酸磷酸通过去磷酸化产生肌酸和ATP,由肌酸分解产生的肌酐在极高活性的肌酸激酶催化下再次合成肌酸磷酸,储存于组织内.巴西龟这种能重复利用代谢废物,将其转化为能量物质的机能可能是其在禁食半年之后仍能存活的主要原因之一.但这种可能的循环途径以及含有高活性酶的龟血能否运用于运动生理、服务于运动员,还需要进一步研究.
潜水初期,肌酸激酶活性大幅度降低,可能是由于巴西龟处于从有氧代谢为主逐渐过渡为厌氧代谢为主的状态,机体代谢水平仍较高,能量供不应求,血清中高活性的肌酸激酶能高效催化生化反应,提供能量;肌酸激酶同工酶活性升高可能反映了巴西龟特异的抗缺氧生存的生理优势.
巴西龟缺氧潜水时,血糖含量升高,说明当氧供应不足时,龟体内丰富的肝糖原被大量降解为葡萄糖,释放到血液中,以补偿机体各组织器官缺氧时的能量供应不足.
3.4 巴西龟体内独特的离子平衡与缓冲系统

3.5 巴西龟缺氧潜水的氧分压和二氧化碳分压
血气指标检测发现,巴西龟缺氧潜水时的血氧分压约为人体的2倍(见表2),暗示巴西龟红细胞的携氧能力可约为人的2倍,表明巴西龟的红细胞结构比人体更加优越,或者龟类的血红蛋白较人类具有较多的氧结合位点,从而使红细胞与血氧的亲和力增强,使巴西龟即使在低氧环境中也能有效地捕获氧.此外,从二氧化碳分压和氧分压的数据推测,巴西龟潜水初期的能量代谢方式可能处于过渡转变阶段,随着缺氧呼吸时间延长,机体代谢方式逐渐转变为以厌氧代谢为主.
综上所述,龟类具有极强的抗低氧生存潜能,低温有利于龟类的抗缺氧存活;血清中极高活性的肌酸激酶和乳酸脱氢酶等可能是龟类长寿、抗饥饿和抗缺氧能力强的重要分子基础;缺氧时肌酸激酶活性降低而同工酶活性以及血糖含量升高提示龟类在逆境中可能具有特殊的能量代谢平衡和抗氧化应激机制;缺氧时钙、镁离子浓度升高暗示着龟类具有独特的酸碱平衡体系.这些结果为运动医学研究和抗衰老医学相关的生理生化探索提供了有价值的参考.
参考文献:
[1] YIN D Z, CHEN K J. The essential mechanisms of aging: Irreparable damage accumulation of biochemical side-reactions[J]. Exp Gerontol, 2005, 40: 455-465.
[2] QIN W H, LI F X, ZHANG Z J,etal. Anti-anoxic function of turtles’ brain may relate with their longevity[J]. Life Science Research, 2004, 8(1): 8-10.
[3] NILSSON G E, LUTZ P L. Anoxia tolerant brains[J]. J Cereb Blood Flow Metab, 2004, 24: 475-486.
[4] WARREN D E, REESE S A, JACKSON D C. Tissue glycogen and extra-cellular buffering limit the survival of Red-eared Slider turtles during anoxic submergence at 3 ℃[J]. Physiol Biochem Zool, 2006, 79(4): 736-744.
[5] ULTSCH G R, JACKSON D C. Long-term submergence at 3 ℃ of the turtle, Chrysemys picta bellii, in normoxic and severely hypoxic water[J]. J Exp Biol, 1982, 96: 11-28.
[6] JACKSON D C, RAUER E M, FELDMAN R A,etal. Avenues of extrapulmonary oxygen uptake in western painted turtles (Chrysemys picta belli) at 10 ℃[J]. Comp Biochem Physiol(Part A), 2004,139: 221-227.
[7] JACKSON D C. Surviving extreme lactic acidosis: the role of calcium lactate formation in the anoxic turtle[J]. Resp Physiol Neurobiol, 2004,144: 173-178.
[8] MAGINNISS L A, EKELUND S A, ULTSCH G R. Blood oxygen transport in common map turtles during simulated hibernation[J]. Physiol Biochem Zool, 2004, 77: 232-241.
[9] OVERGAARD J, WANG T, NIELSEN O B,etal. Extra-cellular determinants of cardiac contractility in the cold, anoxic turtle[J]. Physiol Biochem Zool, 2005, 78: 976-995.
[10] 安克敬.水中溶解氧的含量变化及相关问题[J].生物学教学, 2005, 30(6):70-71.
[11] 李 烨,陈 雄,王 贵,等.乌龟的主要非肺呼吸器官及限制龟壳呼吸的生存极限[J].湖南师范大学自然科学学报,2007,30 : 124-128.
[12] 周 强.长跑运动至疲劳后血清酶活性变化[J].成都体育学报, 2001, 27(5):95-96.
[13] 刘军华,陈灏珠,杨学义.镁离子对低氧心肌保护作用的离子通道机制探讨[J].中华医学杂志, 1997, 77(7):505-508.
[14] LIU J H, CHEN H Z, YANG X Y. The mechanisms of the Mg2+effect on the protection of anoxic cardiac muscle[J]. Chinese Medical Journal,1997, 77(7): 505-508.
[15] JACKSON D C, TAYLOR S E, ASARE V S,etal. Comparative shell buffering properties correlate with anoxia tolerance in freshwater turtles[J]. Am J Physiol Regul Integr Comp Physiol, 2007,292: 1 008-1 015.
[16] JACKSON D C. Living without oxygen: lessons from the freshwater turtle[J]. Comp Biochem Physiol(Part A), 2000, 125: 299-315.
