PEG分子量对LiFePO4/C纳米复合正极材料结构与电化学性能的影响*
2010-11-26马新胜徐永刚黄新虎徐云龙于建国
马新胜, 徐永刚, 黄新虎, 张 洁, 徐云龙, 于建国
(1. 华东理工大学 a. 材料科学与工程学院; b. 国家超细粉末工程研究中心,上海 200237)
磷酸铁锂(LiFePO4)具有较高的理论比容量(170 mAh·g-1),适中的电压平台(3.4 V左右)、优良的循环性能、低廉的价格和良好的安全性、环保性,得到了人们的广泛关注。由于LiFePO4电子导电率低和Li+扩散系数小等缺点限制了其大规模的工业应用。目前,改进LiFePO4性能的主要途径有碳包覆和金属离子掺杂[1~6]。其中,碳包覆不但可以提高材料的导电性,而且可以限制颗粒生长和硬团聚,从而易于实现对纳米材料的粒径可控制备[7]。
用于碳包覆改性制备LiFePO4/C正极材料(M)的碳源种类多种多样,其中研究较为广泛的有碳凝胶、乙炔黑、MWCNTs和各种有机物等。聚乙二醇(PEG)在制备M过程中所起的作用不仅仅是充当碳源,作为一种高分子表面活性剂,PEG能有效地降低微粒的表面张力,改善制品的团聚性,从而获得粒径小而均匀的M[8];Tajimi等[9]在原料中加入PEG 400,采用水热法合成出结晶度高、粒度小、分布窄、电化学性能良好的M;Zhang等[10]在原料中加入PEG 400,采用微波辐射一步法合成的M,高倍率放电比容量大,循环稳定性好;Xu等[11]采用微乳液法,通过添加PEG 4000成功制备了颗粒细小而均匀,具有良好电化学性能的M。然而,上述研究主要集中于某一分子量PEG对M结构与性能的影响,未涉及不同PEG分子量对M结构与性能影响的系统性研究。
本文以PEG为纳米结构控制剂和碳源,采用液相法合成了LiFePO4/C纳米复合正极材料(F),其结构与电化学性能经XRD, SEM和恒电流充放电测试等表征。通过探讨不同分子量PEG对F的晶型结构、粒子大小、形貌和电化学性能的影响,期望获得PEG分子量对F结构与性能的影响规律,实现F纳米结构的设计与可控制备。
1 实验部分
1.1 仪器与试剂
日本理学D/MAX 2550 VB/PC型转靶X-射线多晶衍射仪[XRD,扫描范围0.00°~80.00°,步长0.02°,每步长扫描时间0.3 s,Cu靶18 KW(管压40 KV,管流450 MA)];日本JSM-6360LV型扫描电子显微镜(SEM);RTS-9型双电测四探针仪;碳含量按文献[12]方法测定。
1.2 F的合成
分别将Fe(NO3)3·9H2O 12.804 9 g和LiH2PO4Fe(NO3)3·9H2O 3.293 9 g溶解在去离子水中并配成一定浓度的溶液,加入PEG 200(a),搅拌均匀后旋蒸至干,干燥1 h;研磨后置于氩气氛中于600 ℃恒温3 h,冷却至室温得淡黄色固体Fa。
分别用PEG 800(b), PEG 2000(c)和PEG 4000(d)替代PEG 200,同法制得淡黄色固体Fb, Fc和Fd。
1.3 F的电化学性能测试
采用恒电流充放电法测定F的比容量和循环性能。以F为正极活性物质,乙炔黑为导电剂,PVDF为粘结剂[m(F) ∶m(乙炔) ∶m(PVDF)=80 ∶10 ∶10],将其混合均匀后涂敷在铝箔上形成薄膜,于120 ℃真空干燥6 h;用模具冲成一定直径的圆片,在5 MPa下压实制成正极片。以金属锂片为对电极,Cellgard 2400为隔膜,1 mol·L-1的LiPF6EC-DMC(等体积)为电解液,在充满氩气的手套箱(米开罗那Super1220/750)内组装成2032型扣式电池。用Roofer多通道电池程控测试仪(深圳路华电子设备有限公司)进行充放电性能测试。电池的充放电性能测试在室温下进行,以一定的充放电倍率进行充放电[电压为2.5 V~4.2 V,测试温度为(26±2) ℃]。
2 结果与讨论
2.1 F的XRD


2θ/(°)图 1 F的XRD谱图Figure 1 XRD patterns of F

F体积/nm3粒径/nm晶胞参数a/nmb/nmc/nmFa0.292 3746.31.034 8960.600 8260.470 211Fb0.292 4542.61.034 0370.601 3220.470 330Fc0.292 0140.41.033 9290.601 3490.469 654Fd0.292 0237.11.034 4300.600 4740.470 123
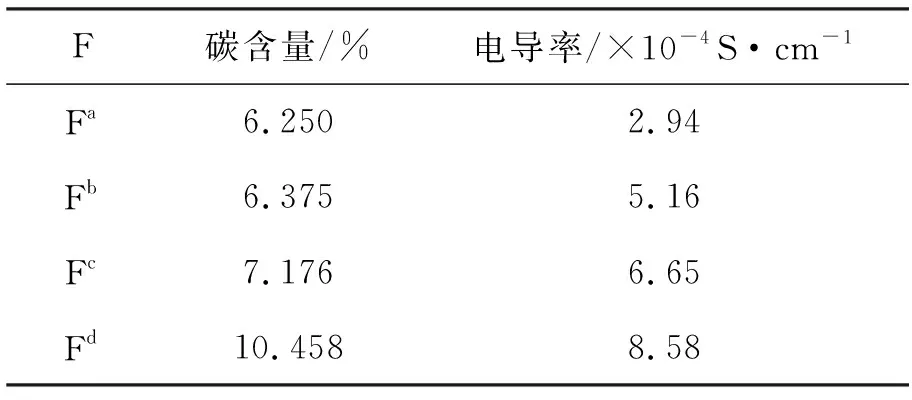
表 2 F的碳含量和电导率*Table 2 The residential carbon content and electrical conductivity of F
*LiFePO4的电导率为10-9S·cm-1~10-10S·cm-1[13]
表1为F的晶胞参数。由表1可见,Fa~Fd的晶胞参数与标准品LiFePO4十分接近。在同样条件下,Fd的晶粒最小。这是由于PEG的分子量愈大,其吸附在颗粒表面上的吸附层愈厚,覆盖和包裹胶粒表面的情况愈好,所产生的空间位阻效应也愈大,更易于控制生成的LiFePO4晶粒的大小与后期晶粒的生长,因此加入分子量较大的PEG能得到晶粒比较小的F。
2.2 F的SEM
图2为F的SEM照片。从图2中可以观察到,Fa~Fd均为球形,粒径小于100 nm且分布较窄,表明PEG的加入有利于粒径的减小和颗粒的均匀分散。这是因为PEG溶于水时,其分子链在水溶液中呈蛇形,能吸附到粒子表面形成一层大分子保护膜,烧结时碳化生成的碳膜均匀地包覆在LiFePO4颗粒的表面有效阻止了LiFePO4颗粒的长大,起到了位阻效应[13]。此外,F的粒径随着PEG分子量的增大而明显降低(这与XRD的分析结果基本一致) 。Fd的粒径最小(<50 nm)且最为均匀。产生这一现象的原因是分子量大的PEG分子链较长,产生的空间位阻比较大,因此得到的Fd颗粒尺寸最小,粒径分布也最窄。
2.3 F的碳含量和电导率
表2为F的碳含量和电导率。从表2可见,Fa~Fd的电导率比纯LiFePO4(10-9S·cm-1~10-10S·cm-1)提高了4~5个数量级,这是由于PEG碳化后包覆在LiFePO4颗粒表面,碳的存在极大地提高了材料的电导率,且随着加入PEG分子量的增大,样品中碳含量也提高,电导率也随之变大。PEG 4000对材料电导率的影响最为显著,Fd的电导率为8.58×10-4S·cm-1。
2.4 F的电化学性能
图3为F在0.1C(17 mA·g-1)充放电电流下的首次放电曲线。表3为F在不同的倍率下的首次放电比容量。从图3和表3可见,Fa~Fd的首次放电比容量分别为123.9 mA·g-1, 130.2 mA·g-1, 153.9 mA·g-1和165.8 mA·g-1,其放电比容量随着PEG分子量的增大而增加。从图3还可以看出,4个样品在3.4 V左右都具有很稳定的放电平台,其中样品Fd具有最长的放电平台,其放电比容量约为LiFePO4理论比容量的97.5%,表明PEG 4000的加入对放电容量的提高最为显著,此现象主要与F的粒径有关。如前所述,F的粒径随PEG分子量的增大而减小,而纳米粒径由于其纳米表面效应有利于锂离子的脱嵌,增大材料和电解液的接触面,减小电极极化[14];同时,包覆的碳起到了提高电子导电率和Li+的扩散系数的作用,从而改善材料的电化学性能。
图4为F在0.1C倍率下的放电比容量随循环次数的变化情况。图5为Fd在0.1C和1C充放电电流下的首次放电曲线。

图 2 F的SEM照片Figure 2 SEM photographs of F

Specific capacity/mA·g-1图 3 F在0.1C倍率下的首次放电曲线Figure 3 Initial discharge curves of F at 0.1C

Cycle number图 4 F在0.1C倍率下的循环性能曲线Figure 4 Cycle performance curves of F at 0.1C

F放电比容量/mAh·-10.1C1CFa123.982.5Fb130.291.9Fc153.9128.1Fd165.8108.1
由表3还可见,同一样品随着倍率的增大放电比容量则减小;在0.1C倍率下,随着PEG分子量的增大,F的放电比容量也随之提高;但在1C倍率下,F的比容量呈现出先增加后减小的趋势。从图4可知,4个样品的放电比容量在循环过程中虽然有小幅波动,但与首次放电比容量相比,经过20次循环后基本无变化,表明添加不同分子量大小的PEG均可以合成出循环稳定性良好的LiFePO4/C。

Capacity/mAh·g-1图 5 不同倍率下Fd的放电曲线Figure 5 Discharge curves of Fd at different rates
从图5和表3可知,Fd在0.1C倍率下的首次放电比容量为165.8 mAh·g-1,在1C倍率下的首次放电比容量为108.1 mAh·g-1。由表3可知,在1C倍率下,随着PEG分子量的增大,F的放电比容量先增加后减小,其中Fc的首次放电比容量最大(128.1 mAh·g-1)。上述现象可以解释为:随着PEG分子量的增大,F的含碳量也增加,在提高电子导电率的同时,却阻碍了Li+的扩散迁移,从而起到了不利于材料电化学性能的作用,这种现象在大电流充放电中表现得尤为明显。Fd的含碳量最高,其在1C倍率下的放电比容量低于Fc的放电比容量。
3 结论
PEG作为纳米结构控制剂,在合成LiFePO4前驱体时吸附在颗粒表面,起到了位阻效应,控制了晶体的生长;在烧结过程中,PEG碳化包覆LiFePO4粒子的表面,抑制了粒子的团聚。通过调变PEG分子量实现了对LiFePO4粒径的控制。
以PEG作为碳源,不同分子量的PEG均能合成橄榄石型晶体结构的LiFePO4/C;随着PEG分子量的增大,合成的LiFePO4/C的含碳量提高。
PEG分子量对LiFePO4/C电导率和电化学性能均有较大影响,随着PEG分子量的增大,LiFePO4/C的粒径减小、电导率增大、电化学性能提高。
PEG 4000合成的LiFePO4/C材料的粒径为40 nm~50 nm,电导率为8.58×10-4S·cm-1; 0.1C倍率下首次放电比容量高达165.8 mAh·g-1,循环20次后容量无衰减;在1C倍率下,首次放电比容量为108.1 mAh·g-1。
[1] Bewlay S L, Konstantinov K, Wang G X,etal. Conductivity improvements to spray-produced LiFePO4by addition of a carbon source[J].Materials Letters,2004,58:1788-1791.
[2] 卢俊彪,唐子龙,张中太,等. 镁离子掺杂对LiFePO4/C材料电池性能的影响[J].物理化学学报,2005,21(3):319-323.
[3] Park K S, Kang K T, Lee S B,etal. Synthesis of LiFePO4with fine particle by co-precipitation method[J].Materials Research Bulletin,2004,39l:1803-1810.
[4] 文衍宣,郑绵平,童张法,等. 钛离子掺杂对LiFePO4结构和性能的影响[J].无机材料学报,2006,21(1):l16-120.
[5] Arnold G, Garche J, Hemmer R,etal. Fine-particle lithium iron phosphate LiFePO4synthesized by a new low-cost aqueous precipitation technique[J].Journal of Power Sources,2003,119-121:247-251.
[6] Franger S, Benoit C, Bourbon C,etal. Chemistry and electrochemistry of composite LiFePO4materials for secondary lithium batteries[J].Journal of Physics and Chemistry of Solids,2006,67l:1338-1342.
[7] Xu Z, Xu L, Lai Q,etal. APEG assisted sol-gel synthesis of LiFePO4as cathodic material for lithium ion cells[J].Materials Research Bulletin2007,42:883-891.
[8] 徐云龙,马红彦,陶丽丽,等. 共沉淀-微波法合成LiFePO4/C正极材料[J].化工新型材料,2008,36(2):21-24.
[9] Tajimi S, Ikeda Y, Uematsu K,etal. Enhanced electrochemical performance of LiFePO4prepared by hydrothermal action[J].olid State Ionics 2004,175(1-4):287-290.
[10] Yong Zhang, Hui Feng, XingbingWu,etal. One-step microwave synthesis and characterization of carbon-modified nanocrystalline LiFePO4[J].Electrochimica Acta,2009,54:3206-3210.
[11] Zhihui Xu, Liang Xu, Qiongyu Lai,etal. Microemulsion synthesis of LiFePO4/C and its electrochemical properties as cathode materials for lithium-ion cells[J].Materials Chemistry and Physics,2007,105:80-85.
[12] Xu Z, Xu L, Lai Q,etal. A PEG assisted sol-gel synthesis of LiFePO4as cathodic material for lithium ion cells[J].Materials Research Bulletin,2007,42:883-891.
[13] 许迪春,郝晓春,朱宣惠,等. 湿化学法制备ZrO2(Y2O3)超细粉末过程中团聚状态的控制[J].硅酸盐学报,1992,20(1):48-54.
[14] Srinivasan V, Newman J . Discharge model for the lithium iron-phosphate electrode[J].J Electrochem Soc,2004,151(10):A1517-A1529.
