益生菌型肠内营养对急性坏死性胰腺炎大鼠炎症反应和免疫功能的影响
2010-11-23王晓亮汤志刚翁海燕黄强陈炯胡晔
王晓亮 汤志刚 翁海燕 黄强 陈炯 胡晔
·论著·
益生菌型肠内营养对急性坏死性胰腺炎大鼠炎症反应和免疫功能的影响
王晓亮 汤志刚 翁海燕 黄强 陈炯 胡晔
目的评价早期应用益生菌型肠内营养对急性坏死性胰腺炎(ANP)大鼠炎症反应和免疫功能的影响。方法100只SD大鼠按数字表法随机分为对照组、ANP组、传统肠内营养(瑞素)组、益生菌组和瑞素+益生菌(联合)组,每组20只。采用胰胆管逆行注射5%牛磺胆酸钠1.5 ml/kg体重方法制备ANP模型。另经胃留置空肠营养管。各组于术后12、24、48、72 h分批处死大鼠,取血检测血清巨噬细胞移动抑制因子(MIF)、淀粉酶水平及T细胞亚群,取胰腺组织常规病理检查,并采用免疫组化法检测胰腺组织MIF的表达。结果制模后各组MIF、淀粉酶水平较对照组明显升高。制模后72 h,瑞素组、益生菌组和联合组血MIF水平分别为(117.59±1.86)μg/L、(108.39±1.99) μg/L和(95.33±1.96) μg/L,血淀粉酶水平分别为(2799±161)U/L、(2482±140)U/L和(2146±572)U/L,益生菌组和联合组均较瑞素组显著下降(P<0.05),联合组又较益生菌组显著下降(P<0.05)。制模后各组CD3+、CD4+细胞和CD4+/CD8+值较对照组下降。制模后72 h,瑞素组、益生菌组和联合组的CD4+/CD8+值分别为0.93±0.12、1.31±0.13、1.51±0.10,益生菌组和联合组均较瑞素组显著回升(P<0.05),联合组又较益生菌组显著回升(P<0.05)。对照组、ANP组、瑞素组、益生菌组和联合组MIF阳性表达率分别为45%、96%、95%、65%和60%,益生菌组和联合组较ANP组和瑞素组显著降低(P<0.05)。制模后72 h联合组大鼠胰腺病理损伤较瑞素组和益生菌组轻。结论益生菌型肠内营养能有效调节ANP大鼠炎症介质和细胞因子水平,增强机体免疫功能。
胰腺炎,急性坏死性; 肠道营养; 益生菌
肠内营养在重症急性胰腺炎(severe acute pancreatitis,SAP)中的治疗作用已得到多数动物实验和临床试验的证实[1-2],但关于益生菌型肠内营养对机体炎症反应和免疫应答功能影响的研究报道较少[3-4]。本实验旨在探讨益生菌型肠内营养对急性坏死性胰腺炎(ANP)大鼠炎症反应、免疫功能的影响,以指导临床应用。
材料与方法
一、模型制备及实验分组
雄性SD大鼠100只,体重260~300 g,由安徽医科大学实验动物中心提供。采用数字表法随机分为对照组、ANP组、瑞素组、益生菌组(双岐杆菌、嗜酸乳杆菌、肠球菌三联活菌制剂)和瑞素+益生菌(联合)组,每组20只大鼠。采用胰胆管逆行注射5%牛磺胆酸钠1.5 ml/kg体重方法制备ANP模型。另经胃造口置内径1 mm硅胶管于空肠上段2 cm处。对照组轻翻胰腺后缝合切口。术后6 h用2 ml生理盐水冲洗肠管,8 h后瑞素组肠内灌注25%瑞素液(华瑞制药有限公司)5 ml,益生菌组灌注益生菌制剂(上海信谊制药总厂产品)5 ml,联合组将益生菌置于5 ml 25%瑞素液中灌注。灌注前测定含菌活量达109CFU/ml。每隔2 h灌注1次,共8次。术后12、24、48、72 h分批处死大鼠,取血及胰腺组织。
二、淀粉酶、巨噬细胞移动抑制因子(MIF)检测
经Beckman全自动生化分析仪检测血清淀粉酶水平,采用ELISA法(试剂盒购自R&D公司)检测MIF水平。
三、T细胞亚群检测
取外周抗凝血2 ml加淋巴细胞分离液密度梯度离心收集淋巴细胞。取1×105个细胞,加入抗CD3+、CD4+、CD8+抗体,4℃避光孵育30 min,立即上流式细胞仪(Beckman-Coulter公司,型号EPICS-XLII)进行检测。
四、胰腺病理检查及MIF表达检测
胰腺标本常规病理检查。采用免疫组化染色检测胰腺组织MIF表达,严格按照试剂盒说明书操作。以胞质出现明显的棕黄色颗粒为阳性细胞,以阳性细胞占总细胞数的百分比评判染色强度:﹤5%为-,5%~25%为+,﹥25%为++。
五、统计学方法
结 果
一、一般情况
各组大鼠均无肠内营养所致并发症发生。建模后72 h,各组死亡率分别为0(0/20)、55.0%(11/20)、40.0%(8/20)、25.0%(5/20)、25.0%(5/20)。
二、血淀粉酶和MIF水平变化
制模后12 h,ANP组、瑞素组、益生菌组和联合组血清淀粉酶、MIF水平均较对照组明显升高(P<0.05)。制模后72 h,ANP组维持高水平,益生菌组和联合组下降且均较瑞素组显著(P<0.05),联合组的MIF水平又较益生菌组下降显著(P<0.05,表1)。
三、T细胞亚群变化
制模后12 h,ANP组、瑞素组、益生菌组和联合组CD3+、CD4+细胞和CD4+/CD8+值均较对照组显著下降(P<0.05)。制模后72 h,ANP组维持低值,益生菌组和联合组CD3+、CD4+细胞和CD4+/CD8+值回升,且明显高于瑞素组(P<0.05),联合组又较益生菌组回升明显(P<0.05,表1)。
四、胰腺病理学改变及MIF的表达
对照组胰腺组织轻度水肿及少量炎症细胞浸润;ANP组胰腺明显出血、坏死,腺泡结构破坏;瑞素组胰腺组织部分出现坏死及出血,腺小叶结构消失;益生菌组和联合组胰腺病变程度相似,均较瑞素组轻(图1)。
对照组胰腺组织MIF弱表达,ANP组和瑞素组阳性细胞数增加、染色增强,而益生菌和联合组胰腺组织MIF表达较瑞素组减弱(图2)。5组MIF阳性表达率分别为45%、96%、95%、65%和60%,益生菌组和联合组较ANP组和瑞素组显著降低(P<0.05)。
表1 各组大鼠T细胞亚群、血清淀粉酶水平、MIF浓度的比较
注:与同时点对照组比较,aP<0.05;与ANP组比较,bP<0.05;与瑞素组比较,cP<0.05;与益生菌组比较,dP<0.05
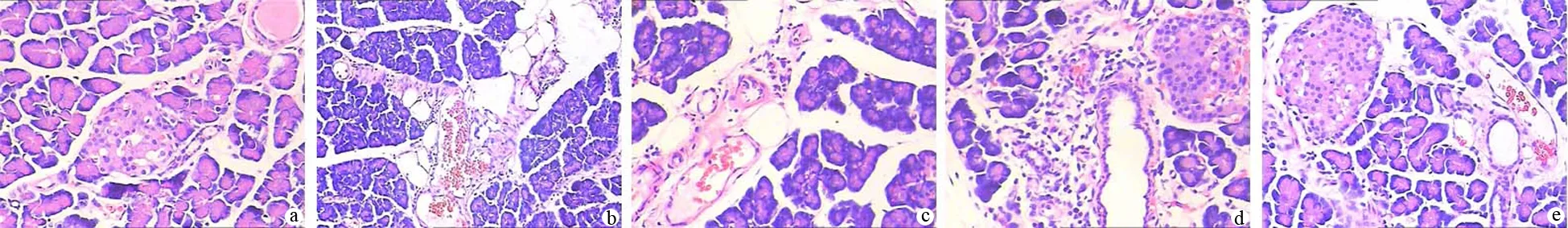
a.对照组;b.ANP组;c.瑞素组;d.益生菌组;e.联合组(HE ×200)
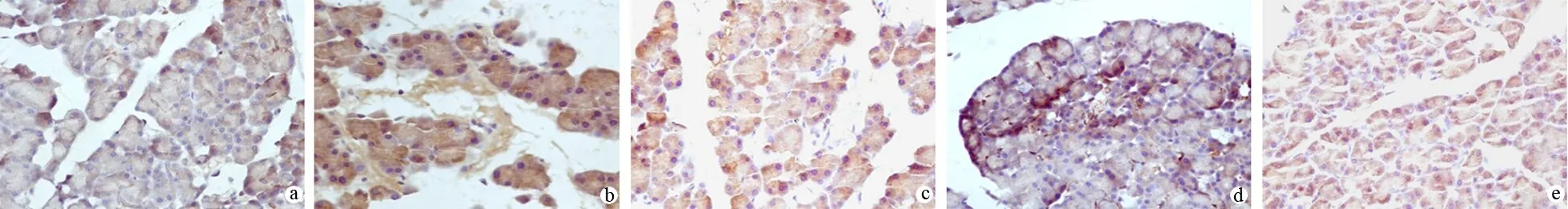
a.对照组;b.ANP组;c.瑞苏组;d.益生菌组;e.联合组(免疫组化 ×400)
SAP时,由于肠道动力紊乱、肠道菌群失调、肠黏膜上皮细胞过度凋亡,导致肠黏膜屏障损伤,肠道菌群易位,易并发感染和多器官功能不全综合征(MODS),成为SAP患者后期高病死率的重要原因。目前,免疫功能在急性胰腺炎病理生理过程中的重要性日益受到关注,如何增强肠道局部和系统免疫功能成为SAP临床和实验研究的热点。
T细胞亚群的变化反映了细胞免疫功能的改变,CD3+、CD4+T细胞数和CD4+/CD8+比值降低表明机体处于免疫抑制状态[5]。MIF是先天性免疫和获得性免疫的重要调节因子,在机体炎症和免疫反应中起重要作用,可能会加重SAP及相关肺损伤[6]。益生菌型肠内营养是指增加益生菌的营养制剂,它可建立宿主和微生物之间的共生关系,促进肠上皮细胞更新,增加肠黏膜血流量和调节肠蠕动,加强肠黏膜免疫系统的功能[7-8]。
本实验对照组大鼠无死亡,ANP组死亡率较高,但各组之间死亡率无统计学差异。制模后各组血清淀粉酶、MIF水平升高。制模后72 h,给予营养支持的3组血淀粉酶及MIF水平均下降,其中联合组下降较益生菌组显著,益生菌组又较瑞素组下降显著,表明联合益生菌行肠内营养在减轻炎症反应方面效果更好。制模后各组CD3+、CD4+T细胞和CD4+/CD8+比值均降低,提示ANP早期已有不同程度的免疫功能抑制。制模后72 h,营养支持各组各指标回升,其中联合组回升最高,提示联合组的营养支持对ANP大鼠免疫抑制状态的改善,抑制炎症介质和细胞因子的释放效果最明显。胰腺组织病理的改变及MIF表达的变化也证实了这一点。因此,临床上应推荐使用益生菌型肠内营养。
[1] Marik PE, Zaloga GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ, 2004, 328:1407.
[2] McClave SA, Chang WK, Dhaliwal R, et al. Nutrition support in acute pancreatitis: a systematic review of the literature. J Parenter Enteral Nutr, 2006, 30:143-156.
[3] 赵晓雷, 计敏. 微生态肠内营养治疗重症急性胰腺炎肠损伤的临床研究. 胰腺病学, 2007, 7: 366-368.
[4] Besselink MG, van Santvoort HC, Buskens E,et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet, 2008, 371: 651-659.
[5] Pezzilli R, Billi P, Beltrandi E, et al.Circulating lymphocyte subsets in human acute pancreatitis.Pancreas,1995,11:95-100.
[6] 张启芳, 梁志海, 唐国都, 等. 巨噬细胞移动抑制因子在急性坏死性胰腺炎发病中的作用. 胰腺病学, 2006, 6: 326-329.
[7] Karakan T, Ergun M, Dogan I, et al. Comparison of early enteral nutrition in severe acute pancreatitis with prebiotic fiber supplementation versus standard enteral solution: a prospective randomized double-blind study. World J Gastroenterol, 2007, 13: 2733-2737.
[8] van Minnen LP, Timmerman HM, Lutgendorff F, et al. Modification of intestinal flora with multispecies probiotics reduces bacterial translocation and improves clinical course in a rat model of acute pancreatitis. Surgery, 2007, 141: 470-480.
2009-05-06)
(本文编辑:屠振兴)
Effectofprobioticsenteralnutritionontheinflammatoryresponseandimmunefunctioninratswithacutenecrotizingpancreatitis
WANGXiao-liang,TANGZhi-gang,WENGHai-yan,HUANGQiang,CHENJiong,HUYe.
DepartmentofGeneralSurgery,AnhuiProvincialHospital,AnhuiMedicalUniversity,Hefei230001,China
TANGZhi-gang,Email:tougao_100@163.com
ObjectivesTo evaluate the effect of probiotics enteral nutrition therapy on the inflammatory reaction and immune function in acute necrotizing pancreatitis (ANP) in rats.Methods100 SD rats were divided randomly into control group (C group,n=20), ANP group, enteral nutrition group (EN group,n=20), probiotics group (P group,n=20) and enteral nutrition plus probiotics group (PEN group,n=20). ANP were induced by retrograde injection of 5% sodium taurocholate (1.5 ml/kg) into the biliary and pancreatic duct. The nasojejunal tube was placed via gastric route. The rats were sacrificed at 12 h, 24 h, 48 h and 72 h after ANP modeling. Serum MIF and amylase levels, as well as CD3+, CD4+, CD8+were measured and MIF was determined by immunohistochemistry and the histopathological changes in pancreatic tissue were observed.ResultsSerum MIF and amylase levels were all increased when compared with that in C group. 72 h after ANP modeling, serum MIF levels in EN, P, PEN groups were (117.59±1.86)μg/L,(108.39±1.99)μg/L and (95.33±1.96)μg/L, respectively; serum amylase levels were (2799±161)U/L, (2482±140)U/L and (2146±572)U/L, respectively; the values in P and PEN groups were significantly lower than that of EN group (P<0.05), the values in PEN groups were significantly lower than that of P group (P<0.05). After ANP induction, CD4+/CD8+values in EN, P and PEN groups were 0.93±0.12, 1.31±0.13, 1.51±0.10, respectively; the values in P and PEN groups were significantly higher than that of EN group (P<0.05), the values in PEN groups were significantly higher than that of P group (P<0.05). MIF positive rates in C, ANP, EN, P and PEN group were 45%, 96%, 95%, 65% and 60%,respectively; the values in P and PEN groups were significantly lower than those of ANP and EN group (P<0.05). At 72 h, the damage of pancreatic tissue was more severe in EN and P groups than that in PEN group.ConclusionsProbiotics enteral nutrition could effectively regulate inflammation mediator and cytokines in rats with ANP, and enhance immune function.
Pancreatitis, acute necrotizing; Enteral nutrition; Probiotics
10.3760/cma.j.issn.1674-1935.2010.01.013
2008年安徽省临床医学重点学科新技术引进项目(2008N017)
230001 合肥,安徽医科大学附属安徽省立医院保健中心11楼普外科
汤志刚,Email:tougao_100@163.com
