人NPTX2真核表达载体的构建及稳定转染细胞系的建立
2010-11-23张玲高军龚燕芳李兆申吴洪玉金晶满晓华
张玲 高军 龚燕芳 李兆申 吴洪玉 金晶 满晓华
·论著·
人NPTX2真核表达载体的构建及稳定转染细胞系的建立
张玲 高军 龚燕芳 李兆申 吴洪玉 金晶 满晓华
目的构建人神经元正五聚蛋白2(NPTX2)真核表达载体,转染人胰腺癌细胞PANC1,建立稳定转染的细胞系。方法通过双酶切的方法获得人NPTX2全长cDNA,利用NotⅠ和EcoRⅠ酶切位点将其插入到真核表达载体pcDNA3.1(+),经酶切和测序验证后,用脂质体转染法转染PANC1细胞,通过G418筛选,建立稳定转染的PANC1细胞,用实时定量PCR方法筛选NPTX2 mRNA高表达克隆。结果成功构建了pcDNA3.1(+)-NPTX2真核表达载体,并建立了稳定转染的PANC1细胞,成功表达了目的基因。结论真核表达载体的构建和稳定转染PANC1细胞系的建立为进一步研究NPTX2基因在胰腺癌细胞的作用奠定了良好的基础。
胰腺肿瘤; NPTX2; 转染; 细胞系
材料与方法
一、主要试剂
含人NPTX2全长cDNA的pReceiver-M15-NPTX2质粒购自广州复能基因公司。质粒pcDNA3.1(+)和人胰腺癌细胞系PANC1为本实验室保存。限制性内切酶EcoRⅠ和NotⅠ、T4 DNA连接酶购自TaKaRa公司;反转录试剂盒购自Fermentas公司;SYBR Green Master Mix购自TOYOBO公司;凝胶回收试剂盒购自维特洁公司;质粒抽提试剂盒购自北京博大泰克公司;LipofectamineTM2000为Invitrogen公司产品;G418购自Sigma公司;Trizol购自Invitrogen公司;SuperECL购自北京普利莱基因技术有限公司;兔抗人NPTX2多克隆抗体购自Protein Tech Group公司;小鼠抗人β-actin单克隆抗体购自Sigma公司;羊抗小鼠IgG购自GenScript公司;HRP标记的羊抗兔IgG购自上海普飞生物技术有限公司。
二、人NPTX2真核表达载体的构建
对pReceiver-M15-NPTX2和pcDNA3.1(+)质粒分别行EcoRⅠ、NotⅠ双酶切。酶切后经琼脂糖凝胶电泳分离、切割,回收获取NPTX2片段(1326 bp)和pcDNA3.1(+)质粒大片段。经T4连接酶16℃过夜连接后转化感受态E.coli DH5α细胞,氨苄青霉素(60 μg/ml)筛选培养,挑取阳性克隆,扩增后抽提质粒进行酶切和测序鉴定。
三、人NPTX2转染PANC1细胞
PANC1细胞常规培养,待细胞融合至90%~95%时,应用LipofectamineTM2000将pcDNA3.1(+)和pcDNA3.1(+)-NPTX2转染PANC1细胞。48 h后在含G418(1000 μg/ml)的培养基中加压筛选2周,获得具有抗性的阳性细胞克隆,继续在含G418(500 μg/ml)的培养基中培养,获得稳定表达人NPTX2的PANC1细胞(PANC1-NPTX2)。
四、实时定量PCR检测NPTX2 mRNA的表达
收集pcDNA3.1(+)转染的细胞及PANC1-NPTX2。应用Trizol抽提细胞总RNA,取2 μg进行反转录。用SYBR Green掺入法进行实时定量PCR扩增。NPTX2上游引物5′-CCTCCCACTCCGCAC-AAAC-3′,下游引物5′-CACCGCATAGGAGAAGGGG-3′,扩增片段133 bp;内参GAPDH上游引物5′-GCACCGTCAAGGCTGAGAA-3′,下游引物5′-ATGGTGGTGAAGACGCCAGT-3′,扩增片段145 bp。以去核酸无菌水作为阴性对照。每个样品均设3个复孔。采用ABI 7500 system soft进行分析,标本中NPTX2基因的CT值通过下列公式进行计算:△CT =NPTX2的CT值-GAPDH的CT值,△△CT =样本△CT -对照△CT,NPTX2基因相对表达量为2-△△CT。
五、蛋白印迹法检测NPTX2蛋白的表达
收集转染细胞,裂解制备蛋白样品,常规行Western blotting。兔抗人NPTX2一抗1∶800稀释,小鼠抗人β-actin抗体1∶10 000稀释,羊抗兔HRP标记的二抗1∶2000稀释,羊抗鼠HRP标记的二抗1∶5000稀释。最后ECL发光,暗室中显影、定影。应用ImageJ软件扫描条带光密度,以NPTX2/β-actin的光密度比值表示NPTX2蛋白的相对表达量。
六、统计学分析
应用SPSS15.0统计学分析软件,两组NPTX2 mRNA表达量采用t检验,P<0.05认为有统计学差异。
结 果
一、真核表达载体pcDNA3.1(+)-NPTX2的酶切鉴定
NPTX2全长cDNA为1326 bp。pcDNA3.1(+)-NPTX2经双酶切后电泳可见略小于1500 bp的片段(图1),对照质粒pcDNA3.1(+)无此片段。

图1pcDNA3.1(+)-NPTX2质粒(1~4)和pcDNA3.1(+)质粒(5)酶切鉴定电泳图
二、真核表达载体pcDNA3.1(+)-NPTX2的测序鉴定
将含pcDNA3.1(+)-NPTX2重组质粒的大肠杆菌单克隆菌液送至上海英俊公司测序。应用Chromas和DNAman 软件分析测序结果,证实了所提供的重组质粒均包含1326 bp插入片段,与GenBank中公布的NPTX2 mRNA序列匹配,同源性均为100%,且含有pcDNA3.1(+)质粒的序列。
三、转染的PANC1细胞NPTX2 mRNA的表达
GAPDH mRNA与NPTX2 mRNA均有较好的扩增曲线与溶解曲线(图2)。设对照质粒转染的PANC1细胞NPTX2 mRNA相对表达量(relative quantity, RQ)为1,则PANC1-NPTX2的NPTX2 mRNA的RQ值为30.089,两组差异显著(P<0.05)。
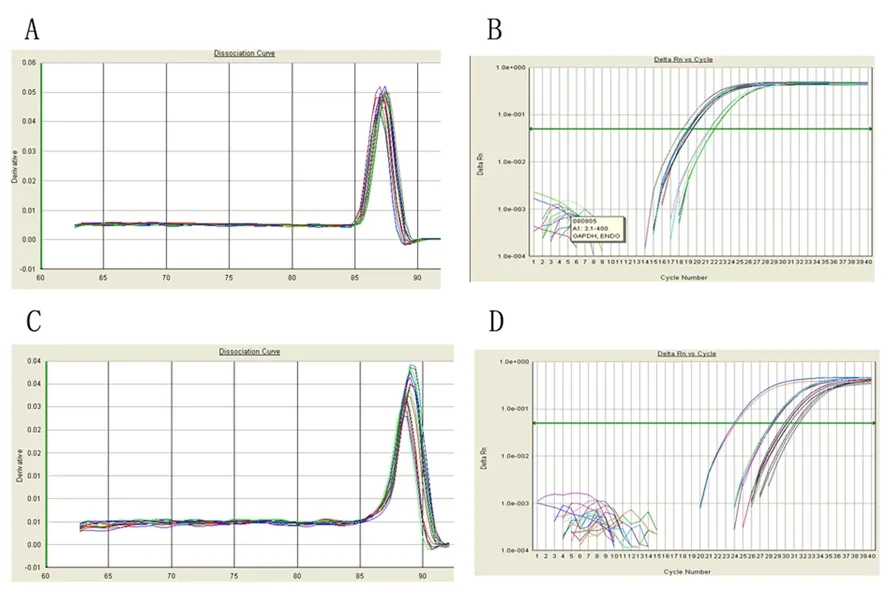
图2GAPDH(A、B)和NPTX2(C、D)的融解曲线和扩增曲线
四、转染细胞NPTX2蛋白的表达
空白对照PANC1细胞和pcDNA3.1转染的细胞均未检测到NPTX2蛋白的表达,pcDNA3.1-NPTX2转染细胞检测到NPTX2蛋白表达(图3)。

图3 转染细胞的NPTX2蛋白表达
NPTX2基因又称为神经元活性调节正五聚体蛋白(neuronal activity-regulated pentraxin, Narp)。目前针对该蛋白研究较多地集中在神经系统疾病中,如癫痫发作和帕金森病[6-9],在胰腺疾病的研究尚少。为此,本文将NPTX2基因转染人胰腺癌细胞株PANC1,为后续的研究奠定基础。
利用表达系统在哺乳动物细胞内表达目的基因是研究基因功能及其相互作用的重要手段。在各种表达系统中,最早被采用的是原核表达系统,这也是目前掌握最为成熟的表达系统[10]。其优点在于能够在较短时间内获得基因表达产物,且所需成本相对低廉。但该系统存在许多难以克服的缺点,如原核表达缺乏转录后修饰。为此,许多学者将原核基因调控系统引入真核基因调控领域,基因工程研究中常用的真核表达系统有酵母表达系统、昆虫细胞表达系统和哺乳动物细胞表达系统[11]。
本研究采用哺乳动物表达系统pcDNA3.1(+)。
它不仅含有氨苄青霉素抗性可用于原核扩增,还含有新霉素抗性可用G418筛选稳定表达株。我们将人NPTX2全长cDNA成功地插入pcDNA3.1(+)载体的CMV启动子下游,构建NPTX2真核表达载体。经酶切、PCR和测序鉴定正确无误后,通过脂质体介导将pcDNA3.1(+)-NPTX2重组质粒转染PANC1细胞,通过G418筛选建立了稳定转染细胞系。采用实时定量PCR和Western blotting分别从转录和翻译水平检测到NPTX2基因的表达,表明重组的人NPTX2基因在PANC1细胞中能有效地被转录和翻译,成功地建立了一个在基因组DNA中稳定整合有pcDNA3.1(+)-NPTX2载体的PANC1细胞系。
[1] Hruban RH,Lacobuzio-Donahue C,Wilentz RE,et al.Molecular pathology of pancreatic cancer.Cancer J,2001,7:251-258.
[2] Egger G,Liang G,Aparicio A,et al.Epigenetics in human disease and prospects for epigenetic therapy.Nature,2004,429:457-63.
[3] 宋健,曹佳,高军,等.胰腺癌组织SPARC基因CpG岛甲基化状态及临床意义.中华胰腺病杂志,2008,8:145-147.
[4] Sato N,Fukushima N,Maitra A,et al.Discovery of novel targets for aberrant methylation in pancreatic carcinoma using high-troughput microarrays.Cancer Res,2003,63:3735-3742.
[5] Matsubayashi H,Canto M,Sato N,et al.DNA methylation alterations in pancreatic juice of patients with suspected pancreatic disease.Cancer Res,2006,66:1208-1217.
[6] Tsui CC,Copeland NG,Gilbert DJ,et al.Narp,a novel member of the pentraxin family,promotes neurite outgrowth and is dynamically regulated by neuronal activity.J Neurosci,1996,16:2463-2478.
[7] O′Brien RJ,Xu D,Petralia RS,et al.Synaptic clustering of AMPA receptors by the extracellular immediate-early gene product Narp.Neuron,1999,23:309-323.
[8] O′Brien R,Xu D,Mi R,et al.Synaptically targeted narp plays an essential role in the aggregation of AMPA receptors at excitatory synapses in cultured spinal neurons.J Neurosci,2002,22:4487-4498.
[9] Moran LB,Hickey L,Michael GJ,et al. Neuronal pentraxin II is highly upregulated in Parkinson′s disease and a novel component of Lewy bodies.Acta Neuropathol,2008,115:471-478.
[10] Busuttil BE,Turney KL,Frauman AG.The expression of soluble,full-lengh,recombinant human TSH receptor in a prokaryotic system.Protein Expr Pufir,2001,23:369-373.
[11] 郭广君,吕素芳,王荣富.外源基因表达系统的研究进展.科学技术与工程,2006,6:582-587.
2008-12-05)
(本文编辑:屠振兴)
Constructionofeukaryoticvectorofhumanneuronalpentraxin2andestablishmentofstabletransfectedPANC1cellline
ZHANGLing,GAOJun,GONGYan-fang,LIZhao-shen,WUHong-yu,JINJing,MANXiao-hua.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo construct eukaryotic vector of human neuronal pentraxin 2 (NPTX2), and obtain the stable transfected PANC1 cell lines.MethodsThe full-length cDNA of NPTX2 was digested by EcoR1 and Not1, and was cloned into plasmid pcDNA3.1, which were confirmed by sequencing, then the pcDNA3.1 (+) and pcDNA3.1 (+)-NPTX2 vectors were transfected into PANC1 cells by LipofectamineTM2000. The stable transfected PANC1 cell lines were selected by the ability of resistance to G418. The NPTX2 mRNA expression of PANC1 in the selected clones was detected by real-time quantitative PCR.ResultsThe eukaryotic vector pcDNA3.1 (+)-NPTX2 was constructed successfully, stable transfected PANC1 cell line was established and confirmed by real-time quantitative PCR.ConclusionsThe construction of eukaryotic vector targeting NPTX2 and the established stable transfected PANC1 cell line provided a solid experimental foundation for further studies on the function of NPTX2 in pancreatic cancer cells.
Pancreatic neoplasms; NPTX2; Transfection; Cell line
研究表明,胰腺癌存在遗传学改变及表观遗传学变化[1-3],但是,迄今为止胰腺癌的确切分子发病机制尚不清楚。神经元正五聚蛋白2(neuronal pentraxin 2, NPTX2)在胰腺癌组织及胰腺癌患者胰液中均处于高甲基化状态[4-5],但该基因在胰腺癌发生发展过程中的作用尚无报道。为进一步研究NPTX2基因的功能及其在胰腺癌发病机制中的作用,本实验建立了稳定转染NPTX2的人胰腺癌细胞PANC1,现报道如下。
10.3760/cma.j.issn.1674-1935.2010.01.012
200433 上海,第二军医大学长海医院消化内科
李兆申,Emial: zhsli@81890.net
