Dysadherin基因沉默对胰腺癌细胞侵袭移行能力的影响
2010-11-23杜冀晖张厚德高燕谢宏民
杜冀晖 张厚德 高燕 谢宏民
·论著·
Dysadherin基因沉默对胰腺癌细胞侵袭移行能力的影响
杜冀晖 张厚德 高燕 谢宏民
目的探讨靶向封闭dysadherin基因对胰腺癌细胞PANC1、BxPC3体外侵袭移行能力的影响。方法应用脂质体转染方法将小分子RNA(siRNA)转染细胞。实验分为dysadherin-siRNA转染(dysa)组、阴性对照siRNA转染(HK)组、脂质体对照(对照)组、。采用RT-PCR、免疫组化方法检测转染细胞的dysadherin mRNA及蛋白表达;采用Transwell侵袭小室检测转染细胞体外侵袭移行能力。结果转染dysadherin-siRNA(5 nmol/L)的PANC1和BxPC3细胞的dysadherin mRNA表达较HK组细胞分别下降95.4%、52.1%(P<0.05);dysadherin蛋白表达亦分别降低91.2%、83.6%(P<0.01)。PANC1细胞的对照组、HK组和dysa组穿膜细胞数分别为163.2±15.5、154.4±17.3和53.6±7.9;BxPC3细胞的对照组、HK组和dysa组穿膜细胞数分别为30.7±3.2、27.5±2.8和4.7±2.4。dysa组显著低于HK组和对照组(P值均<0.01)。结论应用RNA干扰技术沉默人胰腺癌细胞株PANC1、BxPC3的dysadherin基因可使细胞的侵袭移行能力下降。
胰腺肿瘤; RNA干扰; 癌,移行细胞; Dysadherin
近年来的研究表明,癌相关细胞膜糖蛋白dysadherin在肿瘤细胞的过表达能降低细胞间黏附、促进细胞运动和转移[1-2]。本研究应用RNA干扰技术沉默人胰腺癌细胞株PANC1、BxPC3的dysadherin基因,探讨其对胰腺癌细胞侵袭移行能力的影响,为临床应用提供实验依据。
材料与方法
一、实验分组
胰腺癌细胞株PANC1、BxPC3 购自中国科学院上海生科院细胞资源中心,常规培养传代后收集对数生长期PANC1和BxPC细胞,分别接种于6孔板,每孔(0.8~3.0)×105个细胞,分为脂质体对照组、阴性对照siRNA转染(HK)组和dysadherin-siRNA转染(dysa)组。当培养细胞达到50%~80%融合时,HK组和dysa组分别应用脂质体转染HK siRNA和dysadherin 141 siRNA,dysadherin 141 siRNA(序列为GCGCCTGCACCCCGGAGCG)及通用阴性对照HK siRNA(序列为GACTTCATAAGGCGCATGC)由武汉晶赛生物工程技术有限公司提供。对照组仅加脂质体。每组设3个复孔。转染后继续培养24 h,收集各组细胞。
二、RT-PCR 检测细胞dysadherin mRNA表达
采用Trizol试剂抽提各组细胞总RNA,常规进行RT-PCR。dysadherin正义引物为5′-CCTGTGTCTTCTCACCATCG-3′,反义引物为5′-AGGAGGTTGTCAGCTCCTGT-3′,扩增产物为551 bp;内参GAPDH正义引物为5′-AACGTGTCAGTGGTGGACCT-3′,反义引物为5′-AGGGGAGATTCAGTGTGGTG-3′, 扩增产物为400 bp。PCR扩增条件:94℃ 3 min,94℃ 45 s、54℃ 45 s、72℃ 1 min,30个循环,最后72℃ 10 min。产物经琼脂糖凝胶电泳分离,采用凝胶成像系统(法国Vilber Lourma Bio-vision1000)测定条带灰度。以目的条带与GAPDH灰度值之比作为dysadherin mRNA相对表达量,表达抑制率=(1- 转染组表达量/ 对照组表达量)×100%。
三、免疫组化检测细胞dysadherin蛋白表达
制备细胞爬片,同上述方法转染细胞,继续培养24 h后,进行免疫组化检测。由病理科医师在高倍镜下随机观察5个视野,计数细胞并对每个细胞进行评分。细胞不着色为0分,淡黄色为1分,棕黄色为2分,深棕黄色为3分。将评分之和除以细胞数作为dysadherin蛋白表达强度,表达抑制率= (1-转染组表达强度/对照组表达强度) ×100%。
四、Transwell转移小室测定细胞侵袭移行能力
将Transwell小室放入24孔培养板中,上室加300 μl预温的无血清培养基,室温下静置1 h使基质胶再水化,吸去剩余培养液,分别接种300 μl用无血清培养基制备的各组细胞悬液[(0.5~1.0)×106/ml],下室加500 μl含有20%胎牛血清的培养基,常规培养24 h后用棉头拭子擦去基质和聚碳酸酯膜上方的细胞,加入500 μl结晶紫染液浸泡小室20 min,用蒸馏水洗去多余染液,晾干。在显微镜下随机观察10个视野,计数每个视野内穿过膜的细胞数,表示肿瘤细胞的侵袭移行能力。
五、统计学处理

结 果
一、肿瘤细胞dysadherin mRNA及蛋白的表达
PANC1的dysa组和HK组dysadherin mRNA表达量分别为8.5和183,BxPC分别为102和213,dysa组两株细胞dysadherin mRNA表达抑制率分别为95.4%、52.1%(P<0.05)。两细胞对照组的dysadherin mRNA表达量分别为187和213,与HK组无显著性差异(图1)。
PANC1和BxPC3的dysa组的dysadherin蛋白表达均较HK组明显降低,蛋白表达抑制率分别为91.2%、83.6%(P<0.01);HK组与对照组比较,其抑制率仅为1.8%、0.7% (图2)。
二、转染细胞体外侵袭移行能力的变化
dysa组穿过膜的PANC1、BxPC3细胞明显减少(图3)。PANC1的对照组、HK组和dysa组穿膜细胞数分别为163.2±15.5、154.4±17.3和53.6±7.9;BxPC3分别为30.7±3.2、27.5±2.8和4.7±2.4。dysa组显著低于HK组和对照组(P值均<0.01)。
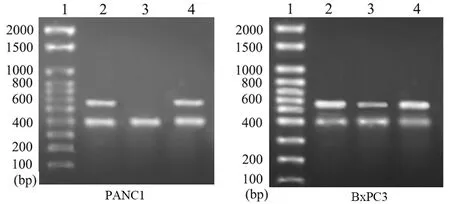
l.DNA marker;2.对照组;3.dysa组;4.HK组
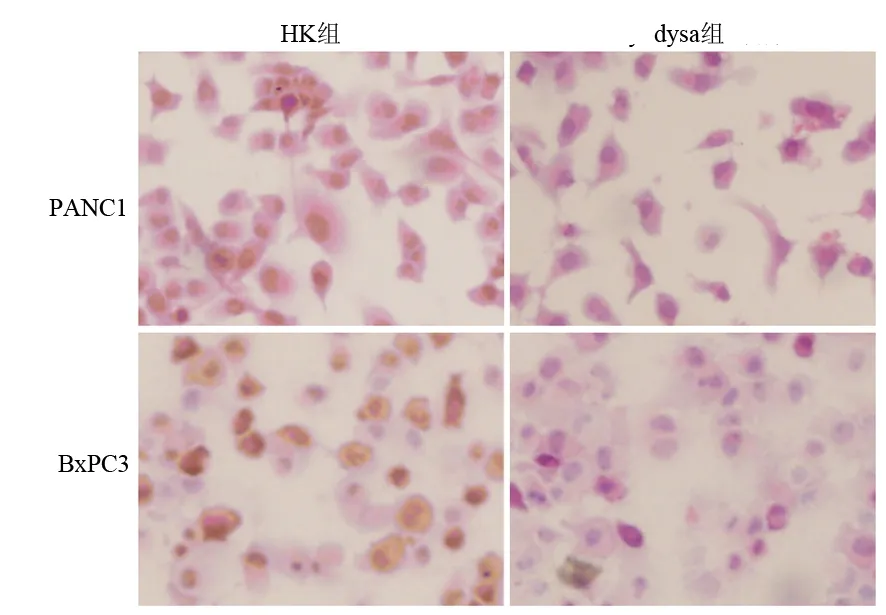
图2各组细胞dysadherin蛋白表达的变化(免疫组化 ×400)
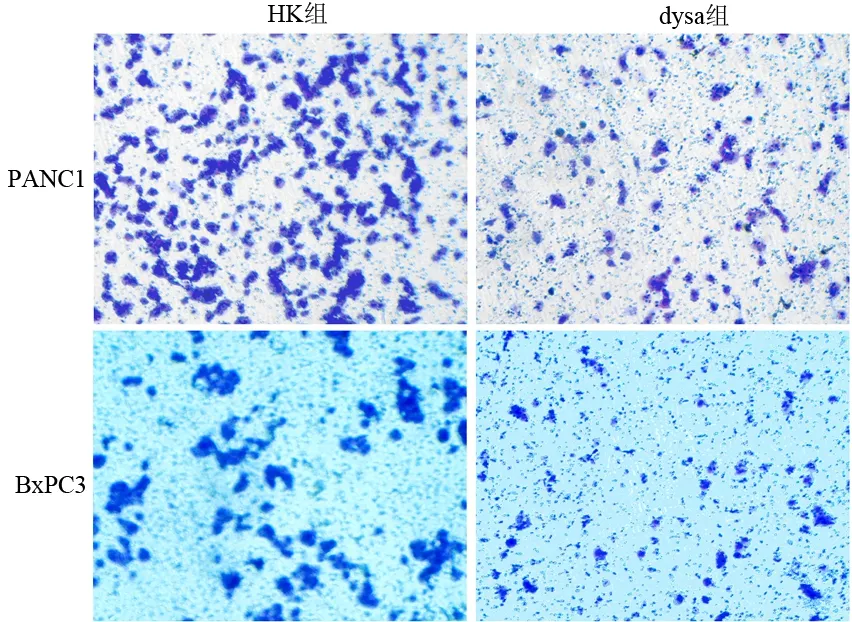
图3 两组细胞的穿膜细胞量( ×100)
讨 论
Dysadherin是位于细胞膜的一种糖蛋白,是一种肿瘤相关性抗原[3]。近年研究发现,dysadherin可能在癌细胞的浸润及转移方面发挥重要作用。Dysadherin主要表达于包括胰腺癌在内的各种不同类型的肿瘤细胞,仅在少数几种正常人体细胞表达[4-6]。Shimamara等[4]报道,dysadherin的表达与胰腺癌的远处转移及不良预后明显相关,且表达dysadherin的胰腺癌细胞在癌巢中所占比例与胰腺癌的组织病理分级明显相关。Ino等[1]报道,dysadherin在人胰腺癌细胞株Capan-1和HPAF-Ⅱ低表达,在PANC1和Miapaca-2中等量表达,在Mpanc-96和BxPC3高表达。将转染dysadherin基因的Capan-1细胞种植于裸鼠胰腺,35 d后裸鼠肝转移明显较对照组增多。
PANC1、BxPC3细胞dysadherin基因沉默后,通过Transwell侵袭小室的细胞数明显减少,提示下调dysadherin的表达能明显抑制胰腺癌细胞的侵袭能力,表明dysadherin 表达可能与胰腺癌细胞的侵袭能力有一定的相关性,与Ino等[1]的研究相似。
肿瘤发生侵袭转移是多因素作用的结果,包括促进细胞运动及侵袭细胞外基质。研究表明,dysadherin可通过抑制E-cadherin介导的细胞间黏附等多种机制降低细胞间黏附、促进细胞运动和转移及肿瘤进展[1,4,7]。此外,dysadherin阳性细胞分泌趋化因子配体CCL2也可能是dysadherin促进肿瘤发生、发展和转移的机制之一[8]。因此,有关以dysadherin为靶点的基因治疗在胰腺癌中的应用及其机制尚需进一步地深入研究。
[1] Ino Y,Gotoh M,Sakamoto M,et al.Dysadherin,a cancer-associated cell membrane glycoprotein,down-regulates E-cadherin and promotes metastasis.Proc Natl Acad Sci USA,2002,99:365-370.
[2] Shimamura T,Yasuda J,Ino Y,et al.Dysadherin expression facilitates cell motility and metastatic potential of human pancreatic cancer cells.Cancer Res,2004,64:6989-6995.
[3] Tsuiji H,Takasaki S,Sakamoto M,et al.Aberrant O-glycosylation inhibits stable expression of dysadherin,a carcinoma-associated antigen,and facilitates cell-cell adhesion.Glycobiology,2003,13:521-527.
[4] Shimamura T,Sakamoto M,Ino Y,et al.Dysadherin overexpression in pancreatic ductal adenocarcinoma reflects tumor aggressiveness: relationship to e-cadherin expression.J Clin Oncol,2003,21:659-667.
[5] Shimada Y,Yamasaki S,Hashimoto Y,et al.Clinical significance of dysadherin expression in gastric cancer patients.Clin Cancer Res,2004,10:2818-2823.
[6] Kyzas PA,Stefanou D,Batistatou A,et al.Dysadherin expression in head and neck squamous cell carcinoma:association with lymphangiogenesis and prognostic significance.Am J Surg Pathol,2006,30:185-193.
[7] Sato H,Ino Y,Miura A,et al.Dysadherin: expression and clinical significance in thyroid carcinoma.J Clin Endocrinol Metab,2003,88:4407-4412.
[8] Nam JS,Kang MJ,Suchar AM,et al.Chemokine (C-C motif) ligand 2 mediates the prometastatic effect of dysadherin in human breast cancer cells.Cancer Res,2006,66:7176-7184.
2009-05-08)
(本文编辑:屠振兴)
EffectofdysadheringenesilencingmediatedbyRNAinterferenceonmetastasisandinvasionofpancreaticcancercells
DUJi-hui,ZHANGHou-de,GAOYan,XIEHong-min.
CentralLaboratory,NanshanHospital,GuangdongMedicalCollege,Shenzhen518052,China
ZHANGHou-de,Email:szkjk@126.com
ObjectiveTo investigate the effect of dysadherin gene silencing on metastasis and invasion in pancreatic cancer cell line PANC1, BxPC3 in vitro.MethodsPANC1 and BxPC3 cells were divided into dysa group, negative siRNA control group (HK), liposomes control group(control). dysa group and HK group were tranfected by dysadherin siRNA and Negative siRNA, respectively.The expression of dysadherin mRNA and protein were detected by RT-PCR and immunohistochemical method. Transwell test was used to evaluate the invasion ability of pancreatic cancer cells.ResultsAfter transfected by dysadherin siRNA, the dysadherin mRNA levels in PANC1 and Bxpc3 cells were decreased by 95.4% and 52.1%. The expression of dysadherin protein was also down-regulated by 91.2% and 83.6%, respectively, when compared with HK groups (P<0.05). The numbers of invasive cells migrated in Transwell in PANC1 cells control group, HK group and dysa group were 163.2±15.5, 154.4±17.3 and 53.6±7.9; the numbers of invasive cells in BxPC cells control group, HK group and dysa group were 30.7±3.2, 27.5±2.8 and 4.7±2.4, respectively. The numbers in dysa group were significantly lower than those of HK group and control group (P<0.01).ConclusionsSilencing the dysadherin gene of PANC1, BxPC3 by RNA interference could significantly inhibit the invasive and migratory ability of canceroas cells.
Pancreatic neoplasms; RNA interference; Carcinoma,transitional cell; Dysadherin
10.3760/cma.j.issn.1674-1935.2010.01.009
深圳市科技计划资助项目(JH200505260369A)
518052 深圳,广东医学院附属南山医院中心实验室(杜冀晖),消化内科(张厚德、高燕、谢宏民)
张厚德,Email: szkjk @126.com
