miR-101在胰腺癌组织中的表达以及对胰腺癌细胞ASPC-1增殖的影响
2010-11-23李先鹏郭世伟金震东曲乐
李先鹏 郭世伟 金震东 曲乐
·论著·
miR-101在胰腺癌组织中的表达以及对胰腺癌细胞ASPC-1增殖的影响
李先鹏 郭世伟 金震东 曲乐
目的观察miR-101在胰腺癌组织中的表达,探讨其对胰腺癌细胞增殖的影响。方法采用实时定量PCR方法检测miR-101在胰腺癌组织、癌旁组织和胰腺癌细胞株ASPC-1中的表达。通过基因重组技术构建miR-101的表达载体peGFPc1-miR-101,应用脂质体将其转染到ASPC-1细胞,荧光显微镜检测转染效率;实时定量PCR检测转染细胞miR-101的表达水平,以癌旁正常胰腺组织为1,折算成相对倍数;MTT法检测转染细胞的增殖率。利用在线软件targetScan预测miRNA可能的靶基因。结果miR-101在胰腺癌组织和胰腺癌细胞株ASPC-1中相对表达量分别为55%和39%,较癌旁正常胰腺组织显著降低(P<0.01)。peGFPc1-miR-101转染ASPC-1细胞后,miR-101表达增加,为对照组的19.8倍(P<0.01),癌细胞增殖率明显降低,最低仅为原代细胞的26%(P<0.01)。EZH2基因是miR-101影响胰腺癌细胞增殖活力的可能靶基因。结论胰腺癌组织miR-101低表达,它可能通过抑制EZH2的表达调控细胞的增殖。
胰腺肿瘤; miR-101; 细胞增殖
微小RNA(microRNA,miRNA)是近期发现的生物体内源长度约为19~25个核苷酸的非编码小RNA,通过与靶基因miRNA的3′非翻译区(3′-UTR)互补配对,而在转录后水平上对基因的表达进行调控,导致miRNA的降解或翻译抑制。最近几年的研究发现,miRNA与人类肿瘤的发生、发展关系密切,在各种肿瘤组织中存在miRNA的异常表达[1]。目前已有胰腺癌组织的miRNA异常表达谱的报道[2],但针对某一特定异常表达的miRNA在胰腺肿瘤发生、发展中的功能作用尚缺乏研究。为此,本实验检测miR-101在胰腺癌组织中的表达,探讨其对胰腺癌细胞增殖的影响。
材料与方法
一、材料
真核表达质粒载体peGFPc1购自Clonetech公司,E.coli DH5α感受态细胞购自天根生物公司。胰腺癌细胞株ASPC-1为本实验室冻存。3例胰腺癌及其相应癌旁正常胰腺组织为长海医院手术切除的新鲜标本。Trizol、脂质体、miRNAs检测试剂盒等均购自Invitrogen公司,限制性内切酶、凝胶回收试剂盒、质粒提取试剂盒、DNA marker、反转录酶、实时定量PCR试剂等均购自TAKARA公司,MTT试剂盒购自天根生物公司。
二、方法
1.miR-101表达的检测:采用Trizol法提取胰腺癌组织、癌旁组织及胰腺癌细胞株ASPC-1细胞的总RNA。琼脂糖凝胶电泳以及分光光度计分别检测RNA浓度和质量。
根据Gene Bank公布的人miR-1基因的序列,用primer primerer5.0软件设计克隆引物。miR-101-F:GAAGATCTATATGGCCCATCTGAGGTTG,含Bgl Ⅱ酶切位点;miR-101-R:CCCAAGCTTAAAAACCTCCCACCACGAAT,含Hind Ⅲ酶切位点。内参U6购自Invitrogen公司。引物由Invitrogen公司合成。以100 ng总RNA为模板,逆转录cDNA,RT反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min。再利用taqman miRNA assay进行实时PCR。PCR反应:94℃ 10 min, 94℃ 30 s、60℃ 1 min,45个循环。每组实验重复3次,结果用Ct值分析,以癌旁正常胰腺组织表达量为1,折算为相对倍数。每组PCR实验均以持家基因U6作为内参。
2.miR-101表达载体构建及细胞转染:以人的基因组DNA为模板,PCR法扩增miR-101片段。 PCR反应条件:94℃ 10 min,94℃ 30 s、55℃ 20 s、72℃ 15 s,30个循环,72℃延伸5 min。扩增片段经电泳分离、回收,由Invitrogen公司负责测序。测序正确后,应用限制性内切酶酶切,连接至质粒peGFPc1中,构建miR-101表达载体peGFPc1-miR-101。
将ASPC-1细胞按1×104个/孔的密度接种于96孔板常规培养。待细胞生长密度达60%~70%后,采用脂质体Lipofectamine-2000将peGFPc1-miR-101转染细胞。以仅加入脂质体的细胞作为阴性对照。
3.转染细胞增殖率检测:转染后0、12、24、48、72 h收集细胞,采用MTT法检测细胞增殖活力。细胞相对增殖率=(实验孔A530-空白孔A530)/(阴性对照孔A530值-空白孔A530)。实验重复3次,取均值。
4.miRNA靶基因的预测:采用miRNA靶基因预测软件targetScan(http://www.targetscan.org/)筛选miR-101靶向作用的基因。
结 果
一、 miR-101在胰腺癌组织中的表达
miR-101在胰腺癌和胰腺癌细胞株ASPC-1的相对表达量分别是癌旁正常胰腺组织的55%和39%,较癌旁正常胰腺组织显著降低(P<0.01)。
二、peGFPc1-miR-101的鉴定
带GFP报告基因的peGFPc1-miR-101转染细胞24 h后,>70%的ASPC-1细胞内出现绿色荧光基因信号(图1a)。转染细胞的miR-101表达量明显升高,为阴性对照组的19.8倍(P<0.01),阴性对照组和空白对照组之间无明显变化 (图1b)。

图1peGFPc1-miR-101转染的ASPCA-1细胞(a)及其miR-101表达(b)
三、转染细胞增殖的变化
转染后12 h,细胞的增殖率降低,为对照组的85%;转染后24 h,增殖率仅为对照组的27%(P<0.01);转染后72 h,增殖率为对照组的26%(P<0.01,图2)。
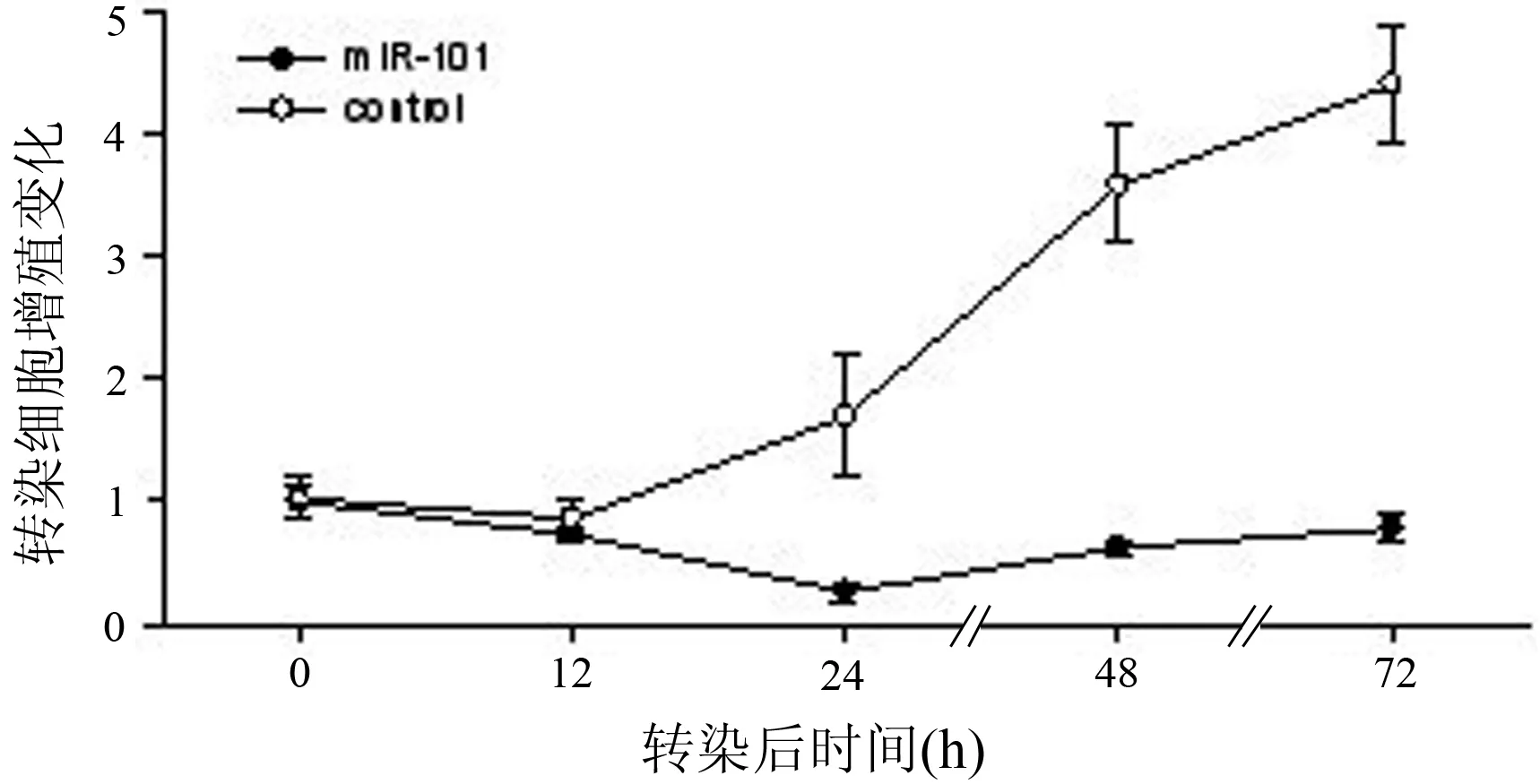
图2 转染后ASPC-1细胞的生长曲线
四、miR-101抑制靶基因的筛选
根据targetScan的预测,miR-101在Zeste基因增强子(EZH2)的3′-UTR区域中有两个作用位点,能较强地抑制该基因的表达(图3)。

图3 miR-101在Zeste基因增强子(EZH2)的靶位点
讨 论
随着研究的不断深入,目前认为miRNA在肿瘤的发生发展过程中具有与癌基因或抗癌基因相似的作用[3]。因此,深入研究miRNA在肿瘤中的功能,了解其作用的机制和通路,对肿瘤的治疗、诊断以及进程监控都具有重要意义[4]。
miR-101是脊椎动物所特有的一个miRNA,它有两个前体,分别位于人的1号染色体和9号染色体中,但其成熟序列在各个物种中高度保守。目前已有研究证实,miR-101在肝癌、前列腺癌等实体肿瘤中发挥着重要的作用[5-7]。本结果显示,miR-101在胰腺癌组织中表达降低,而转染表达miR-101的胰腺癌细胞的增殖被明显抑制,提示miR-101在胰腺癌的发生发展过程中起着如同抑癌基因的重要作用。Zeste基因增强子(EZH2)基因是哺乳动物细胞中的一个组蛋白甲基化酶,具有促进目标基因沉默的能力,对癌细胞的存活和转移也具有重要的调控功能。
EZH2过度表达会导致癌细胞具有侵入性,加快实体肿瘤组织癌细胞的增殖和转移[8]。本实验预测miR-101靶点在EZH2基因的3′-UTR区域,能抑制该基因的的转录后水平,从而达到抑制癌细胞的增殖和转移,与本实验结果相符。
最近也有研究发现,肝癌细胞的抗凋亡基因MCL-1也是miR-101的靶基因之一[4,9-10]。MCL-1是一种受高度调节的蛋白,其表达受到各种生存及分化信号的调节。细胞凋亡的过程中它的表达下调,在细胞的存活过程中起着至关重要的作用。因此推测,在胰腺癌细胞的增殖过程中,MCL-1基因的表达可能也受miR-101的调控。
[1] Garzon R,Fabbri M,Cimmino A,et al.MicroRNA expression and function in cancer.Trends Mol Med,2006,12:580-587.
[2] Zhang Y,Li M,Wang H,et al.Profiling of 95 microRNAs in pancreatic cancer cell lines and surgical specimens by real-time PCR analysis.World J Surg,2009,33:698-709.
[3] Slack FJ,Weidhaas JB.MicroRNA in cancer prognosis.N Engl J Med,2008,359:2720-2722.
[4] Tricoli JV,Jacobson JW.MicroRNA:Potential for Cancer Detection,Diagnosis,and Prognosis.Cancer Res,2007,67:4553-4555.
[5] Varambally S,Cao Q,Mani RS,et al.Genomic loss of microRNA-101 leads to overexpression of histone methyltransferase EZH2 in cancer.Science,2008,322:1695-1699.
[6] Su H,Yang JR,Xu T,et al.MicroRNA-101, down-regulated in hepatocellular carcinoma,promotes apoptosis and suppresses tumorigenicity.Cancer Res,2009,69:1135-1142.
[7] Friedman JM,Liang G,Liu CC,et al.The putative tumor suppressor microRNA-101 modulates the cancer epigenome by repressing the polycomb group protein EZH2.Cancer Res,2009,69:2623-2629.
[8] Fujii S,Ito K,Ito Y,et al.Enhancer of zeste homologue 2 (EZH2) down-regulates RUNX3 by increasing histone H3 methylation.J Biol Chem,2008,283:17324-17332.
[9] Banerjee S,Choi M,Aboukameel A,et al.Preclinical studies of apogossypolone,a novel pan inhibitor of bcl-2 and mcl-1,synergistically potentiates cytotoxic effect of gemcitabine in pancreatic cancer cells.Pancreas,2010,39:323-331.
[10] Ulivi P,Arienti C,Amadori D,et al.Role of RAF/MEK/ERK pathway,p-STAT-3 and Mcl-1 in sorafenib activity in human pancreatic cancer cell lines.J Cell Physiol,2009,220:214-221.
2010-05-26)
(本文编辑:屠振兴)
TheexpressionofmiR-101inpancreaticcanceranditseffectonproliferationofpancreaticcancercelllineASPC1
LIXian-peng,GUOShi-wei,JINZhen-dong,QULe.
DepartmentofGatroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
ObjectiveTo investigate the expression of miR-101 in pancreatic cancer and the effect of down-regulation miR-101 on proliferation of pancreatic cancer cell line ASPC1.MethodsReal-time PCR was used to determine the expression of miR-101 in pancreatic cancer, adjacent tissues and pancreatic cancer cell line ASPC-1. The miR-101 over-expression vector (peGFPc1-miR-101) was constructed and was transfected into ASPC-1 cell. Transfection efficiency was measured by fluorescence microscope. The expression of miR-101in the transfected cells was detected by real-time PCR. Cell viability analysis was performed by MTT. The targeted genes of miR-101 in pancreatic cancer were scanned by the online targeted gene prediction software (target Scan).ResultsThe expression of miR-101 was in pancreatic cancer tissues, adjacent tissues and ASPC-1 cell line, respectively. The expressions in pancreatic cancer tissues and ASPC-1 cells were significantly lower than that in adjacent tissues (P<0.01). The expression of miR 101 in transfected cells increased to 19.8 folds as much as that in the control group (P<0.01). Proliferation rate of transfected cells was significantly decreased, which was only 26% of primary cells (P<0.01). EZH2 was the potential targeted gene of miR-101 in pancreatic cancer.ConclusionsmiR-101 was weakly expressed and it may affect the proliferation of pancreatic cancer cell by inhibiting the EZH2 expression.
Pancreatic neoplasms; miR-101; Cell proliferation
Correspongdingauthor:JINZhen-dong,Email:zhendjin@126.com
10.3760/cma.j.issn.1674-1935.2010.04.016
200433 上海,第二军医大学附属长海医院消化内科(李先鹏、金震东),普外三科(郭世伟);第二军医大学(曲乐)
共同第一作者:郭世伟
金震东,Email:zhendjin@126.com
