亚低温对大鼠急性脊髓损伤后局部线粒体呼吸功能的影响
2010-11-22第四军医大学西京医院急诊科西安710032
第四军医大学西京医院急诊科(西安 710032)
赵 鹏 余厚友 王 肖 王慧贤 尹 文
近年来,亚低温在中枢神经系统损伤后的保护方面的研究得到了大部分学者的认同。亚低温治疗在急性脊髓损伤中的作用研究也正在起步,其治疗机制也在逐步明晰。细胞活动所需能量90%以上由线粒体氧化磷酸化提供。因此,外伤后线粒体呼吸功能的改变直接影响到神经细胞的功能。本研究采用超速离心法分离出损伤段脊髓线粒体,观察脊髓损伤后线粒体呼吸功能的变化及亚低温对它的影响,并从亚细胞水平探讨亚低温治疗对脊髓损伤后继发性损害的病理生理演变过程的影响。
材料与方法
1 实验动物和分组 SD大鼠 54只,雌性,体重220~260 g(第四军医大学动物中心提供),随机分为3组:假手术组(A组,18只)、SCI组(B组,18只)、亚低温组(C组,18只)。
2 SCI动物模型制作 SCI组和亚低温组参照改良的Allen’s法[1]制作大鼠脊髓中度损伤模型:实验前大鼠禁食 8 h,用戊巴比妥钠(30 g/L)按 40 mg/kg腹腔注射麻醉,背部脱毛后俯卧位固定于动物手术台上,常规消毒,腰背部正中切口,逐层分开显露 T8~T10椎板,行 T9全椎板切除,显露硬脊膜,钳夹固定 T8及T10棘突,用 50 g的不锈钢棒(直径为2.5 mm)沿带有刻度的玻璃导管从 10 mm高处垂直下落,打击在由塑料材料制成的底部呈凹面、直径为3 mm的撞杆上,后者将打击力传递给脊髓,造成大鼠脊髓不完全损伤,致伤后迅速移开打击物,逐层缝合。模型成功的判断标准:打击后损伤处脊髓出血、水肿,大鼠出现摆尾反射,双下肢及躯体回缩样扑动,麻醉清醒后双下肢呈弛缓性瘫痪。对照组仅行 T9全椎板切除术作对照。术后即刻腹腔注射5%葡萄糖盐水2 ml,以补充血容量。术后处理:每只大鼠分笼饲养,不限制进食和饮水,术后定时协助损伤大鼠排尿、排便。
3 亚低温治疗 采用美国惠浦 HP-V26温度测定仪连续监测大鼠肛温。模型建立成功后,亚低温组大鼠体温降至34℃左右。术前予全身烤灯加热,使其温度维持(37.5±0.2)℃。亚低温治疗组伤后5min内立即使用腹部冰袋降温法将大鼠肛温降至(34±1)℃,烤灯+腹部冰袋降温法维持亚低温至治疗所需时间(损伤后6h),然后室温下自然复温。
4 脊髓组织线粒体的提取 分别于损伤后 6、12和24 h三个时相点取材,每个时相点6只大鼠。根据 Estabrook方法,各组在伤后相应时段取出损伤段脊髓组织,用预冷的生理盐水冲洗脊髓组织,滤纸吸干后称重。按16ml/g比例加入分离介质至Teflon芯匀浆器中匀浆。然后将匀浆倒入预冷的离心管中,3000g离心 10min,取上清后配平,15000g离心 10min。弃去上清,沉淀部分再用分离介质充分漂洗,15000g离心10min。弃去上清,沉淀中加入分离介质0.5ml,充分打匀制成线粒体悬液约10mg/ml,置冰浴中待用。整个分离过程在冰浴中进行,离心在0~4℃条件下进行。
5 线粒体功能指标的测定 采用Clark氧电极法[1],取反应介质(0.225mol/L蔗糖,15 mmol/L KCl,15 mmol/L KH2 PO4,50 mmol/L TrisHCl,1 mmol/L EDTA,p H 7.5)2.9 ml,加入搅拌反应杯中,恒温 30℃,加入线粒体悬液0.1 ml,以琥珀酸(终浓度10 mmol/L)为底物,反应 1 min后,加入600nmol/L ADP,用 JYD-IA溶氧测定仪记录线粒体氧化还原反应曲线,计算 R3、R4、RCR和P/O。(测得的氧耗速率为氧化呼吸链呼吸Ⅲ(R3);ADP完全磷酸化后测得的氧耗速率为氧化呼吸链呼吸Ⅳ(R4),呼吸控制率(RCR)=R3/R4,磷氧比(P/O)=ADP量 /R3耗氧量)。
结 果
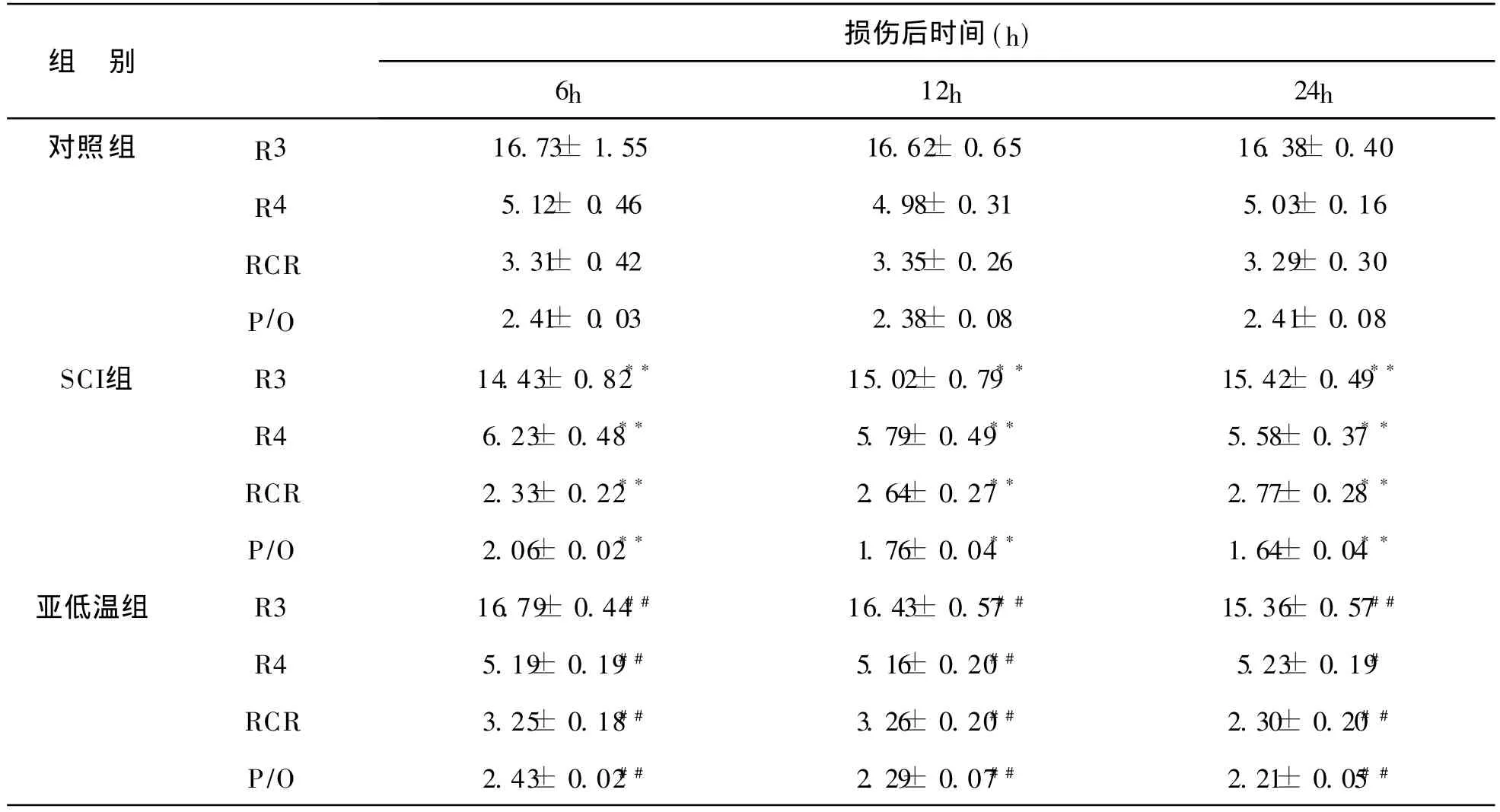
SCI组伤后 6、12、24 h的R3和RCR显著低于对照组,R4显著高于对照组,亚低温组伤后 6、12h的R3和RCR高于SCI组,R4低于SCl组,差异均有统计学意义(P<0.01);亚低温组 R3、R4、RCR在伤后 6、12h和对照组比较差异无统计学意义。24 h时相 R3和RCR低于对照组,差异有统计学意义(P<0.05)。
线粒体的P/O直接反映了线粒体氧化磷酸化的变化,见附表。SCI组在伤后各时相总P/O明显低于对照组,亚低温组 P/O明显高于SCI组,差异均有统计学意义(P<0.01);伤后 6、12 h亚低温组和对照组之间无明显差异,但24 h仍低于对照组(P<0.05)
附表 线粒体 R3、R4、RCR(%)和P/O变化 [nmol/(min· mg),(±s)]
附表 线粒体 R3、R4、RCR(%)和P/O变化 [nmol/(min· mg),(±s)]
与对照组比较,**P<0.01;与SCI组比较,#P<0.05,##P<0.01
RCR 2.33±0.22** 2.64±0.27** 2.77±0.28**P/O 2.06±0.02** 1.76±0.04** 1.64±0.04**亚低温组 R3 16.79±0.44## 16.43±0.57## 15.36±0.57##R4 5.19±0.19## 5.16±0.20## 5.23±0.19#RCR 3.25±0.18## 3.26±0.20## 2.30±0.20##P/O 2.43±0.02## 2.29±0.07## 2.21±0.05##
讨 论
有研究报道脑创伤后 6~12 h线粒体呼吸活性R3、RCR、P/O和氧化磷酸化效率均明显下降,R4相对正常或升高[3]。本实验中SCI组在伤后R3显著低于对照组,同时R4显著高于对照组,RCR、P/O明显低于对照组,差异均有统计学意义,见附表。表明脊髓损伤后伤段脊髓线粒体内膜底物通透性、呼吸链和ATP/ADP移位体等明显受到影响。线粒体内膜通透性增加。也说明损伤的线粒体 RCR的变化是由 R3降低和R4升高共同变化造成。线粒体氧化磷酸化偶联程度明显受到抑制,利用氧化释放能量转化为ATP的效率明显降低。早期使用MP可明显降低线粒体内膜通透性,改善线粒体氧化磷酸化的偶联程度,保护伤段脊髓线粒体的稳定性。
本研究中亚低温治疗组在脊髓损伤伤后 6 h和12 h的R3明显高于SCI组,R4明显低于SCI组,差异均有统计学意义;亚低温组伤后6h和12h的RCR和P/O与对照组之间无明显差异,但24 h仍低于对照组,见表一。说明伤后局部脊髓线粒体利用氧化释放能量转化为ATP的效率明显降低。早期使用亚低温治疗可明显减轻对线粒体内膜底物通透性、呼吸链的影响,降低线粒体内膜通透性,改善线粒体氧化磷酸化的偶联程度和提高线粒体能量转化的效率,对伤段脊髓线粒体的稳定性和功能有一定的保护作用。
亚低温对中枢神经损伤保护的机理主要包括:降低脑组织氧耗量,减少脑组织乳酸堆积;保护血脑屏障,减轻脑水肿;抑制内源性毒性产物对脑细胞的损害作用;减少钙离子内流,阻断钙对神经元的毒性作用;改变遗传信息的传递,促进蛋白质合成的恢复,减少脑细胞结构蛋白破坏,促进脑细胞结构和功能修复;减轻弥漫性轴索损伤;改变脑缺血后各种酶的活性,减轻缺血性神经元损伤;调节损伤后钙调蛋白激酶Ⅱ和蛋白激酶的活性,促进缺血再灌注后期蛋白质的合成;抑制神经元凋亡;抑制脑损伤缺血缺氧后的炎性反应[7~9]。实验表明线粒体有摄取、积聚二价阳离子如 Ca2+、Mg2+等作用,调节胞浆游离 Ca2+的浓度,从而实现细胞的释放反应、受体调节、信息传递。研究表明细胞内和线粒体内 Ca2+超载是脊髓损伤后线粒体功能障碍、结构受损的重要原因 。在颅脑损伤中的研究结果表明,亚低温治疗能减少脑组织Ca2+内流,从而降低磷脂酶活性,使线粒体膜结构保持完整性,又使自由基形成减少。本实验显示:SCI组 R3、RCR、P/O与对照组相比明显下降,R4明显上升,亚低温治疗组 RCR和P/O比值高于SCI组,表明亚低温治疗能改善损伤脊髓线粒体氧化磷酸化功能,改善线粒体呼吸功能,从而证实亚低温在脊髓水平也能起到相似作用。
近年来,随着亚低温脑保护在动物实验和临床应用上的成功,有关亚低温治疗脊髓损伤的研究和临床应用也相继开展。本实验从亚细胞水平提示,使用亚低温治疗,可提高伤段脊髓线粒体的呼吸功能,对脊髓损伤有一定的保护作用,笔者希望此方面的研究将会为今后亚低温脊髓保护工作的开展提供一定的理论依据。
[1] Estabrook RW.Oxidative and phosphorylation methods in enzymology.new york:Academic Press,2005,(10):45.
[2] Vink R,Golding EM,Headrick JP.Bioenergetic analysis 0f oxidative metabolism following traumatic brain injury in rats[J].Neurotranata,1994,11(3):265-268.
[3] Uu D,U L.Prostaglandin re1ease by spinal cord injury mediates production 0f hydroxyl radical,malondiadehyde and ce11 death:a site of neuroprotective action of methylpredinsolone[J].Neurotraunsm,2001,77(4):1036-1047.
[4] Mckenzie AL,Hall JJ,Aihara N,et al.Immunolocalization of endothelin in the tmumatized spinal cord:relationship to blood spinal cord barrier breakdown[J].JNeurotrauma,1995,12(3):257-268.
[5] Salzman SK,Aeosta R,Beck G,etal.Spinal endothelin content is elevated after moderatelocal trauma in the rat to levels associated with locomotor dysfunction .intrathecal injection[J].JNeurotrama,1996,13(1):93-101.
[6] Holmin S,Mathiesen T.Intracerebral administration of interleukin-1 beta and induction of inflammation,apoptosis,and vasogenic edema[J].JNeuro Surg,2000,92(1):108-l20.
[7] Oudega M,Vargas CG,Bunge MB.Long-term effects of methylprednisolone following transection of adult rat spinal cord[J].Eur JNeurosci,1999,11(7):2453-2464.
[8] 只达石.亚低温脑保护的发展和现状[J].现代神经疾病杂志,2002,2(3):133-135.
[9] Harris OA,Coford MJ,Good M C,etal.The role of hypothermia in the management of severe brain injury[J].Are Neurol,2002,59(7):1077-1088.
[10] Khan T,Havey R M,Sayers S T,etal.Animal models of spinal cord contusion injuries[J].Lab Anim Sci,1999,49:161-172.
[11] 郭亚乐.缺氧缺血性脑损害亚低温干预持续时间的选择[J].陕西医学杂志,2003,32(1):92.
