麦麸饲料中细菌对家蝇幼虫生长发育的影响
2010-11-22苏志坚李广宏张敏静林健聪黄亚东
苏志坚,庞 义,李广宏*,张敏静,林健聪,黄亚东,3
(1.中山大学有害生物控制与资源利用国家重点实验室/昆虫学研究所,广州 510275;2.广州暨南大学医药生物技术研究开发中心,广州 510632;3.基因工程药物国家工程中心,广州 510632)
家蝇 Musca domestica L.是一种分布广泛、数量众多、与人畜接触频繁的双翅目昆虫,既可以作为经济昆虫大规模人工饲养以获取优质动物蛋白(郎跃深,2009),同时也是传播伤寒、痢疾、霍乱、鼠疫、炭疽等多种严重疾病的重要媒介之一(Grubel et al.,1997;Zimmerman et al.,1989;Zurek et al.,2001)。在自然界,家蝇幼虫大多生活在富含微生物群落的诸如动物尸体、排泄物、生活垃圾以及食品等有机基质中。而基质中的微生物群落,尤其是细菌,对其生存、生长和发育起着关键性作用(Zurek et al.,2000;Graczyk et al.,2001;Moon,2002)。研究资料表明,家蝇幼虫在完全无菌的环境中不能发育至 3龄(Gerberich,1948;Schmidtmann and Martin,1992)。然而,在培养基中添加活的或者死的细菌均能使幼虫完成整个生活史(Greenberg,1954;Levinson,1960)。目前,关于细菌支持家蝇幼虫生长发育的真正机制尚未清楚,一种解释是细菌在幼虫肠道中为其提供维生素以及固醇类等生长必需物质(Bergmann and Levinson,1954;Brookes and Fraenkel,1958;Chang and Wang,1958);另一种解释是细菌分解幼虫生活环境中的有机物质(Zurek et al.,2000;Moon,et al.,2001);还有一解释种就是细菌直接作为幼虫食物(Levinson,1960;Rochon et al.,2004)。
并不是所有的细菌都能支持家蝇幼虫的生长发育,且不同种类的细菌及细菌群落对幼虫的存活率、化蛹率、蛹重及羽化率都有不同的影响。Schmidtmann和 Martin(1992)在血琼脂平板上分别接种 9种细菌,结果发现,家蝇幼虫的化蛹率在 0~69%之间,而羽化率则在 0~54%之间。Zurek等(2000)将不同细菌接种到胰化酪蛋白大豆卵黄琼脂(Trypticase Soy Egg Yolk Agar,TSEYA)培养基中,然后接入无菌幼虫进行培养。结果发现,24种细菌当中,共有 8种(Morganella morganii,Providencia rettgerii,Serratia marcescens,Providencia stuartii,Microbacterium barkei,Xanthobacter flavus,Corynebacterium seminale,Gordona amarae)不能支持幼虫的生长,而其余细菌对幼虫的化蛹率、蛹重以及羽化率的影响则分别为 6.67%~93.3%、11.8~24.2 mg和 0 ~ 91.5%。 Rochon等(2004)将 Empedobacter brevis、Flavobacterium odoratum和 Escherichia coli等量混合,然后接种到 TSEYA培养基中,结果发现,家蝇幼虫在这种培养基中的存活率、化蛹率、生长时间及蛹重均显著优于单独接种 E.coli,这个研究也说明多种不同细菌群落可以为幼虫提供更为充分的营养。
家蝇幼虫可以在动物粪便、米糠、奶粉、酒糟及麦麸等培养料中进行饲养(Spiller,1964)。麦麸因其产量大、价格低廉、处理方便以及无寄生螨等特点,自 Richardson(1932)报道以来就成为人工饲养家蝇的主要材料。然而,家蝇幼虫对麦麸的利用率非常低,一般情况下料虫比仅为 3:1(彭宇等,1996)。此外,尽管剩余麦麸的营养组成与新鲜麦麸相差不大,但并不能继续用于家蝇幼虫、牲畜以及家禽等的饲养。由于家蝇幼虫在生长发育过程中可以利用细菌作为食物且没有选择性,而一些细菌又不支持幼虫的生长发育(Zurek et al.,2000;Schmidtmann and Martin,1992;Watson et al.,1993;Rochon et al.,2004;Lysyk et al.,1999;Peck and Walton,2006)。因此,筛选培养基中可以支持幼虫生长的各种细菌以及了解细菌中不同营养物质对幼虫生长发育影响对今后开展低成本集约化生产家蝇幼虫和进行特种经济动物生态养殖具有重要的作用。
1 材料与方法
1.1 麦麸中细菌分离方法
取 10 g小麦麸(购自广州市南方面粉厂,批号:20070325),加入无菌去离子水 40 mL,在超净台内充分搅拌混匀后,4℃静置 16 h。然后,纱布过滤,收集上清。将该上清液按 10倍进行系列稀释(10-2~10-8),各取 1 mL在 SOC琼脂平板中进行涂布(100μL/板),30℃,培养 24 h。按照单菌落的形态、大小、色泽、透光度、革兰氏染色、活动能力、氧化能力以及催化能力等指标进行挑选分离(Garcia et al.,1998)。
1.2 不同细菌 16Sr RNA鉴别方法
将初步分离的各种细菌单克隆接种到 LB培养基中,220 rpm,30℃,培养 16 h。然后,利用基因组DNA抽提试剂盒(Qiagen,Cat.#51504,Germany)获得各种菌株的基因组 DNA。合成上下游引物63 F(5'-CAGGCCTAACACATGCAAGTC-3')和1387 R(5'-GGGCGGTGTGTACAAGGC-3')(Acinas et al.,2004),并建立标准的 PCR体系(50μL体积):10×PCR buffer 5μL,dNTP(各 2.5 mM)4μL,63F(10μM)2.5μL,1387R(10μM)2.5μL,DNA 聚 合 酶 (Hotstart,5 U/μL,Qiagen,Cat.#203603,Germany)0.25 μL,模板 DNA 1μL(100 ng/μL),灭菌水 34.75μL。然后,进行 PCR扩增(95℃,5 min,1个循环;94℃,30 s;55℃,30 s;72℃,1.5 min;25个循环;72℃,10 min,1个循环)。1%的琼脂糖凝胶电泳检测,割胶回收PCR扩增产物。将回收片段克隆到 T-载体(pGEMT,Cat.#1380,Promega,USA)上,再转化到大肠杆菌 JM109中,氨苄青霉素抗性筛选重组子并送上海生工生物工程有限公司进行测序。获得的序列在NCBI数据库进行比对分析(www.ncbi.nlm.nih.gov/blast)。
1.3 不同细菌对家蝇幼虫生长发育影响的测定
本实验中所使用的家蝇成虫及幼虫均取自中山大学有害生物控制与资源利用国家重点实验室,并在温度为 25~30℃,湿度为 70%~90%及光周期 L:D=16:8 h的条件下饲养。TSEYA培养基的配制参考 Watson等(1993)方法。
1.3.1 家蝇卵的表面消毒
取 500~700个卵,在超净台内,将卵放入平皿中,加入预冷的(15℃)无菌水 29.688 mL,然后缓慢加入 312μL 30%次氯酸钠溶液(广州化学试剂厂,AR),快速搅拌混匀,并静置 15 min。用吸管收集卵,无菌水洗涤 3~ 4次后,置于灭菌滤纸上,再放入平皿中,Parafilm膜封口。28℃,70%~90%湿度培养 12~14 h至幼虫孵化。
1.3.2 细菌在培养基中的生长速度以及 pH变化。
将各种细菌接种到胰化酪蛋白大豆卵黄液体培养基中,220 rpm,37℃,培养 16 h后测量其 pH值。再将各种细菌接种于液体 LB培养基中,220 rpm,37℃,培养 16 h,取 1 mL培养液,离心收集沉淀,无菌水洗涤 3次后称重。实验重复 3次。
1.3.3 家蝇幼虫在细菌培养基中的生长发育
将已鉴定的各种细菌分别接种到 LB液体培养基中,220 rpm,37℃,摇瓶震荡培养 14~16 h后测量其 OD595值。然后用灭菌水稀释至 OD595=0.250±0.02。在 TSEYA培养基中各加入 100μL菌液,每种菌接 3瓶。对照组中加入等量的无菌水。用灭菌毛笔挑取刚孵化的无菌幼虫(虫龄<8 h),接种到含不同细菌的 TSEYA培养基中(10~12头 /瓶),28±0.5℃,70% ~80%的湿度及光周期 L:D=16:8 h的条件下饲养至化蛹为止,每天观察 3次。实验重复 3次。
1.4 单纯细菌作为食物对家蝇幼虫生长发育影响的测定
将各种细菌分别接种到 250 mLLB液体培养基中,220 rpm,37℃,摇瓶震荡培养 16 h,然后转入到5 L发酵罐中进行培养。4℃,12000 rpm(13920 xg)离心 5 min收集菌体,用无菌水洗涤菌体 4~5次后,称重,用去离子水稀释至终浓度为 100 mg/mL。在 100 mL三角瓶中,放入一块灭菌棉垫(r=2.5 cm,h=0.3 cm),然后加入 3 mL菌液。接入无菌幼虫(15头/瓶),在 28±0.5℃,湿度为 70%~80%以及光周期 L:D=16:8 h的条件下进行饲养。每 2天更换一次含新鲜菌液的棉垫。每天观察 3次。实验重复 3次。
1.5 细菌的氨基酸、脂肪酸以及维生素 B3含量的检测
按照 1.4制备枯草芽孢杆菌、金黄色葡萄球菌、成团肠杆菌、大肠杆菌、奇异变形杆菌、香味类香味菌,连同家蝇幼虫以及麦麸在 110℃处理 10 h后,用凯氏定氮法、酸水解法以及气相 -质谱连用法分别测定总氮、各种氨基酸以及脂肪酸含量。利用 HPLC方法测定细菌和蛋黄的维生素 B3含量。
1.6 统计分析
幼虫生长时间、化蛹率、蛹重、成虫羽化率等数据均取平均值。所有数据均用 SAS软件包(ver10.0;SASinstitute,Cary,North Carolina,U.S.A)处理,p<0.05表示有差异,p<0.01有显著差异,p>0.05为无差异。
2 结果与分析
2.1 麦麸中细菌种类的鉴定
从麦麸中分离出的细菌,通过形态学、16S rRNA序列的扩增、测序以及将序列拼接后与 NCBI数据库比较,一共有 13种细菌,属于 7个目 9个科12个属:分别为金黄色葡萄球菌 Staphylococcus aureus、枯草芽孢杆菌 Bacillus subtilis、松鼠葡萄球菌Staphylococcus sciuri、成团肠杆菌 Pantoea agglomerans、聚团肠杆菌 Enterobacter agglomerans、大肠杆菌Escherichia coli、香味类香味菌 Myroides odoratimimus、奇异变性杆菌 Proteus mirabilis、醋酸钙不动杆菌 Acinetobacter calcoaceticus、藤黄八叠球菌Micrococcus luteus、嗜水汽单胞菌 Aeromonas hydrophila、铜绿假单胞菌 Pseudomonas aeruginosa和解糖肠球菌 Enterococcus saccharolyticus(表 1)。金黄色葡萄球菌、铜绿假单胞菌及大肠杆菌都是人们所熟知的重要人类条件致病菌。聚团肠杆菌又称聚团多源菌,该菌能引起人体呼吸系统、血液、肠道等发生感染。成团肠杆菌是一种符合肠杆菌定义的产类胡萝卜素的黄色菌群,可以引起人类发生败血症。藤黄八叠球菌为革兰氏阳性菌,是生乳和乳制品中常见的污染菌。醋酸钙不动杆菌主要分布在水体和土壤中,该菌粘附力极强,能引起人体皮肤、泌尿生殖系统以及脑部发生感染。枯草芽孢杆菌是革兰氏阳性需氧菌,作为 α-淀粉酶、中性蛋白酶以及角蛋白酶的重要生产菌而广泛应用于工业生产中。香味类香味菌属革兰染色阴性菌,可分解甘露醇,发酵糖的能力缓慢而微弱。奇异变形杆菌广泛存在于水、土壤腐败的有机物以及人和动物的肠道中,为条件致病菌,可引起败血症、创伤感染、膀胱炎、以及食物中毒等。嗜水气单胞菌为革兰氏阴性菌,普遍存在于淡水、污水、淤泥、土壤和人类粪便中。该菌也是一种条件致病菌,对水产动物、畜禽和人类均有致病性,是一种典型的人 -畜 -鱼共患病原菌,可引起多种水产动物的败血症和人类腹泻(Garrity,2008)。需要指出的是,不同产地或不同条件下加工处理的麦麸,其所含细菌的种类和数量也可能有较大不同。
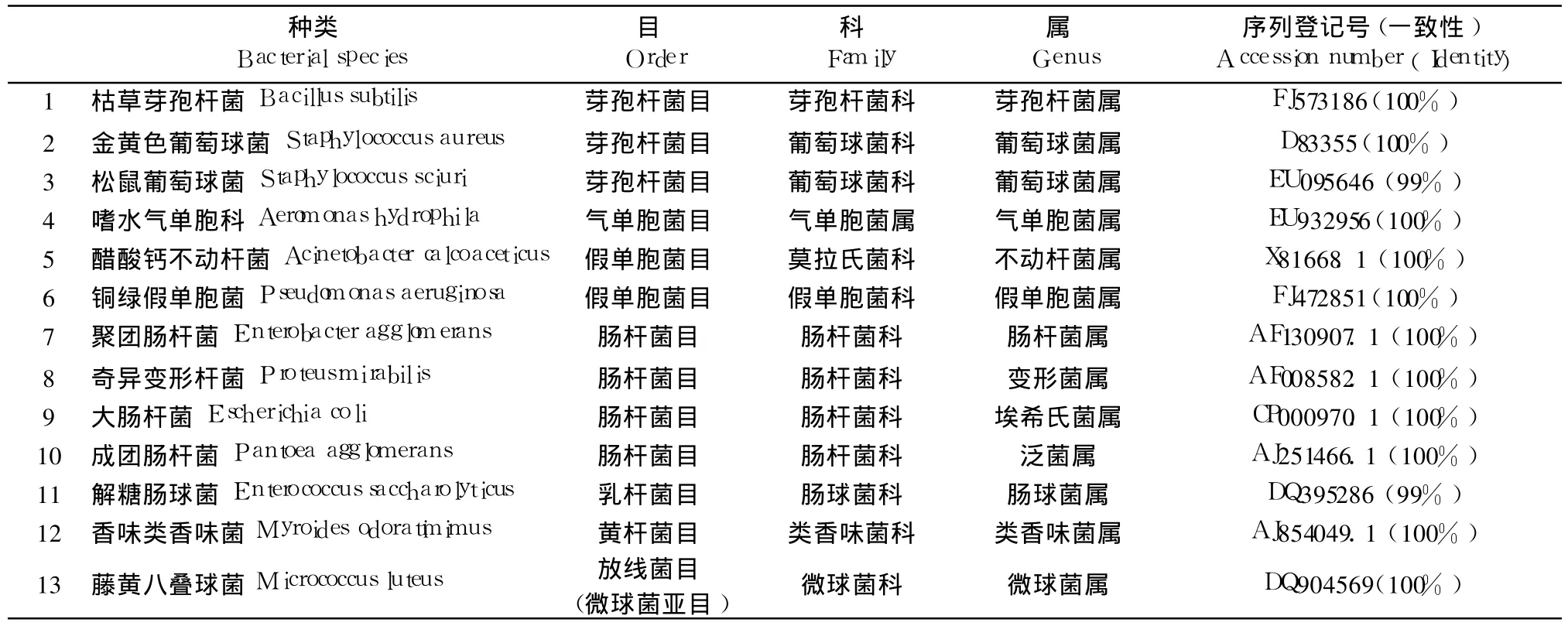
表 1 从麦麸中分离的细菌种类*Table 1 The bacterial species isolated from wheat bran
2.2 不同细菌在培养基中的生长速度以及 p H变化
在所测定的 12种细菌中,醋酸钙不动杆菌是生长最快的一种(表 2)。培养 16 h后,菌体平均生长量可达到 63.75±1.25 g/L。随后依次为藤黄八叠球菌、松鼠葡萄球菌、铜绿假单胞菌、嗜水汽单胞菌、聚团肠杆菌、成团肠杆菌、大肠杆菌、奇异变性杆菌、枯草芽孢杆菌和香味类香味菌。金黄色葡萄球菌则是生长得最慢的一种,培养 16 h后,菌体平均生长量仅为 8.40±0.17 g/L。大多数的细菌生长 16 h后,与对照组相比,培养基的pH值维持不变或者略高。碱性最强的是奇异变形杆菌,其培养基的 pH值能达到 8.23。铜绿假单胞菌和嗜水汽单胞菌在生长过程中会产酸,从而导致培养基呈酸性,后者培养 16 h后培养基的 pH值低至 5.52。从表 2可知,尽管在生长过程中各项指标有所不同,然而幼虫在分别接种这 12种细菌的培养基中均能完成整个生长发育周期。这一结果说明了从麦麸中分离出的细菌,尽管其生长量存在差异,且其在生长过程中对环境 pH值也有一定的影响,但这些变化均不会阻碍幼虫完成整个生长发育过程。此外,由于解糖肠球菌在这种培养基生长极其缓慢,因此没有测定该株细菌。
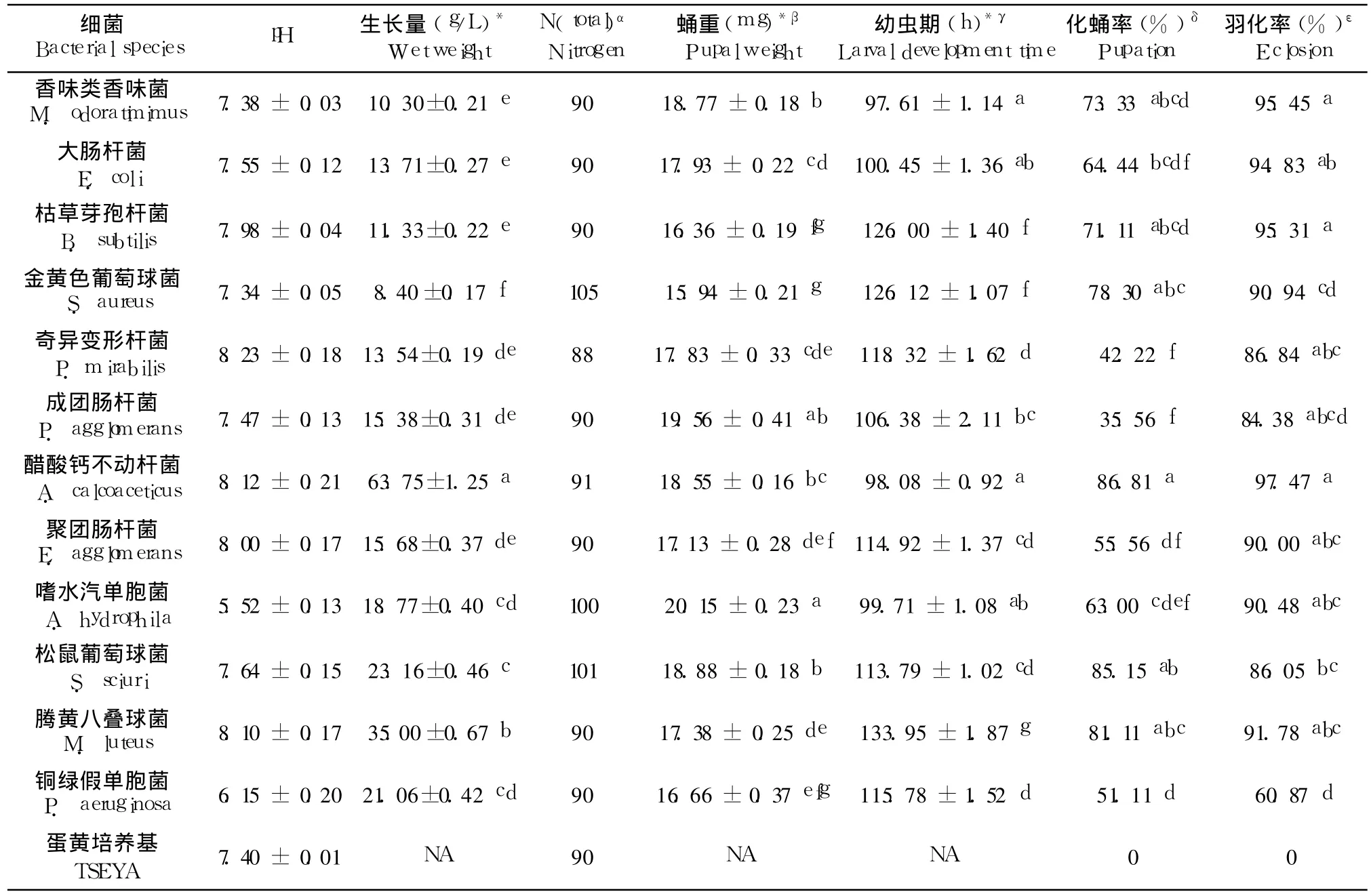
表 2 麦麸中不同细菌对家蝇幼虫生长发育的影响Table 2 Development of M.domestica larvae on trypticase soy egg yolk agar inoculated with different bacterial species isolated from wheat bran
2.3 家蝇幼虫在细菌 -TSEYA培养基中生长发育的情况
麦麸中分离出来的 12种细菌都能支持家蝇幼虫的生长发育,但其对幼虫历期、蛹重、化蛹率以及羽化率的影响是不一样的。在幼虫历期方面,幼虫在接种香味类香味菌的 TSEYA培养基中平均生长时间最短,仅需 97.61±1.14 h,而取得与此相近结果的有生长在接种醋酸钙不动杆菌、嗜水汽单胞菌及大肠杆菌 TSEYA培养基中的幼虫,它们的幼虫历期均显著短于接种其余 8种细菌的 TSEYA培养基中的幼虫(p<0.001)。而幼虫历期最长的是在接种藤黄八叠球菌的 TSEYA培养基中的幼虫,完成整个过程需要 133.95±1.87 h(表 2)。这一结果也说明,幼虫生长速度并不与细菌生长量呈正相关。在化蛹率方面,幼虫在接种醋酸钙不动杆菌和松鼠葡萄球菌的 TSEYA培养基中具有最高的平均化蛹率,分别达到 86.81%和 85.15%。奇异变形杆菌和成团肠杆菌对幼虫的生存有明显的影响,部分幼虫在3龄期间死亡,死虫通体发黑(资料没显示)。幼虫在接种这两种细菌的 TSEYA培养基中的平均化蛹率仅为 42.22%和 35.56%,显著低于其它 10种细菌(p<0.001)。在蛹重方面,从接种嗜水汽单胞菌的 TSEYA培养基中得到的蝇蛹平均重量达到20.15±0.23 mg,显著高于除成团肠杆菌以外的接种其它细菌 TSEYA培养基中得到的蝇蛹重量(p<0.001)。而幼虫在接种金黄色葡萄球菌的 TSEYA培养基中生长情况并不理想,其平均蛹重仅为15.94±0.21 mg。除铜绿假单胞菌外(羽化率仅为60.87%)(p<0.001),其余的细菌对成虫羽化不会造成明显的影响(羽化率在 84.33%~97.47%之间)。在对照组中,所有幼虫发育均不能超过 2龄,两周后全部死亡。
2.4 单纯细菌作为食物对家蝇幼虫生长发育的影响
在所有测试的细菌中,只有枯草芽孢杆菌、香味类香味菌、聚团肠杆菌及成团肠杆菌能支持幼虫顺利完成整个生长发育过程。幼虫以枯草芽孢杆菌作为食物,仅需 169.44±1.30 h就进入蛹期。而以香味类香味菌和成团肠杆菌为食物的幼虫生长需要的时间较长,进入蛹期的时间分别为 210.24±2.08和 204.24±1.67 h(表 3)。食用聚团肠杆菌、成团肠杆菌及香味类香味菌的幼虫化蛹后,其蛹重均显著优于以枯草芽孢杆菌为食物的幼虫化蛹后的蛹重(p<0.001),然而在成虫羽化率方面,却显著低于后者(p<0.001)。而以这 4种细菌作为食物,其幼虫在存活率差异不显著。此外,尽管醋酸钙不动杆菌和松鼠葡萄球菌也能支持大部分幼虫生长发育到 3龄,但均在幼虫化蛹前全部死亡。其余细菌组及对照组的幼虫在 24~36 h内全部死亡。
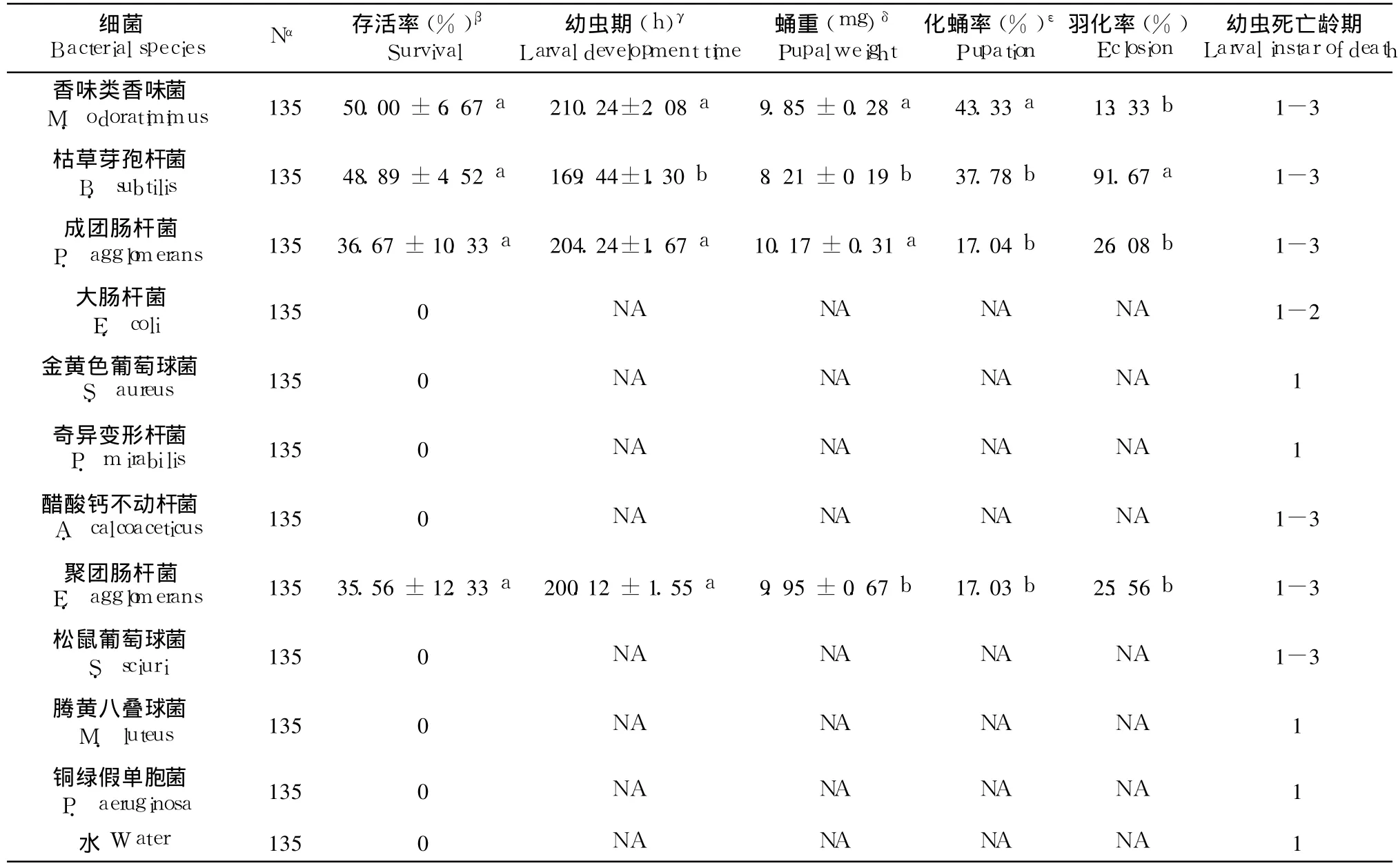
表 3 单纯一种细菌对家蝇幼虫生长发育的影响Table 3 The development of M.domestica larvae on different bacterial cultures
上述这些结果表明,部分细菌可以为家蝇幼虫提供其生长发育过程中所需要的全部营养,包括维生素、蛋白质以及必需脂肪酸,但细菌中所含营养成分的差异对幼虫生长发育的影响也有所不同。蛹重是反映幼虫生长发育是否良好的重要指标,从表 3可知,香味类香味菌、聚团肠杆菌以及成团肠杆菌中所含有的营养物质较枯草芽孢杆菌的更能适合家蝇幼虫的生长。此外,通过与表 2中蛹重指标比较后发现,以细菌作为唯一食物的幼虫,化蛹后的蛹重远小于生长在接种相同细菌的 TSEYA培养基中幼虫化蛹后的蛹重,这一结果表明细菌分解生活环境中的有机物质及其提供的各种营养对家蝇幼虫的生长发育也具有十分重要的作用。
2.5 细菌的氨基酸、脂肪酸以及维生素 B3含量的检测
为了了解不同细菌之间营养成分的差异,本研究根据前面实验结果挑选 6种细菌并对其氨基酸、脂肪酸以及维生素 B3含量进行了检测。据报道,家蝇幼虫在生长过程中需要多种 B族维生素(郎跃深,2009)。在 TSEYA培养基中,卵黄可以提供多种 B族维生素,只有维生素 B3的含量极低(100 ug/kg)(Food Standards Agency,2002),远少于家蝇幼虫生长所需(Levinson,1960)。本研究所挑选的细菌则均能提供大量的维生素 B3(0.105~1.08 g/kg),可以满足幼虫新陈代谢所需(表 4)。
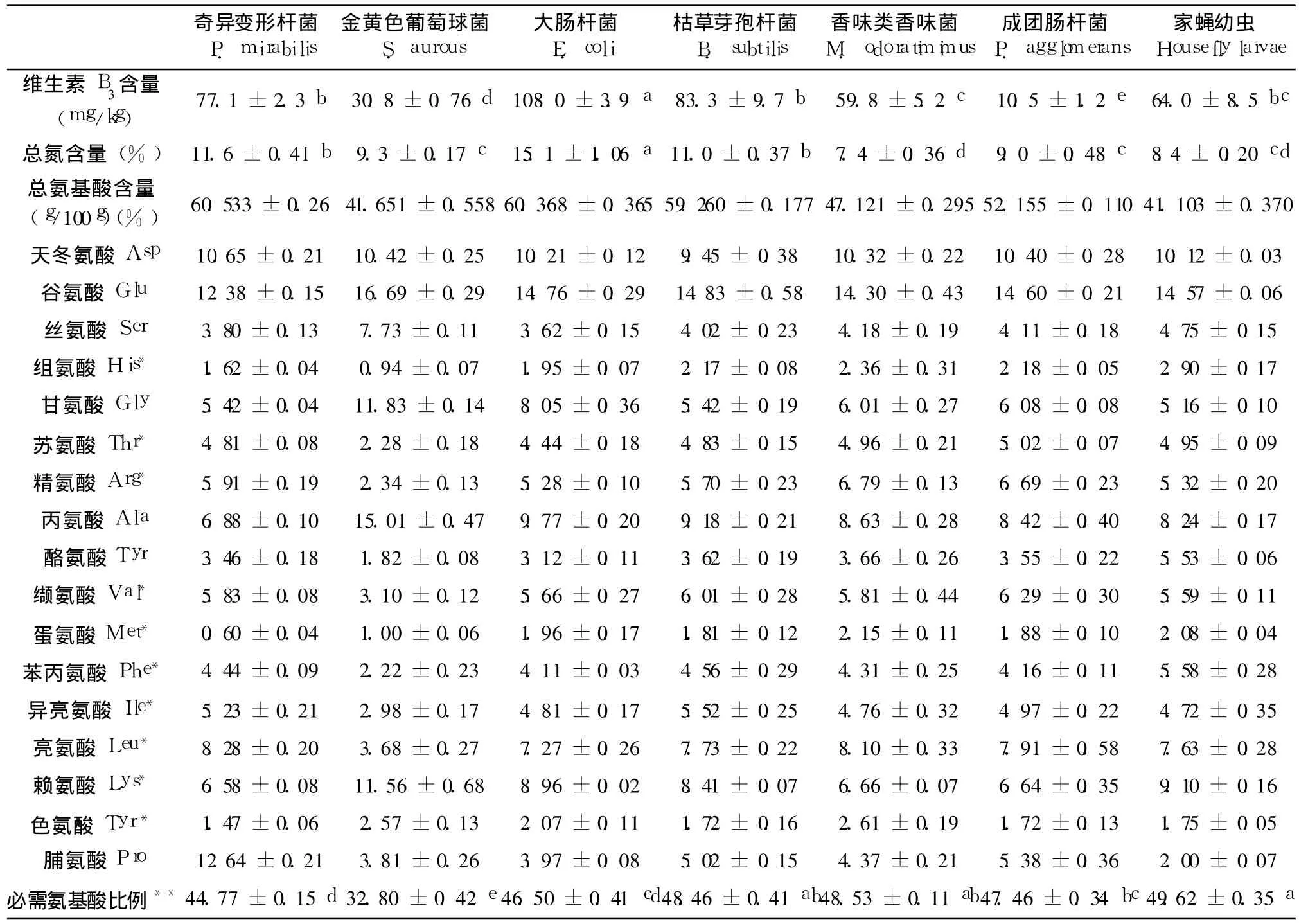
表 4 各种细菌和家蝇幼虫中总氮、氨基酸以及维生素 B3含量的测定Table 4 The amino acid composition,vitamin B3 and total nitrogen of bacterial species and housefly larvae
6种细菌当中,大肠杆菌含总氮量最高,平均达到 15.1±1.06%,其次是奇异变形杆菌和枯草芽孢杆菌,香味类香味菌含总氮量最低,仅为 7.4±0.36%。在氨基酸总量方面,大肠杆菌以及奇异变形杆菌含量最高,每百克样品分别含有为 60.533±0.26 g和 60.368±0.365 g氨基酸,而金黄色葡萄球菌含量最低,只有 41.651±0.558 g。由于昆虫必须从食物中摄取包括组氨酸、精氨酸、苏氨酸、缬氨酸、亮氨酸、异亮氨酸、色氨酸、赖氨酸、甲硫氨酸和苯丙氨酸在内 10种必需氨基酸以维持其生长发育的需要(Genc,2006),因此,本研究进一步比较了这些细菌中含有昆虫必需氨基酸的含量与总氨基酸之间的比例(表 4)。结果显示,比例最高的是香味类香味菌和枯草芽孢杆菌,它们与幼虫之间的比例没有显著差异,但显著高于其它细菌(p<0.01)。比例最低的是金黄色葡萄球菌,仅为 32.80±0.42%。统计分析结果表明,细菌中含有的昆虫必需氨基酸含量与总氨基酸含量之间的比例与蛹重呈正相关(r=0.8324;F=14.90,t=3.86,p=0.031),但与幼虫生长时间(r=0.7355;F=8.344,t=2.88,p=0.063)以及化蛹率(r=0.2265;F=0.8782,t=0.937,p=0.418)没有相关性,这一结果暗示,能支持幼虫生长发育的细菌,其含有的昆虫必需氨基酸含量与幼虫的生长质量可能有关,但与其发育成功率(successful development)没有关系。
家蝇幼虫可以通过氧化食物中的脂肪酸来为其生长发育提供能量,此外,食物中的多种脂肪酸对昆虫成虫羽化以及提供能量方面具有显著作用(郎跃深,2009)。在总脂肪方面,大肠杆菌含量最高,达到 168 mg/g(wet weight),其次是成团肠杆菌和香味类香味菌,分别为115.8 mg/g和103.4 mg/g;含量最少的还是金黄色葡萄球,仅为 92.6 mg/g。在饱和脂肪酸方面,金黄色葡萄球菌具有最高的含量,达到 76.38%,其次是大肠杆菌和枯草芽孢杆菌,最少的是香味类香味菌,仅为40.34%。家蝇幼虫体内含有大量的不饱和脂肪酸,达到60.83%,其中,C16:1(n-7)、C18:1(n-9)以及 C18:2(n-6)含量最高。香味类香味菌以及成团肠杆菌有着相似的含量,分别为 56.79%和 51.9%,也含有大量的 C16:1(n-7)和 C18:1(n-9)。所有 6种细菌均能提供亚麻酸(0.071% ~1.68%),一种昆虫必需脂肪酸。尽管枯草芽孢杆菌含有极少的不饱和脂肪酸,仅占总磷脂值的 0.4%,然而其含有大量的支链脂肪酸(42.16%),且种类和所占的比例与幼虫体内的相当(表 5)。
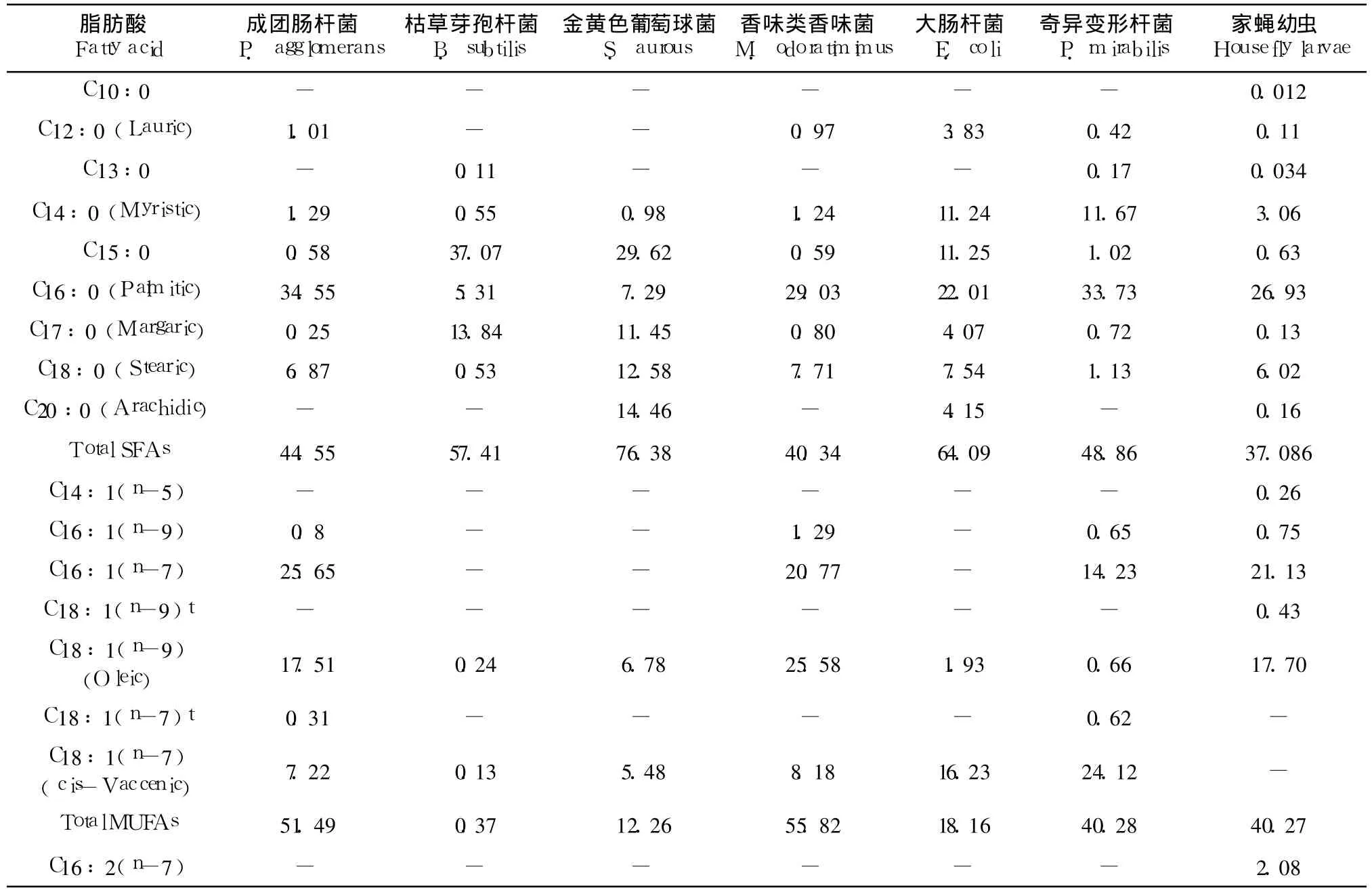
表 5 6种细菌中不同脂肪酸的含量Table 5 Fatty acid percentage composition of six strain bacterium from wheat bran*
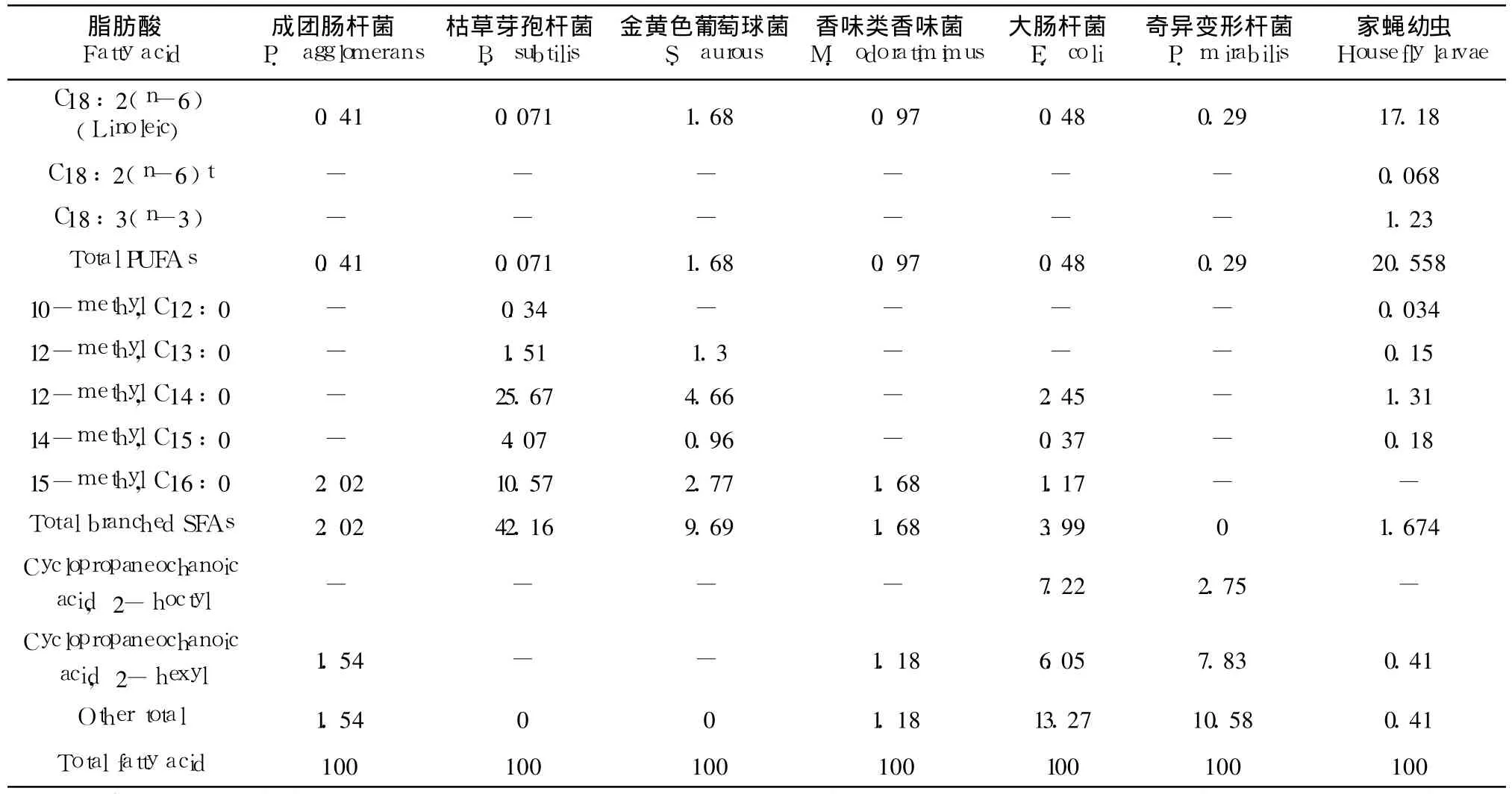
(续上表)
3 结论与讨论
细菌对家蝇幼虫的生长发育起着关键性的作用,但并不是所有的细菌都能支持蝇科幼虫的生长发育。Lysyk等(1999)在 TSEYA培养基中测试了 5种细菌对厩蝇幼虫生长发育的影响,结果发现幼虫在接种 Serratia marcesecns以及 Aeromonas sp.的培养基中不能生长,而这两种细菌被证明是昆虫条件致病菌。Zurek等(2000)在 TSEYA培养基中测试了 24种从火鸡粪以及青贮玉米(corn silage)中分离的细菌对家蝇幼虫影响,幼虫在接种其中 8种细菌的培养基不能生长。此外,一些杀虫微生物,如苏云金杆菌 Bacillus thuringiensis以及白僵菌 Beauveria bassiana等都对家蝇幼虫有毒性作用。在本研究中,尽管幼虫在所有接种细菌的培养基中均能完成各个生长发育阶段,但在接种成团肠杆菌和奇异变形杆菌的 TSEYA培养基中死亡率较高,其中的原因未明。这两种细菌在TSEYA培养基中均生长正常,有可能是由于这两种细菌能产生一些对幼虫生长有害的物质(如成团肠杆菌能表达几丁质酶)所致(Garrity,2008)。
到目前为止,尚未明确细菌影响家蝇幼虫生长发育的机理。由于家蝇幼虫主要通过氧化食物中的氨基酸和脂肪酸来满足其能量的需要(李绍文等,1988),而无菌幼虫难以在没有接种细菌的TSEYA培养基中正常生长发育,且单纯细菌就可以作为幼虫的食物。这些研究结果暗示,细菌中不同氨基酸、脂肪酸以及维生素的含量可能是影响幼虫生长发育的主要因素。TSEYA培养基只含有极其微量的 vitamin B1和 vitamin B3(烟酸),而后者作为辅酶主要参与生物体新陈代谢以及脂肪氧化产能(电子链传递)的过程,具有十分重要的作用(Genc,2006),本研究中选取的 6种细菌均能提供大量的烟酸,完全可以满足幼虫生长的需要。
细菌中 10种昆虫必需氨基酸含量对幼虫的生长质量以及蛹重有着重要影响。其中原因可能是:一方面,家蝇幼虫肠道中主要的蛋白水解酶为氨基肽酶(aminopeptidase),可将蛋白质或者多肽水解成氨基酸(Blahovec et al.,2006);另一方面,由于细菌的大小差别不大,在单位摄取量相当的情况下,必需氨基酸比例越高,幼虫能够利用的营养就越多,因而生长加快以及蛹重增加。幼虫在接种枯草芽孢杆菌的 TSEYA培养基中生长的时间以及蛹重均不理想,其原因可能是由于枯草芽孢杆菌能分泌多种蛋白酶,其中一些蛋白酶甚至能水解角蛋白(Gupta and Ramnani,2006;Cai et al.,2008),而这些蛋白酶可能影响幼虫消化系统。我们曾经利用蛋白酶 K(proteinase K)消化麦麸后再接种幼虫,结果发现幼虫出现行动迟缓、发育缓慢甚至死亡的现象(资料未显示)。而利用单纯细菌作为食物的实验结果说明,枯草芽孢杆菌是可以支持幼虫完成整个生长发育过程的。
蛹重的大小与家蝇成虫的羽化率没有显著的相关性(Zurek et al.,2000),相反,食物中多不饱和脂肪酸以及支链饱和脂肪酸的含量对满足宿主能量的需求以及虫体器官的形成却有着关键性的作用。Dadd(1980)发现,食物中多不饱和脂肪酸种类(如 γ-亚麻酸、花生四烯酸等)对库蚊 Culex pipiens成虫的飞行能力起着决定性的作用;Wang等(2006)证实南美大闪蝶 Morpho peleides幼虫和成虫体内的多不饱和脂肪酸主要来源于食物,并能满足成虫变态过程中能量的需要以及增加飞行的能力。在本研究中,不饱和脂肪酸含量最高的香味类香味菌和成团肠杆菌对家蝇成虫的羽化率显著低于含量最低的枯草芽孢杆菌(表 3),但前者的幼虫化蛹后,大部分都在蛹期死亡。即使部分变态为成虫,并用额囊顶破蛹壳,但不能离开蛹壳顺利出来,最终死亡(资料未显示)。这一现象暗示细菌中营养成分含量的不同会影响蛹期组织的发育过程以及成虫能量的需求。我们推测细菌中不饱和脂肪酸含量的多少可能对家蝇成虫羽化率影响不大,但支链脂肪酸的种类及含量对家蝇幼虫变态过程中组织形成及成虫羽化可能有更为重要的影响。尽管这一推测尚需要实验证明,但细菌中支链脂肪酸的重要作用在其它动物中早已被发现。Allison(1962)及 Miura等(1980)就证实了反刍动物瘤胃中的细菌含有大量的支链脂肪酸,而这些脂肪酸可以被宿主吸收并参与构成宿主器官及奶类脂肪。
References)
Acinas SG,Klepac-Ceraj V,Hunt DE,Pharino C,Ceraj I,Distel DL,Polz F,2004.Fine-scale phyogenetic architecture of a complex bacterial community.Nature,430:551-554.
Allison MJ,Bryant MP,Katz I,Keeney M,1962.Metabolic function of branched-chain volatile fatty acids,growth factors for Ruminococci II.Biosynthesis of higher branched-chain fatty acids and aldehydes.J.Bacteriol.,83:1084-1093.
Bergmann ED,Levinson ZH,1954.Steroid requirements of housefly larvae.Nature,173:211-212.
Blahovec J,Kostecka Z,Kocisova A,2006.Peptidolytic enzymes in different larval stadium of housefly Musca domestica.Veterinarni Medicina,51(4):139-144.
Brookes MJ,Fraenkel G,1958.The nutrition of the larva of the housefly,Musca domestica L.Physiol.Zool.,31:208-223.
Cai C,Chen J,Qi J,Yin Y,Zheng X,2008.Purification and characterization of keratinase from a new Bacillus subtilis strain.J.Zhejiang Univ.Sci.B,9(9):713-720.
Chang JG,Wang MY,1958.Nutritional requirements of the common housefly,Musca domestica vicina Macy.Nature,181:566.
Dadd RH,1980.Essential Fatty Acids for the Mosquito Culex pipiens.The Journal of Nutrition,110(6):1152-1160.
Food Standards Agency,2002.Mc Cance and Widdowson's The Composition of Foods.(sixth summary edition).Cambridge:Royal Society of Chemistry Press.http://nutritionandeggs.co.uk/eggs_nutrition/nutrition1.html
Garcia LS,Procop GW,Roberts GD,Thomson RB,1998.Overview of conventional methods for bacterial identification.In:Forbes BA,Salun DF,Weissfeld AS,eds.Bailey and Scott's Diagnostic Microbiology.Mosby Elsevier Health Science Press,167-181.
Garrity GM,2008.Bergey's manual of Systematic Bacteriology.Springer Press,1-281.
Genc H,2006.General principles of insect nutritional ecology.Trakya Univ.J.Sci.,7(1):53-57.
Gerberich JB,1948.Rearing house flies on common bacteriological media.J.Econ.Entomol.,141:125-126.
Graczyk TK,Knight R,Gilman RH,Cranfield MR,2001.The role of non-biting flies in the epidemiology of human infectious diseases.Microb.Infect.,3:231-235.
Greenberg B,1954.A method for the sterile culture of house fly larvae,Musca domestica L.Can.Entomol.,86:527-528.
Grubel P,Hoffman JS,Chong FK,Burstein NE,Mepani C,Cave DR,1997.Vector potential of houseflies(Diptera:Muscidae)for Helicobacter pylori.J.Clin.Microbiol.,35:1300-1303.
Gupta R,Ramnani P,2006.Microbial keratinases and their prospective applications:an overview.Appl.Microbiol.Biotechnol.,70:21-33.
Lang YS,2009.The Cultural Technology and Application of Housefly Larvae.Beijing Science and Technology Literature Press,15-42.[郎跃深,2009.蝇蛆养殖技术与应用.北京:科学技术文献出版社,15-42.]
Levinson ZH,1960.Food of housefly larvae.Nature,188:427-428.
Li SW,Wang MS,Zeng YH,1988.Biochemistry of Insects.(Roskstein M,1978.New York:Academic Press).Beijing:Science Press,1-5.[李绍文,王孟淑,曾耀辉,1988.昆虫生物化学(罗克斯坦,1978.学术出版社).北京:科学出版社,1-5.]
Lysyk TJ,Kalischuk-Tymensen L,Selinger LB,Lancaster RC,Wever L,Cheng KJ,1999.Rearing stable fly larvae(Diptera:Muscidae)on an egg yolk medium.J.Med.Entomol.,36(3):382-388.
Miura H,Horiguchi M,Mutsumoto T,1980.Nutritional interdependence among rumen bacteria,Bacteroides amylophilus,Megasphaera elsdenii and Ruminococcus albus.Appl.Environ.Microbiol.,40(2):194-300.
Moon RD,2002.Muscid flies(Muscidae).In:Mullen G,Durden L,eds.Medical and Veterinary Entomology.Elsevier Science Press,279-301.
Moon RD,Hinton JL,O'Rourke SD,Schmidt DR,2001.Nutritional value of fresh and composted poultry manure for house fly(Diptera:Muscidae)Larvae.J.Econ.Entomol.,94:1308-1317.
Nation JL,2008.Insect Physiology and Biochemistry.CRC Press,11-320.
Peck GW,Walton WE,2006.Effect of bacterial quality and density on growth and whole body stoichiometry of Culex quinquefasciatus and Culex tarsalis(Diptera:Culicidae).J.Med.Entomol.,43(1):25-33.
Peng Y,Zhong CZ,Zong LB,Lei CL,1996.Studies on utilization of theresidual wheatbran in housefly(Musca domestica Linnaeus)larvae rearing.Journal of Hubei University(Natural Science),18(4):320-323.[彭宇,钟昌珍,宗良炳,雷朝亮,1996.家蝇幼虫剩余饲料的利用研究.湖北大学学报(自然科学版),18(4):320-323]
Richardson HH,1932.An efficient medium for rearing houseflies throughout the year.Science,14:350-351.
Rochon K,Lysyk TJ,Selinger LB,2004.Presistence of Escherichia coli in immature house fly and stable fly(Diptera:Muscidae)in relation to larval growth and survival.J.Med.Entomol.,41(6):1082-1089.
Schmidtmann ET,Martin PAW,1992.Relationship between selected bacteria and the growth of immature house flies,Musca domestica,in an axenic test system.J.Med.Entomol.,29(2):232-235.
Wang W,AhrnéS,Jeppsson B,Molin G,2005.Comparsion of bacterial diversityalong the human intestinal tract by direct cloning and sequencing of 16S rRNA genes.FEMS Microbiology Ecology,54:219-231.
Watson DW,Martin PAW,Schmidtmann ET,1993.Egg yolk and bacteria growth medium for Musca domestica(Diptera:Muscidae).J.Med.Entomol.,30(4):820-823.
Zimmerman JJ,Berry WJ,Beran GW,Murphy DP,1989.Influence of temperature and age on recovery of pseudorabies virus form houseflies(Musca domestica).Am.J.Vet.Res.,50:1471-1474.
Zurek L,Denning SS,Schal C,Watson DW,2001.Vector competence of Musca domestica(Diptera:Muscidae)for Yersinia pseudotuberculosis.J.Med.Entomol.,38:333-335.
Zurek L,Schal C,Watson DW,2000.Diversity and contribution of the intestinal bacterial community to the development of Musca domestica(Diptera:Muscidae)larvae.J.Med.Entomol.,37(6):924-928.
