氟苯尼考肺靶向明胶微球制备方法的试验
2010-11-22冯华兵杜继红葛代兴杨秀玉
刘 澜,田 玲,冯华兵,杜继红,葛 冰,葛代兴,杨秀玉
(1.北京大北农动物保健技术研究中心,北京 怀柔 101407;2.北京市农业局,北京 海淀100029;3.北京市兽药饲料监察所,北京 海淀100107;4.中国兽医药品监察所,北京 海淀100081)
氟苯尼考(FFC)是动物专用广谱抗菌药,临床用于预防和治疗畜禽的各种细菌感染,但常规制剂往往治疗效率较低[1]。肺靶向氟苯尼考明胶微球是指将氟苯尼考分散在明胶中形成的微球状分散体系,它可通过控制明胶微球的球径范围,将药物最大限度地运送到肺部组织,使药物在肺部浓集超出传统制剂的数倍乃至数百倍,以达到靶向治疗作用。近年来,国内外学者[2-8]研究表明,明胶微球粒径在5~30μm之间,微球静脉注射后经血液循环到达肺部,可被分布在肺组织的网状内皮系统吞噬或被肺部毛细血管机械性摄取,而呈现良好的肺靶向性。本试验以明胶为载体,采用两步法制备了氟苯尼考肺靶向明胶微球(florfenicol gelatin microspheres,FFC-GMS),并通过单因素试验、均匀试验、正交试验对影响微球粒径、形态等的因素进行了考察,优化处方、工艺,为肺靶向氟苯尼考明胶微球的制备提供科学依据。
1 材料
1.1 仪器 扫描电子显微镜(S-3400N,日本HITACHI);DSC扫描仪(diamond 6,PE);激光粒度分布仪(2000,马尔文);高效液相色谱仪(Waters2487,美国 Waters);恒速数显搅拌机(JHS-2/60,杭州仪表电机有限公司);数显恒温磁力搅拌器(07HWS-1,杭州仪表电机有限公司);超声波清洗器(KQ5200,昆山市超声仪器有限公司);生物显微镜(XSP-C203,重庆光学仪器有限公司);真空干燥箱(DZ-1BC,天津泰斯特)。
1.2 试验药品与试剂 氟苯尼考购自浙江海翔药业股份有限公司(批号:P048-2008243);氟苯尼考对照品购自中国兽医药品监察所(批号:K0300801,含量:99.5%);明胶、液体石蜡、Span-80、Tween-80、石油醚、甲醛、异丙醇均购自北京化学试剂公司(化学纯);胃蛋白酶购自北京化学试剂公司。
2 方法与结果
2.1 空白明胶微球(gelatin microspheres,GMS)的制备 采用乳化交联法制备空白明胶微球[3],以明胶水溶液为分散相,液体石蜡为连续相,加入适宜的乳化剂,机械搅拌得稳定乳剂(w/o),然后加入异丙醇脱水再加入甲醛或戊二醛交联固化制成明胶微球。
2.1.1 油相、乳化剂的选择 根据相关文献[6,9],选择以液体石蜡为油相,考察以Tween-80、Span-80或两者的混合物作为乳化剂时制得的乳剂的稳定性,从而进行乳化剂的筛选,结果见表1。结果表明以Tween-80和Span-80(w/w为1∶1)为混合乳化剂效果最好。

表1 乳化剂对乳化效果的影响
2.1.2 固化条件的选择 先将10%明胶溶液分散于液体石蜡中,机械搅拌,尝试用甲醛或戊二醛、异丙醇固化制得明胶微球,通过显微镜观察微球的外观形态。通过预试验,甲醛和戊二醛的固化效果无显著性差别,正式试验我们选择以甲醛和异丙醇作为固化剂,固化时间分别为1 h,考察不同的甲醛、异丙醇投料量对微球形态的影响。结果见表2。随着甲醛和异丙醇投料量的增多,得到的球形颗粒增多,粘连减少,流动性增强,但是增加到一定程度后,这种改变趋势减弱,综合考虑工艺、成本、有机溶剂的残留等因素,选择以10 mL甲醛和20 mL异丙醇为固化剂。
2.1.3 GMS制备工艺的优化 综合考察影响微球形成的5因素(明胶浓度、油相体积、乳化剂用量、乳化温度、搅拌速率),对其进行5因素4水平的均匀试验。均匀试验设计详见表3。通过光学显微镜直接观察GMS的均匀性、粒径范围、形状与粘连程度,结果发现编号2、编号3较好,但仍有粘连且形态不完美。

表2 甲醛和异丙醇对微球形态的影响

表3 均匀试验设计
根据均匀试验结果结合相关文献[4,10]确定乳化温度为60℃。进一步采用4因素3水平的正交试验,将GMS的平均粒径(S1)、粒径分布均匀程度(S2)、不粘连程度(S3)作为评价指标,分别评分。每批评价500个微球,且对结果进行综合评分S(S=S1+S1-S3),S愈高,微球的质量越好,详见表4。从表4中可以看出编号6总分最高。综合分析确定GMS最佳制备工艺为:明胶浓度10%,油相体积为55mL,乳化剂用量为0.4g,乳化温度为60℃,搅拌速率为1000r/min。
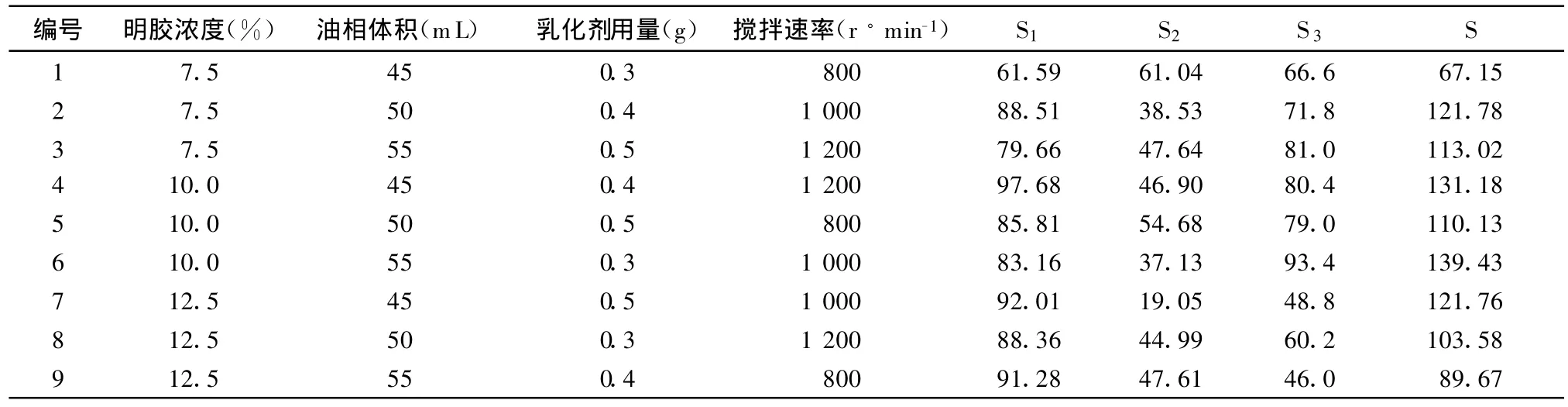
表4 正交试验设计
2.1.4 GMS的制备工艺 将已充分溶胀的10%明胶溶液8mL滴入含有0.4g乳化剂的55mL液体石蜡中,在 60℃水浴中搅拌乳化15min,转速1000r/min。冰水浴迅速冷却,以细流状加入20mL异丙醇搅拌1h,再加入甲醛10mL,搅拌交联固化1h,抽滤。用异丙醇-乙醚洗涤,至洗尽甲醛,用石油醚洗去微球表面的液体石蜡,真空干燥。过200目筛,得类白色微球粉末。用光散色法测定微球平均粒径为10.23μm,粒径范围5.0~30μm的数目占总数的90.8%,结果见图1。
2.2 FFC-GMS制备工艺的确定 采用两步法制备氟苯尼考明胶微球,将氟苯尼考溶解于30%二甲基甲酰胺水溶液中,加入GMS,静置浸入2h,抽滤,用蒸馏水洗净二甲基甲酰胺,真空干燥,过200目筛,得类白色微球粉末,形态见图2。用光散色法测定微球平均粒径为10.57μm,粒径范围5.0~30μm的数目占总数的88.3%,达到肺部靶向的设计要求。

图1 明胶微球的粒径分布
2.3 差示扫描量热法验证FFC-GMS的形成 操作条件:扫描温度30℃~350℃,扫描速度20deg◦min-1,分别测得FFC、GMS与FFC-GMS的DSC曲线。结果见图3。从曲线上看出FFC在270℃左右有特征峰,GMS在 300℃左右有特征吸收峰,但FFC-GMS基本上无FFC或GMS的特征吸收峰,而有其本身245℃左右有特征峰,说明确实形成了FFC-GMS。

图2 氟苯尼考明胶微球

图3 差示扫描量热法曲线
2.4 FFC-GMS中载药量的测定 称取一定量微球,置于烧杯中,加入20 mL蒸馏水,加入0.2 g胃蛋白酶,用稀盐酸调溶液p H值至3.5,而后将烧杯置于40℃±3℃水溶液中搅拌水解3 h,破坏明胶微球使氟苯尼考释放[11];再加入20 mL N,N-二甲基甲酰胺,继续搅拌30 min后用0.22 m的微孔滤膜过滤,滤液用N,N-二甲基甲酰胺定容至50 mL。
2.4.1 回收率 精密称取20 mg干燥空白明胶微球,分别加入氟苯尼考 1 mg、2.5 mg、5 mg,同上操作后,精密量取10μL滤注入液相色谱仪,记录色谱图。另取氟苯尼考对照品适量,加入流动相制成浓度为50μg/mL的溶液,同法测定。按外标法以峰面积计算氟苯尼考浓度。色谱柱:MSC-18;流动相:乙腈-水-冰醋酸(500∶985∶15);检测波长为224 nm。测得低、中、高不同加入量的平均回收率为102.1%(n=5)。
2.4.2 氟苯尼考药物含量的测定 精密称取干燥微球20 mg,同上操作后,精密量取10μL滤注入液相色谱仪,记录色谱图。另取氟苯尼考对照品适量,加入流动相制成浓度为50μg/mL的溶液,同法测定。按外标法以峰面积计算氟苯尼考浓度。色谱柱:MSC-18;流动相:乙腈-水-冰醋酸(500∶985∶15);检测波长为224 nm。得FFC-GMS中载药量为121.2 mg/g(n=3)。
2.5 FFC-GMS药物包封率的测定 精密称取干燥样品20 mg,用少量蒸馏水涡旋洗涤3次后弃去洗液,残余微球70℃烘干。按2.4项下方法测定水洗后微球中的氟苯尼考含量,并计算包封率,得FFC-GMS药物包封率为90.31%。

2.6 FFC-GMS稳定性考察 将FFC-GMS密封于西林瓶内,分别置于 4℃,室温(20℃±5℃)和40℃相对湿度75%的条件下3个月,每月检查,其外观、形态、载药量几乎无变化,结果见表5。说明FFC-GMS稳定性较好。
3 讨论
3.1 GMS的制备工艺 本试验以明胶为载体,采用乳化交联法制备了肺靶向明胶微球。根据相关文献及单因素考察确定了油相、乳化剂和固化条件,运用均匀设计和正交设计的试验方法考察了影响成球的五个因素包括明胶浓度、油相的体积、乳化剂的用量、乳化温度和搅拌速率,并通过方差分析发现明胶浓度对成球效果的影响最显著,其次为乳化剂用量、搅拌速率、连续相体积、乳化温度,进一步优化并确定了制备工艺。用该工艺制备的微球外观形态较好,平均粒径为10.23μm,粒径范围5.0μm~30 μm的数目占总数的90.8%。
3.2 FFC-GMS的制备工艺 氟苯尼考在水中的溶解性较差,如直接采用乳化交联法制备微球,微球的含药量较低。本试验采用两步法,以30%二甲基甲酰水溶液为溶剂不仅能够较好的溶解氟苯尼考,而且能够很容易的浸润明胶微球,且溶液可反复用于浸泡,提高药物收率并最终得到载药量较高的氟苯尼考肺靶向明胶微球。
3.3 FFC-GMS的体外评价 影响微球肺靶向的主要因素是微球粒径的大小,国内外学者研究证实5~30μm的微球静脉注射后在肺部蓄积。本试验方法制得的FFC-GMS的平均粒径为10.57μm,粒径范围5.0~30μm的数目占总数的88.3%,达到肺部靶向的设计要求。对氟苯尼考肺靶向明胶微球载药量和包封率进行测定,结果表明,本试验方法制备的氟苯尼考肺靶向明胶微球载药量较高,平均载药量为121.2 mg/g;采用水洗法测定药物的包封率达为90.31%,表明微球的制备工艺较好。

表5 稳定性试验结果
