实验性脾虚大鼠小肠结构与免疫功能的变化
2010-11-22朱晓宇刘凤华许剑琴胡艳欣
尹 朋,赵 烨,朱晓宇,王 宁,刘凤华,许剑琴,胡艳欣
(1.中国农业大学动物医学院,北京海淀100193;2.北京农学院动物科技系,北京昌平102206)
传统中医理论认为,脾为后天之本,主运化,为气血生化之源,现代研究认为,脾(胃)功能涉及现代医学的消化吸收、能量代谢、神经、内分泌和免疫等多系统的功能。养殖生产中部分动物常因先天禀赋不足、群体排序低下、消化吸收功能障碍、免疫机能低下等处于亚健康状态,这部分动物约占健康群体的5%~10%,其整体素质难以跟上全群平均水平,表现为时常腹泻,生产性能、机体抗病能力下降,中兽医辨证多属脾虚。中兽医脾的防卫功能与现代兽医学中的免疫系统有相似之处,与黏膜免疫有着某种内在联系。脾虚多有肠道黏膜免疫系统改变。研究表明,脾虚泄泻的发病机制与免疫调节有关,而消化系统的免疫作用主要通过小肠的免疫来实现的[1]。本试验采用利血平复制大鼠脾虚模型,观察十二指肠、空肠、回肠组织结构的改变,肠黏膜上皮内淋巴细胞及杯状细胞的变化以及 TLR2的表达情况,揭示脾虚大鼠小肠黏膜结构及免疫功能的变化规律,为中药调控脾虚,开发抗病促壮中药添加剂奠定理论依据。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠12只,体重250 g±20 g,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂及仪器设备 利血平(广东邦民制药厂有限公司),免疫组化用 anti-TLR2抗体(bs-1019R,Beijing Biosynthesis Biotechnology Co.,LTD,China),免疫组化 SABC试剂盒(KGSP04 histostain-plus kit,Key Gen Biotech,Nanjing,China),DAB显色剂(Vector Laboratories);石蜡切片机(Leica RM 2145),显微镜(Leica Microsystems,Wetzlar,Germany),Image-Pro Plus 2.1分析系统(Media Cybernetics公司),Motic图像分析系统。
1.3 脾虚大鼠模型复制 试验大鼠分为对照组和脾虚组,每组6只。试验前禁食12~16 h,自由饮水。脾虚组每天肌肉注射利血平0.5 mg/kg体重,对照组每天肌肉注射生理盐水 0.5 mL/只,连续7 d。观测大鼠体重的变化及临床表现。
1.4 取材 造模第8天,剖杀各组试验大鼠,取十二指肠、空肠、回肠中段,用冷生理盐水冲洗干净,立即置于4%甲醛溶液中固定。常规石蜡包埋、连续切片(3μm),备用。
1.5 指标检测及方法 (1)绒毛长度及黏膜厚度的测定:H.E.染色、光镜下观察比较对照组与脾虚组大鼠肠黏膜形态结构,并应用Image-Pro Plus 5.1分析系统,测量十二指肠、空肠和回肠的绒毛长度、肠黏膜厚度,脾虚组和对照组分别选取十二指肠、空肠和回肠组织切片各6张,每张切片测量5个最长的肠绒毛长度,进行统计,取其平均值。(2)小肠上皮内淋巴细胞和杯状细胞的测定:H.E.染色,显微镜下统计100个柱状上皮细胞内淋巴细胞和杯状细胞数量,每只大鼠分别统计十二指肠、空肠和回肠各3张切片,求各组各肠段的平均值。(3)肠道TLR2表达量的测定:SABC免疫组织化学方法及Motic病理图象分析系统,显微镜下统计肠道横断面固有层及绒毛顶端内单位面积TLR2(阳性物面积/视场总面积×100%)表达情况并观察其分布。每组随机选取3只大鼠,每只大鼠分别统计不同肠段3张切片的肠道横断面固有层及绒毛顶端内单位面积TLR2表达量,并求取平均值。
1.6 试验数据统计 应用SPSS 12.0软件对测定的数据进行组间方差分析和显著性检验。试验结果采用平均数±标准差表示。
2 结果
2.1 脾虚模型大鼠临床表现和体重变化 脾虚组大鼠第3天开始出现精神倦怠,嗜卧,懒动,拱背,扎堆等临床症状;采食量明显减少,造模第7天,与对照组比较体重显著下降(P<0.05,图1)。以上临床症状及体重变化表明大鼠脾虚模型复制成功。
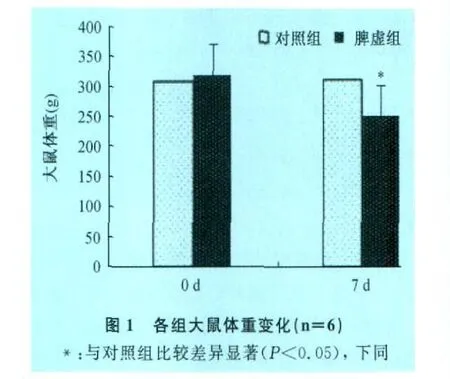
2.2 脾虚大鼠小肠组织形态学变化 光镜下观察可见,对照组大鼠十二指肠、空肠、回肠上皮结构完整,层次分明(见中插彩版图2 A、B、C)。脾虚组大鼠十二指肠、空肠、回肠绒毛肠黏膜顶端上皮细胞变性、坏死、脱落,固有层裸露(见中插彩版图2 D、E、F)。

2.3 脾虚大鼠小肠绒毛长度和肠黏膜厚度 见表1。
由表1可知,与其形态学变化相应,脾虚组十二指肠、空肠和回肠的绒毛长度与肠黏膜厚度均发生了变化,极显著低于对照组(P<0.01)。
2.4 脾虚大鼠小肠上皮内淋巴细胞和杯状细胞数量 见表2。
由表2可知,脾虚组十二指肠、空肠和回肠的上皮内淋巴细胞和杯状细胞数量均极明显多于对照组(P<0.01)。
2.5 脾虚大鼠小肠黏膜TLR2表达的变化 见中插彩版图3和表3。

由图3和表3可见,TLR2阳性物质为棕黄色,主要分布在小肠绒毛顶端与黏膜下层。与对照组比,脾虚组大鼠十二指肠、空肠和回肠的绒毛顶端与黏膜下层TLR2的表达量均显著下降(P<0.01或P<0.05)。
表1 脾虚大鼠小肠绒毛长度和肠黏膜厚度(±SD,n=6) (μm)

表1 脾虚大鼠小肠绒毛长度和肠黏膜厚度(±SD,n=6) (μm)
*:与对照组比较差异显著(P<0.05);**:与对照组比较差异极显著(P<0.01),下同
不同肠段 组别 绒毛长度 肠黏膜厚度十二指肠 对照组 678.21±41.48 790.76±39.90脾虚组 591.73±24.50** 694.87±42.84**空肠 对照组 573.17±56.14 668.19±10.99脾虚组 312.87±56.52** 530.11±47.28**回肠 对照组 379.91±17.20 479.67±25.91脾虚组 312.24±20.88** 429.79±27.82**
表2 小肠黏膜上皮淋巴细胞和杯状细胞数量统计结果(±SD,n=6)(个)

表2 小肠黏膜上皮淋巴细胞和杯状细胞数量统计结果(±SD,n=6)(个)
组别 上皮内淋巴细胞十二指肠 空肠 回肠杯状细胞十二指肠 空肠 回肠对照组 12.1±1.4 23.3±1.3 20.9±1.1 9.1±0.9 11.5±1.1 17.5±1.1脾虚组 18.5±1.2** 34.5±2.8** 26.9±1.2** 13.2±1.0** 17.7±1.3** 23.1±1.5**
表3 对照组和脾虚组大鼠小肠黏膜TLR2表达量统计结果(±SD,n=3) (%)

表3 对照组和脾虚组大鼠小肠黏膜TLR2表达量统计结果(±SD,n=3) (%)
组别 绒毛顶端十二指肠 空肠 回肠黏膜下层十二指肠 空肠 回肠对照组 12.4±1.9 9.2±0.8 18.2±2.0 21.1±1.8 4.5±0.4 18.1±1.7脾虚组 6.5±0.8** 4.4±0.9** 8.2±1.1** 4.8±0.8** 3.6±0.2* 10.7±1.2**
3 讨论
小肠是消化道内营养物质吸收和转运的主要部位,同时小肠黏膜也是机体防止病原侵袭的第一道防线[2],而脾虚与肠道消化吸收及黏膜免疫功能低下存在密切关系[3]。小肠黏膜结构的良好状态是营养物质消化吸收以及发挥黏膜免疫功能的结构基础。其中小肠的绒毛长度、黏膜厚度及绒毛表面积是衡量小肠消化吸收功能的重要指标[4]。本试验研究发现,脾虚大鼠肠黏膜结构受损严重,尤以十二指肠和空肠受损最为显著,表现为黏膜上皮脱落,固有层裸露。与对照组相比,十二指肠、空肠和回肠绒毛长度及黏膜厚度均显著下降。上述结果均提示脾虚大鼠小肠消化吸收面积减少、功能减弱,必然导致大鼠生长受阻,这一点从脾虚大鼠体重显著下降得到佐证。
小肠上皮内淋巴细胞和杯状细胞在肠道发挥黏膜免疫功能过程中均起到非常重要的作用。小肠上皮内淋巴细胞是一类独特的细胞群,在细胞介导的黏膜免疫和维持上皮的完整性上起重要作用,能抑制肠黏膜超敏反应,识别上皮细胞是否受细菌、病毒的感染,并分泌细胞因子,以发挥抗细菌、抗病毒、抗感染和抗局部细胞癌变的作用。杯状细胞则可以通过在黏膜表面分泌黏液在其局部执行特异性或非特异性免疫功能[5]。淋巴细胞和杯状细胞执行免疫功能过强则会造成免疫损伤。本研究结果发现,脾虚大鼠的小肠上皮内淋巴细胞和杯状细胞均显著高于对照组,提示脾虚大鼠小肠组织结构的损伤很可能是局部免疫反应过强而造成的免疫损伤。那么造成免疫损伤的机制何在呢?
近年来研究发现,TLRs的激活及引发的下游一系列信号分子活化可能是过度免疫反应造成肠黏膜屏障功能受损的关键点。TLRs可表达于肠道黏膜上皮细胞、固有层的巨噬细胞、树突状细胞、纤维母细胞以及微血管内皮细胞上,识别共生菌或病原菌表达的PAMPs,与黏膜耐受和保护有密切的关系[2,4]。其中TLR2在天然免疫应答中的重要性不容忽视,是连接天然免疫和获得性免疫的桥梁[6-7]。TLR2是TLR家族的一个重要成员,其存在对于肠道黏膜具有重要的保护作用[8]。本研究结果发现,脾虚大鼠小肠黏膜 TLR2的表达量显著下降,提示脾虚大鼠肠道过强免疫反应并非由TLR2介导的同时,在一定程度上说明,小肠局部天然免疫功能将受到抑制,这与小肠组织结构损伤情况一致。
综上所述,小肠黏膜结构的损伤是脾虚引起动物体重下降的原因之一,局部过强的免疫反应是造成小肠黏膜结构损伤的主要机制,且此过程并非通过TLR2介导;同时小肠结构的损伤及TLR2表达的显著下降均提示其抵御病原侵袭的功能下降。
[1] 逄紫千,李秋明,袁洪平.针灸对脾虚证肠道局部免疫的作用机制[J].长春中医药大学学报,2007(2):84-85.
[2] Schenk M,Mueller C.The mucosal immune sy stem at the gastrointestinal barrier[J].Best Practice&Research Clinical Gastroenterology,2008,22(3):391-409.
[3] 周华.四君子汤总多糖对小鼠整体和肠道黏膜免疫功能的影响[D].广州:广州中医药大学,2001.
[4] Har ris G,Kuolee R.Role of Toll-lik e recep tors in health and diseases of gastrointestinal tract[J].世界胃肠病学杂志:英文版,2006(14):11-22.
[5] Iijima H,Takahashi I,Kiy ono H.Mucosal immune network in the gut for the control of infectious diseases[J].Rev Med Virol,2001,11:117-133.
[6] 段朝霞.Toll样受体家族与天然免疫[J].国外医学:分子生物学分册,2002(6):380-383.
[7] 杨芳芳,陈成水.Toll样受体2的研究进展[J].医学综述,2008(11):1636-1639.
[8] 李可洲,李宁,黎介寿,等.短链脂肪酸对大鼠移植小肠形态及功能的作用研究[J].世界华人杂志,2002,10(6):720-722.
