SYBR GreenⅠ荧光定量PCR检测猪圆环病毒2型方法的建立
2010-11-22时建立徐绍建孙文博吴家强王金宝
李 俊,丁 鹏,时建立,徐绍建,孙文博,吴家强,王金宝,周 顺
(1.山东师范大学生命科学院,山东济南250014;2.山东省农业科学院畜牧兽医研究所山东省畜禽疫病防治与繁育重点实验室,山东济南250100;3.青岛农业大学动物科技学院,山东青岛266109)
猪圆环病毒2型(PCV2)为圆环病毒科,圆环病毒属成员,是一种单股负链环状的DNA病毒,无囊膜,病毒粒子直径为17 nm。临床上对于该病毒相关疾病的诊断主要根据其临床症状,但由于猪圆环病毒同猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪细小病毒等引起的疾病临床症状相似,临床症状和病理变化只能作为初步诊断的依据,难以确诊。荧光定量PCR技术最早由Higuchi在1992年提出,1996年美国PE公司推出首台Real-time检测系统,使 Real-time PCR得以真正的应用和推广。它可对样品中的核酸进行准确的定量检测,具有简单、易操作、结果直观、敏感性高、特异性强、重复性好等优点,已成为病原检测的重要方法。
1 材料与方法
1.1 病毒株 猪圆环病毒2型山东分离株SD2(DQ478947),无PCV1污染的PK-15细胞,E.coli DH5α菌种,由山东省畜禽疫病防治与繁育重点实验室保存。
1.2 主要试剂和仪器 荧光定量PCR仪购自BIO-RAD公司,PCR产物纯化回收试剂盒、DNA连接试剂盒、PCR试剂盒等购自宝生物工程(大连)有限公司。
1.3 引物设计 根据GenBank已发表的PCV2分离株的序列,采用Primer5.0软件,设计如下两对特异性引物,扩增猪圆环病毒2型完整ORF3基因和ORF3基因中196bp片段,引物由上海生工生物工程技术服务有限公司合成。
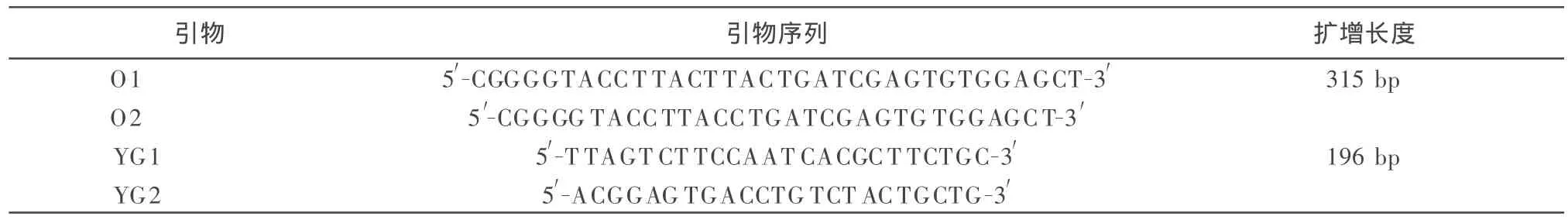
表1 SYBR GreenⅠ荧光定量PCR检测猪圆环病毒引物序列
1.4 标准品的制备与定量 PCR产物回收纯化,插入pMD-18T载体,按常规方法转化大肠杆菌,将PCR鉴定为阳性的重组质粒送上海生工生物工程技术服务有限公司测序鉴定。将上述质粒做30倍稀释后,用紫外分光光度计测定其浓度,计算标准品拷贝数,10倍梯度稀释,-70℃保存备用。
1.5 SYBR GreenⅠ荧光定量PCR反应条件的确定 按顺序加入以下试剂,建立25μL PCR反应体系:12.5μL 2×Fast Start Universal SYBRGreen Master、8.5μL Rnase free水、上下游引物 YG1、YG2各1μL(终浓度 300 nmol/L)、2μL模板。按以下程序进行Real-time PCR反应:95℃15 min,95℃15 s,58℃1 min,40个循环。
1.6 扩增产物的溶解曲线分析 荧光定量PCR扩增结束后,添加 Dissociation stage,95℃15 s,58℃1 min,95℃15 s。在升温变性时收集荧光信号,经软件分析后获得扩增产物的Tm值。试验所用仪器为BIO-RAD多重荧光定量PCR仪,数据分析软件为iQTM5.2.0。
1.7 标准曲线的建立 选择每微升含有107、106、105、104、103拷贝数的标准品作为模板,在BIO-RAD多重荧光定量PCR仪进行荧光定量PCR扩增,得到相应的动力学曲线,自动计算产生标准曲线。
1.8 特异性试验 以猪伪狂犬病病毒(PRV)、猪细小病毒(PPV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)、猪瘟病毒(CSFV)所抽提的DNA或cDNA为模板和双蒸水进行SYBR GreenⅠ荧光定量PCR检测,以确定该方法的特异性。
1.9 敏感性试验(同时将倍比稀释的DNA进行PCR检测) 以每微升含有 108、107、106、105、104、103、102、101、100标准品为模板,进行普通 PCR 和SYBRGreenⅠ荧光定量PCR检测,确定该方法的敏感性。
1.10 重复性试验 用荧光定量PCR仪对3份不同拷贝数的标准品进行重复检测,每个样品重复3次,根据每个稀释度的标准品的CT值进行变异系数计算,确定该方法的重复性
1.11 临床样品检测 采取临床送检的25例具有PMWS疑似症状猪病料,用常规 PCR和 SYBR GreenⅠ荧光定量PCR方法进行检测。
2 结果
2.1 标准品的制备 PCR扩增后取10μL PCR产物,用2%琼脂糖凝胶电泳,能检测到约300 bp的特异条带,阳性重组质粒约有3 000 bp与预期的扩增片段相符(图1)。
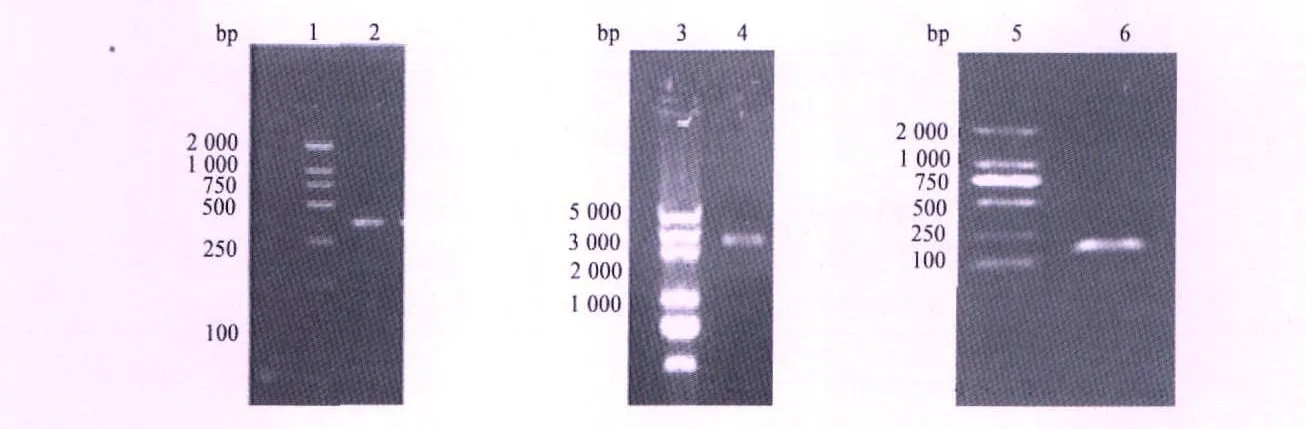
图1 PCR产物和质粒电泳结果
2.2 SYBR GreenⅠ荧光定量PCR扩增后的溶解曲线分析 溶解曲线分析是内置于定量热循环仪软件中的分析步骤,通过溶解曲线分析,以验证PCR产物的特异性。见图2。

图2 SYBR GreenⅠ荧光定量PCR溶解曲线
2.3 标准曲线的建立 选择每微升含有107、106、105、104、103拷贝数的标准品作为模板,按照优化后的SYBR GreenⅠ荧光定量PCR反应条件,制作标准曲线。标准曲线相关系数为0.999,斜率为-3.312,轴截距为 39.12,线性方程为 Y=-3.312 X+39.12,SYBRGreenⅠ荧光定量PCR扩增效率为100.4%。见图3。

图3 SYBR GreenⅠ荧光定量PCR标准曲线
2.4 特异性试验 提取不同病毒DNA,进行SYBR GreenⅠ荧光定量PCR反应,结果这些病毒的扩增曲线始终为上扬,为水平线,表明该方法有很好的特异性。见图4。

图4 SYBR GreenⅠ荧光定量PCR特异性试验结果
2.5 敏感性试验 SYBR GreenⅠ荧光定量PCR能检测的最低浓度为10拷贝/μL,而普通PCR能检测的最低模板浓度为1×103拷贝/μL。表明该方法检测猪圆环病毒2型的敏感性是普通PCR的100倍。见图4。
2.6 重复性试验 用SYBR GreenⅠ荧光定量PCR检测不同浓度的样品,每个浓度3个重复,并对结果进行统计分析,结果见表2。重复性试验的变异系数均小于5%,说明该方法具有很好的重复性(标准差和变异系数采用Microsoft office Execel表格中的相关公式计算)。

图5 SYBR GreenⅠ 荧光定量 PCR敏感性试验结果(拷贝/μL)

表2 SYBR GreenⅠ荧光定量PCR重复性试验结果
2.7 临床样品检测结果 见表3。

表3 SYBR GreenⅠ荧光定量PCR和常规PCR检测比较
3 讨论
研究表明,PCV2仅能导致轻微的断奶仔猪多系统衰竭综合征。当该病毒与PRV、PPV、PRRSV或细菌等共同感染时,一定程度上影响了机体对PRRSV和PRV疫苗的免疫应答能力[8],则会复制出典型的PMWS症状。快速、准确地检测PCV2有助于做出科学、正确的诊断。
本试验设计两对特异性引物O1 O2和YG1YG2,分别扩增整个ORF3基因和其中196 bp特异片段。以引物YG1YG2作为荧光定量PCR检测引物。针对ORF3基因的SYBR GreenⅠ实时荧光定量PCR的建立,为ORF3基因转录情况和功能的深入研究奠定基础。
本试验分别运用普通PCR方法和SYBR GreenⅠ实时定量PCR方法对临床送检病猪组织及血清进行PCV2的检测。所有常规PCR检测阳性的样品,SYBR GreenⅠ实时定量PCR检测结果都是阳性,并将阳性样品间检出率提高15个百分点。临床检测中,可将反应时间优化缩短为1.5 h,可更快速地检测PCV2感染情况。
本试验建立的SYBR GreenⅠ实时PCR方法特异性强、敏感性高、操作方便,适用于PCV2感染的群体血清流行病学调查,为了解国内猪群中PCV2流行情况和 PMWS的早期诊断提供技术支撑。
