丝素蛋白/羟基磷灰石多孔复合材料修复骨缺损研究
2010-11-16施咏毅罗敏清卢神州
施咏毅,罗敏清,毛 丽,卢神州
(1.苏州市中医院 骨科,江苏 苏州 215003;2.现代丝绸国家工程实验室,江苏 苏州 215123;3.苏州大学 纺织与服装工程学院,江苏 苏州 215021)
丝素蛋白/羟基磷灰石多孔复合材料修复骨缺损研究
施咏毅1,罗敏清2,3,毛 丽2,3,卢神州2,3
(1.苏州市中医院 骨科,江苏 苏州 215003;2.现代丝绸国家工程实验室,江苏 苏州 215123;3.苏州大学 纺织与服装工程学院,江苏 苏州 215021)
为了探讨丝素蛋白/羟基磷灰石(SF/HA)复合多孔支架材料的制备及其用于骨缺损的修复,采用超声波凝胶干燥法制备了SF/HA复合材料;以脱胶茧丝为增强材料,水溶性淀粉为制孔剂,通过去离子水萃取法除去淀粉,制备了SF/HA多孔复合材料。对其孔隙率及抗压强度进行测试,并将其植入兔股骨缺损处观察修复的情况。SF/HA多孔复合材料的孔隙率接近75 %,孔径尺寸分布约从几微米到400 μm,并且孔隙之间相互贯通,其抗压强度可达10 MPa以上,植入兔股骨缺损处未见引起骨组织明显的炎症反应及骨坏死,术后12周发现基本修复骨缺损部位,而空白对照组没有骨生成。SF/HA多孔复合材料可以满足骨组织工程支架的基本要求,用于骨缺损的修复。
丝素蛋白;多孔;羟基磷灰石;机械性能测试;X光照片
骨缺损是骨科临床常见的难症之一,在应用数量上骨移植已经成为仅次于输血的人体组织移植。组织工程化骨的应用为骨缺损的治疗带来良好的前景,目前多数学者认为组织工程化骨制备的重点是组织工程支架材料的研制构建。羟基磷灰石(HA)是人体骨组织的主要成分,具有良好的生物相容性、生物活性及骨传导性[1],已广泛用于修复各类骨缺损,但由于易发生脆性断裂、疲劳破坏及烧结后的不可降解性,长期疗效不尽人意。虽然HA纳米化后生物力学性能及可降解性得到改善,但仍距骨组织工程支架材料的要求相差甚远。为了提高材料的力学性能及新骨的形成速度,采用不同性质的材料进行杂化以获得具有新特性的杂化支架材料,成为当前生物材料研究的热点[2-3]。丝素蛋白材料强度高,免疫原性低,生物相容性好,适合于制备生物医用材料[4]。但是单纯的多孔丝素蛋白用于骨修复过程中诱导成骨较慢[5]。在制备复合多孔支架材料中,致孔剂的选择是比较重要的,既在室温下难溶于水,还要能容易去除,不能影响材料的生物相容性。因此考虑使用水溶性淀粉作为致孔剂。水溶性淀粉作为致孔剂的优点是其在室温下溶解速度缓慢,但是加热后比较容易溶于水而去除,另外淀粉的生物相容性比较好,即使不能完全去除也不影响材料的生物相容性和生物降解性。丝素蛋白能够在超声波作用下快速凝胶化[6],因此,本研究以淀粉为致孔剂,采用超声波凝胶干燥法来制备丝素蛋白/羟基磷灰石复合材料,探讨淀粉的加入对复合材料机械性能及孔结构的影响。在此基础上进行植入兔股骨进行骨缺损修复的探讨。
1 实验与方法
1.1 丝素蛋白/羟基磷灰石多孔复合材料的制备
中国家蚕生丝或者茧丝置于质量分数为0.05 %的Na2CO3溶液中,于98~100 ℃处理30 min,重复3次,脱去蚕丝中的丝胶。洗净干燥后的纯丝素纤维用CaCl2·CH3CH2OH·H2O(摩尔比1∶2∶8)三元溶剂,于(75±2)℃搅拌溶解,浴比1∶10,时间1 h。溶解后的混合溶液经过透析、浓缩为质量分数为5 %的丝素蛋白(SF)水溶液。纳米HA的制备如文献[7]所示,脱胶茧丝梳理后剪成2 mm备用。取新制备的质量分数为7 %的HA浆料,按质量比HA∶SF=2的比例加入到质量分数为5 %的丝素蛋白水溶液中,按照质量分数2 %加入脱胶茧丝,然后加入不同质量分数(相对于复合材料内固体总质量)的可溶性淀粉粉末,用JDY-900智能型超声波细胞粉碎机超声振荡至形成凝胶。凝胶放入60 ℃烘箱干燥定形,然后保持60 ℃加入去离子水溶解萃取出淀粉,每隔1 h换一次水,用碘液检测直至淀粉被水萃取完全。样品烘干备用。
1.2 复合材料的表征
孔隙率的测定[8]:选用一个比重瓶装满乙醇,称其质量W1;把质量为Ws的样品浸入乙醇中,脱气,务必使乙醇充盈于多孔支架的孔中,然后再加满乙醇,称其质量为W2;把浸满乙醇的样品取出后,剩余的乙醇与比重瓶称其质量W3。每个样品重复测定4次,取平均值:
样品支架本身体积:Vs=(W1-W2+Ws)/ρ
样品支架孔体积:Vp=(W2-W3-Ws)/ρ
样品支架孔隙率:ε=Vp/(Vp+Vs)=(W2-W3-Ws)/(W1-W3)
样品的表观密度:ρ0=Ws/Vs
抗压强度的测定:INSTRON5566万能实验机测试压缩性能,样品尺寸:0.5 cm×0.5 cm×1 cm,测试速度:0.5 mm/min。
形貌观察:用HITACHIS-570型扫描电子显微镜观测多孔复合材料的形貌。
1.3 复合材料体内植入实验
实验动物:成年雄性新西兰兔24只,平均体质量2.4 kg,由苏州大学实验动物中心提供。饲养环境温度18~24 ℃,湿度40 %~60 %。
材料植入:实验动物自其耳缘静脉内缓慢注射3 %的戊巴比妥钠30 mg/kg。麻醉生效后,在右股骨髁外侧做长约2 cm切口,剥离并剪去植骨区骨膜,在股骨外侧髁以慢速电钻垂直于股骨干钻孔,在股骨髁内形成4.5 mm直径、10 mm深度的松质骨缺损,不打穿内侧髁骨皮质。随机抽取12只为实验组,于骨缺损区植入丝素蛋白/羟基磷灰石复合多孔材料;另外12只为对照组不作任何植入。所有动物逐层缝合皮下组织及皮肤,安尔碘消毒切口。患肢不行内外固定,常规条件下喂养观察。
X光观察:于术后第4、8、12周,每次随机选取4只兔子麻醉后摄右后肢侧位X线片,观察骨缺损新骨生成情况,曝光条件为52 kV,5.6 mAs,0.2 s,将照片导入电脑后观察。
组织学观察,Masson染色[10]:实验用动物处死后, 取骨痂标本,10 %福尔马林固定,10 %的硝酸脱钙7 d,水洗,15 %碳酸锂溶液中和,常规酒精脱水, 浸蜡后石蜡包埋,行5 μm 连续切片,切片脱蜡入水;1 %桔黄G 10 mL+90 mL苦味酸酶染30 min,水洗;苏木精核染15 min,自来水冲洗2 min;复合液染(丽春红+酸性复红)10 min,水洗;1 %磷钨酸分化10 min,1 %亚甲蓝染15 min;无水乙醇脱水;二甲苯透明,中性树胶封片,光学显微镜观察。
2 结果与分析
2.1 复合材料的电镜观察
对于骨组织工程材料,其孔径和孔隙率对于诱发成骨是有很大影响的。研究表明[9],15~50 μm的孔可以诱导纤维组织的长入,50~150 μm的孔则可刺激骨样组织的生成,而150~500 μm的孔可以直接诱发矿化骨的生成。由图1可见,随着淀粉的加入,在复合材料中形成了较多的孔隙,孔径也逐渐增加。另外由于淀粉的溶出,这些孔都是相通的,大孔的孔壁上还套着小孔。小孔只有几微米而大孔可以达到几百微米,满足成骨的需要。随着淀粉加入量从0 %增加到100 %,平均孔径从20 μm增加到200 μm。其中最大孔径已经超过500 μm,随着淀粉加入量的继续增加,最大孔径可能突破1 000 μm,但是这也会导致整个材料在脱淀粉后崩溃,无法成形。

图1 加入不同淀粉量的丝素蛋白/羟基磷灰石复合材料的SEM照片(标尺:600 nm,放大50倍)Fig.1 SEM Images of Surface of SF/HA Porous Composites with Different Starch Mass Fractions (Bar=600 nm, ×50)
2.2 复合材料的表观密度和孔隙率
从图2中可以看出,随着淀粉加入量从0 %上升到100 %,复合材料的表观密度从0.86 g/cm3下降到0.52 g/cm3,而孔隙率从52 %上升到87 %。说明随着淀粉加入量的增加,表观密度有明显的下降,而孔隙率有明显的上升。
2.3 复合材料的抗压性能
从图3可以看到,随着淀粉加入量从0 %上升到100 %,复合材料的抗压强度从23 MPa下降到3.3 MPa,复合材料的抗压模量从660 MPa下降到144 MPa,说明材料的抗压性能随着淀粉加入量的增加显著下降,超过100 %的淀粉加入量,材料强度太小而无法成形。
理想的骨组织工程支架材料应该具有足够的机械强度,一般以小梁骨为参照,其抗压强度应大于5 MPa,抗压强度大于10 MPa可认为是合格的组织支架材料。因此本研究选择加入50 %淀粉的复合材料,其抗压强度达到10.3 MPa,抗压模量为320 MPa,孔隙率为72 %,最大孔径250 μm,作为植入兔股骨缺损的修复材料。

图2 孔隙率和表观密度随淀粉加入量的变化Fig.2 Porosity and Apparent Density of SF/HA Composites with Different Starch Mass Fractions

图3 抗压强度和模量随淀粉加入量的变化Fig.3 Compression Strength and Modulus of SF/HA Composites with Different Starch Mass Fractions
2.4 复合材料的体内实验
2.4.1 大体观察
动物在材料植入后正常活动、进食,患肢轻度肿胀,1周左右消退,切口无感染,植入材料均未见明显排斥现象。4周时材料表面有薄层结缔组织包膜形成;8周时材料表面骨化,与周围组织界限模糊;12周时骨缺损处已填满骨组织,颜色较周围骨皮质呈暗红色,表面光滑,质硬。空白对照组骨缺损处始终无新骨长入,由纤维结缔组织填充,骨缺损边缘发生硬化。
2.4.2 植入后X光观察
由图4可见,a图为术后第4周,HA/SF植入的缺损区边缘清楚,周边骨端与材料间的间隙较明显,材料影清晰;b图为术后8周时, 周边骨端与材料间的间隙模糊,骨痂向移植物长入,骨缺损区较前缩小,材料有降解现象;c图为术后12周时,骨缺损部位钙化程度进一步加深, 整个材料骨密度增高;d图为术后12周时,对照组骨缺损部位仍然未见明显钙化,呈低密度影,缺损区边缘硬化。

图4 植入后不同时期的X光照片(箭头部分为骨缺损部位)Fig.4 The X-ray Pictures at Different Periods after Implant Operation (The Arrows are the Bone Defects)
2.4.3 组织学观察
在Masson染色中,成熟骨中的I型胶原呈红色,软骨胶原是Ⅱ型胶原,呈绿色;而真皮、骨及钙化软骨中的胶原呈红绿相间,钙化软骨中可以呈现较多红染。幼稚骨组织中的胶原主要呈绿色,新生骨在成熟过程中呈绿色至红绿相间,骨质越成熟,红染越多[10]。由图5可见,a图为术后4周时,HA/SF材料边缘有纤维结缔组织长入,有少量纤维骨痂形成,可见到少量成纤维细胞,未见明显成骨细胞及破骨细胞;Masson染色主要表现为绿色。b图为术后8周时,Masson染色出现较多的红染,说明已经发生成骨现象。c图为术后12周时,Masson染色主要表现为红绿相间,大部分部位形成新生骨组织。d图为术后12周时,对照组骨缺损处发生疤痕愈合,由致密结缔组织填充,Masson染色均为绿色,无新生骨组织形成。
从体内植入实验中可以发现,SF/HA复合材料生物相容性良好,没有引起严重的免疫反应或者严重的炎症反应。随着时间的延长,细胞逐渐长入多孔材料中,并且逐渐修复缺损部位。而对照组只有纤维疤痕组织的生成,没有成骨。说明SF/HA复合材料能够促进骨缺损的愈合,可以作为骨组织工程支架材料使用。
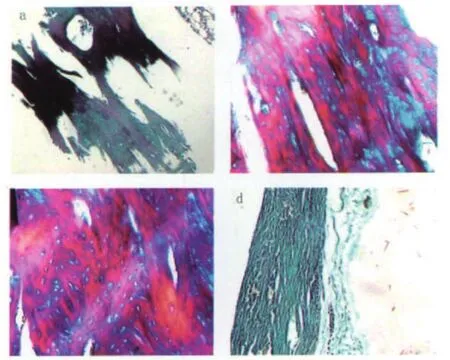
图5 实验组及对照组不同时期的组织学观察(Masson染色,100倍)Fig.5 Histological Observation of the Experimental Group and Control Group in Different Periods(Masson's Trichrome Staining, ×100)
3 结 论
1)使用超声波凝胶干燥的方法,以脱胶茧丝为增强纤维、可溶性淀粉为致孔剂,成功制备了丝素蛋白/羟基磷灰石多孔复合材料,进行了复合材料修复兔股骨缺损的研究。
2)丝素蛋白/羟基磷灰石多孔复合材料压缩强度达到10 MPa以上,孔隙率达到70 %以上,孔径尺寸分布约从几微米到400 μm, 并且孔隙之间相互贯通。
3)兔股骨缺损植入修复实验表明,多孔复合材料生物相容性良好,术后12周能够修复骨缺损部位,该材料有望作为一种骨修复材料得到应用。
[1] KOKUBO Tadashi, KIM Hyun Min, KAWASHITA Masakazu. Novel Bioactive Materials with Different Mechanical Properties[J]. Biomaterials, 2003, 24(13):2161-2175.
[2] 吕彩霞,姚子华. 纳米羟基磷灰石/壳聚糖-硫酸软骨素复合材料的制备及其性能研究[J].复合材料学报,2007,24(1):110-115.
[3] 廖建国,李玉宝,王学江,等.纳米羟基磷灰石/聚碳酸酯复合生物材料Ⅱ:体外生物活性[J].复合材料学报,2008,25(3):68-72.
[4] ALTMAN Gregory H, DIAZ Frank, JAKUBA Caroline,et al. Silk-based biomaterials[J]. Biomaterials, 2003, 24(3):401-416.
[5] MEINEL Lorenz, FAJARDOD Robert, HOFMANN Sandra,et al. Silk Implants for the Healing of Critical Size Bone Defects[J]. Bone, 2005, 37: 688-698.
[6] WANG X, KLUGE J A, LEISK G G, et al. Sonicationinduced Gelation of Silk Fibroin for Cell Encapsulation[J].Biomaterials, 2008, 29: 1054-1064.
[7] 卢神州,李明忠,白伦.羟基磷灰石/丝素蛋白纳米复合颗粒的制备[J]. 丝绸,2006(2):17-19.
[8] 肖秀峰,黄琼瑜,刘榕芳,等.纳米羟基磷灰石/聚合物多孔复合支架材料[J].复合材料学报,2008,25(6):39-46.
[9] GREEN D,WALSH D, MANN S,et al.The Potential of Biomimesis in Bone Tissue Engineering:Lessons from the Design and Synthesis of Invertebrate Skeletons[J].Bone, 2002,30(6): 810-815.
[10] CHO S W,KIM I K,LIM S H,et al.Smooth Muscle-like Tissues Engineered with Bone Marrow Stromal Cells[J].Biomaterials, 2004, 25: 2979-2986.
Study on Porous Silk Fibroin/ hydroxyapatite Composites Used as Bone Defect Treatment
SHI Yong-yi1, LUO Min-qing2,3, MAO Li2,3, LU Shen-zhou2,3
(1. Orthopedics, Suzhou Traditional Chinese Medical Hospital, Suzhou 215003, China; 2. National Engineering Laboratory for Modern Silk, Suzhou 215123, China; 3. College of Textile and Clothing Engineering, Soochow University, Suzhou 215021, China)
To investigate the preparation and the bone defect treatment of the porous silk fibroin/ hydroxyapatite(SF/HA) scaffold composites, the porous composites of SF/HA were prepared by means of dried after sonication-induced gelation. In the process, degummed silk fiber was used as the reinforcement, and watersoluble starch was used as the porogen, which was removed by extraction method with deionized water. The porosity and compressive strength of SF/HA were tested. At the same time, changes of the bone histology were observed by implanting SF/HA into the bone defects of rabbits. The porosity ratio of SF/HA is about 75 % and the compressive strength can exceed 10 MPa. The diameter of the pores is about from several microns to four hundred microns and most of them are circular. The animal experiments show that SF/HA did not result in inflammatory reaction and bone putrescence. The bone defect was repaired by SF/HA composites by 12 weeks after implant operation. Whereas in the control group, by 12 weeks after operation, no callus formed and the defects were not repaired. It is suggested that SF/HA would be a potential scaffold composites for the treatment of bone defects.
Silk fibroin; Porosity; Hydroxyapatite; Mechanical testing; Radiography
TS149;TB332
A
1001-7003(2010)10-0001-04
2010-07-06;
2010-09-03
国家973计划项目(2005CB623906);苏州市科技计划项目(SYJG0923);江苏省产学研联合创新资金项目(BY2009127)
施咏毅(1975- ),男,主治医师,主要从事脊柱外科、创伤骨科和人工骨的研究。通讯作者:卢神州,副教授,博士,lushenzhou@suda.edu.cn。
