垃圾渗滤液深度处理功能菌的筛选及应用
2010-11-14吉芳英谢志刚邱雪敏张琳苑
吉芳英,谢志刚,邱雪敏,黄 鹤,张琳苑
(1.重庆大学三峡库区生态环境教育部重点实验室,重庆 400045;2.重庆文理学院,重庆 402160)
由于性质的复杂性,垃圾渗滤液的处理成为了世界上较为棘手的科学难题之一,单一的渗滤液处理技术并不能满足人们对渗滤液的处理要求[1]。经生化处理后的垃圾渗滤液的深度处理是实现其达标排放的必要途径[2],生物活性炭法就是一种较为有效的垃圾渗滤液深度处理技术[3-5]。有研究表明,向反应器中投加具有特殊降解作用的微生物可以改善难降解有机污染物的效果,不过这方面的研究目前还限于摇瓶实验[6]。迄今为止,尚未见将功能菌投放到生物活性炭(BAC)反应器中进行垃圾渗滤液深度处理的研究报道。课题组以垃圾渗滤液生化处理曝气池污泥为菌种,用渗滤液生化尾水和琼脂调配培养基,采用生物强化技术进行了功能菌的培养与筛选,并将扩大培养的功能菌投放到BAC中,形成了功能菌BAC反应器。论文对功能菌的驯化、筛选、扩大培养以及功能菌BAC反应器对垃圾渗滤液生化尾水的进一步降解性能进行系统研究,以期为功能菌BAC技术在垃圾渗滤液深度处理方面的实际应用提供理论依据和实验支撑。
1 试验装置和方法
1.1 水质分析方法
光密度值由Hitachi U-3010紫外可见分光光度计测得,TOC(Total Organic Carbon,总有机碳)用Elementar TOC仪测试。色度采用紫外分光光度法测试[7],以铬钴为标准溶液;生物量的测定采用磷脂法[8-9];生物活性采用TTC脱氢酶活性法测定[10-11],无色的氯化三苯基四氮唑(简称T TC)为受氢体,受氢后生成红色三苯基甲膳(TF),采用分光光度法,以TF的生成量表示T TC-脱氢酶活性的大小。
1.2 水样和污泥采集
菌种分离源采自三峡库区某垃圾焚烧厂渗滤液二级生物处理系统的曝气池;试验用水为该系统的二沉池出水,水质特征为:TOC 247 mg/L,UV2543.445 cm-1,NH3-N 20.28 mg/L。
1.3 功能菌培养与筛选
渗滤液生化尾水过滤后的清液以3000 r/min离心10 min,高温灭菌30 min制成液体培养基;向液体培养基中加入2%琼脂调配成水样固体培养基。
将活性污泥打散,制成10倍递减稀释的系列悬浊液。取稀释度10-4~10-6悬浊液各0.1 ml,分别于水样固体培养基上涂布接种,重复3次。置接种后的固体培养基于30℃培养2~3 d。
挑取菌落数在40个左右的平皿,在室温下放置2~3 d,使菌落性状能较充分的表现,挑取单菌落转接于斜面试管上,再将具有不同性状的菌落在固体培养基平板上划线纯化、培养,保存备用。
采用微滤膜(0.22μm)将原水中的微生物滤除,排除原水中微生物对实验的影响。将纯化培养的菌种分别接种于水样,30℃、100 r/min摇床培养24 h,然后3000 r/min离心10 min,滤掉水中菌体,取上清液测试,选择优势菌株,斜面培养基 4℃保存。
1.4 功能菌的鉴定
使用SDS-酚氯仿抽提法提取菌液的总DNA。菌株的鉴定采用16S rDNA序列分析方法。引物按照文献[12]设计,引物由华大中生科技发展有限公司合成,序列如下:
正向引物8F:AGAGTT TGATCCTGGCTC AG(对应于E.coli 16SrRNA基因的8~27个碱基)。
反向引物 1495R:CTACGGCTACCT TGT TA CGA(对应于E.coli 16SrRNA基因的1514~1495个碱基)。
1.5 试验装置及运行
试验采用柱式生物活性炭反应器,炭柱内径10 cm,柱内炭层高120 cm,见图1。活性炭为山西太原新华活性炭厂的ZJ-15型颗粒活性炭,承托层高40 cm(自上而下是粒径不同的石英砂和卵石),承托层的底部为有机玻璃的穿孔板,模拟实际滤池的小阻力配水系统。BAC1不投加功能菌,采用自然挂膜,进水流量7 ml/min;BAC2初始进水量为2 ml/min,1 d后采用间歇式循环物理吸附法投加功能菌生物量为100.6 nmol/mL的菌液6 L,将菌液以1 ml/min的流量挂膜2 h再停止2 h,循环挂膜2 d;第3 d将菌液放空、开始以3ml/min的流量进水并逐渐增加进水流量,7 d后进水量达到7 ml/min。
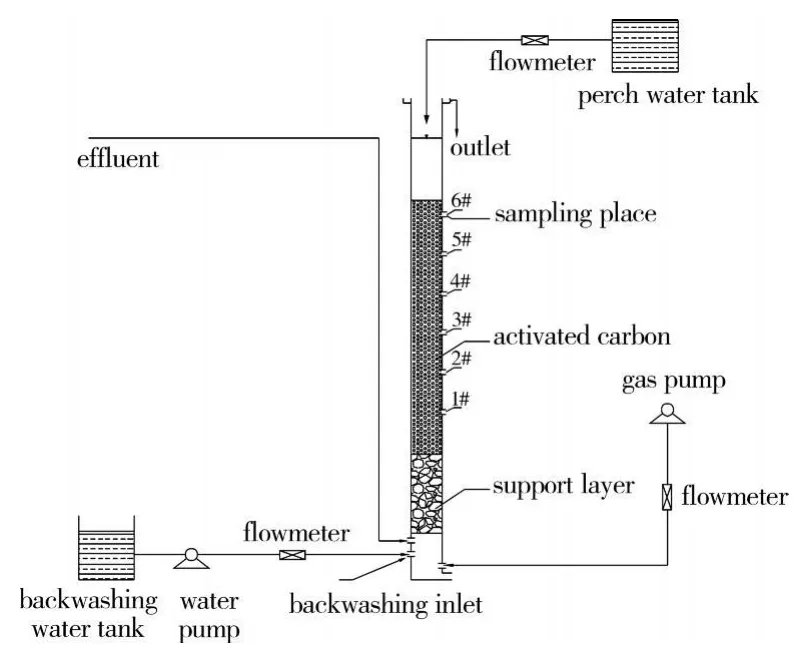
图1 生物活性炭反应器
1.6 分子量分布测定
选用滤膜过滤法测定水中溶解性有机物DOM分子量分布[13-14],即将已知截留分子量的超滤膜置于SCM系列杯式超滤器中,用纯氮气施以0.2 MPa的压力,水中分子量小于膜截留分子量的有机物透过膜进入滤液,而分子量大于膜截留分子量的有机物被膜截留。超滤膜和0.45μm微滤膜在使用前都用超纯水过滤,直至出水的UV254与超纯水的一致。膜过滤采用平行法,即水样用0.45μm微滤膜过滤后,分别通过HM系列平片超滤膜(分子量100 k、30 k 、10 K 、5 k 、1 kDa),测定滤液的 UV254,各分子量分布区间的有机物含量用差减法获得。
2 结果与讨论
2.1 功能菌的鉴定
经过分离纯化,从渗滤液生物处理系统曝气池污泥得到11株菌株。为了淘汰一些不适于应用的菌株(有可能是致病菌,生长速度慢,或营养要求高的菌株),将11株菌株分别接种于TOC初始浓度为92.8 mg·L-1、UV254为 1.378 cm-1的100 mL 液体培养基中,30℃、100 r/min摇床培养24 h,3000 r/min离心 10 min,取上清液测试,将对 TOC、UV254去除率均大于40%的菌株定义为优势菌。实验共筛选出3株优势菌,其特性见表1。

表1 优势菌的特征
对分离纯化后的3种菌株提取基因组DNA,PCR扩增其16S rDNA序列,测序。利用http://www.ncbi.nlm.nih.gov提供的 Blast程序,将测序结果与GenBank数据中的序列数据库中微生物16S rDNA序列进行对比分析,获得最相近菌株的16SrDNA序列,按照参考文献[15]的最大同源性原则进行排序。结果表明,菌株 Y1与海杆菌属(Marinobacter)的16SrDNA核苷酸序列同源性达到99.9%;菌株Y2与不动杆菌属(Acinetobacter)的16S rDNA核苷酸序列同源性达到99.8%;菌株Y3与埃希式菌属(Escherichia)的16S rDNA核苷酸序列同源性达到99.7%。
2.2 生物活性炭反应器的启动
试验将保存的纯菌种作为菌源,用混合培养基扩大培养。培养过程中逐渐提高混合培养基中待处理水样的比例,增强菌种的适应性,并采用间歇式循环物理吸附法将功能菌固定于BAC2,投加菌液生物量为100.6 nmol/L,循环挂膜结束后空菌液的生物量为9.8 nmol/mL,90.3%的功能菌成功接种。BAC1是采用自然挂膜,未投加功能菌。
2.2.1 生物量和生物活性的变化
生物活性炭反应器在启动过程中生物量和生物活性的历时变化过程见图2。

图2 生物活性炭的生物量和生物活性变化
从图2可以看出BAC1的自生长生物量在16 d的自然挂膜的培养过程中呈现出逐渐增加的趋势,投加功能菌的BAC2的生物量却出现了快速积累、下降、再稳步增长的态势。说明投加到生物活性炭池中的功能菌群依然存在一个在适应环境的淘洗和优化过程。启动运行终止时2套反应器的生物量分别为41.8 nmol/g和128.1 nmol/g,生物活性分别为 TF14.9 μ g/g 和 TF 31.2 μ g/g 。
2套反应器的比生物活性很接近(BAC1为TF 0.356 μ g/nmol,BAC2 为 TF 0.365 μ g/nmol),即生物活性炭池上单位生物量具有相同的生物活性。这一结果说明,按照该实验所示的功能菌培养及筛选方法可以获得与自然挂膜自生长优势生物菌群一样的、对目标难降解有机物具有较高降解活性的生物菌群。显然从图2可以看出,通过投加功能菌群的人工强化挂膜方式可以快速启动生物活性炭系统,使生物活性炭系统具有较高的生物量。在生物活性炭池中,生物量越丰富,附着在活性炭上的难降解有机物越容易生物降解,进而较易实现活性炭原位再生,使生物活性炭系统对难降解有机物的去除能力和抗冲击负荷潜能得到加强。
2.2.2 出水TOC的变化
生物活性炭反应器在启动过程中对 TOC的去除效果历时变化过程见图3。
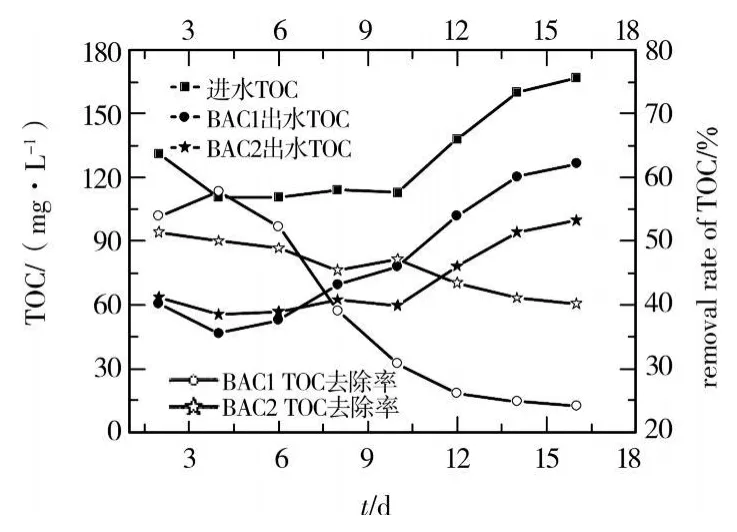
图3 生物活性炭对TOC的去除
从图3可以看出,在启动运行阶段,2套反应器对TOC的去除效果都出现了快速下降到趋于稳定的过程。虽然投加功能菌的BAC2初期去除效果低于BAC1,但是,它的下降趋势相对缓慢,运行稳定时去除效果远优于BAC1。究其原因是因为生物活性炭反应器启动初期,自生长生物尚未形成或投加的功能菌活性尚未恢复,活性炭的简单吸附就成为了有机物TOC的最主要去除方式。显然,投加功能菌的BAC2由于功能菌在活性炭表面上的附着,占据了活性炭吸附位,从而降低了活性炭对有机物TOC的吸附量,宏观上表现为BAC2初期 TOC去除率低。然而,伴随着启动时间的延长,虽然活性炭吸附容量减少,但自生长生物逐渐形成或投加的功能菌活性逐渐恢复,生物降解能力趋强,形成了活性炭吸附与生物降解的协同作用。从图3可以看出,启动运行稳定时2套BAC对TOC的去除率差异较大,分别为20%和40%,说明投加功能菌的BAC2具有较强的生物降解能力,更容易再生活性炭,获得优异的难降解有机物去除能力。
2.2.3 出水UV254的变化
光密度值UV254主要反映了一类具有芳香环结构或者双键结构的有机污染物,一般包括腐殖质和富里酸一类物质。生物活性炭反应器在启动过程中对UV254的去除见图4。活性炭刚投入使用时,主要发挥活性炭的物理吸附作用,UV254的去除率较高,随着通水倍数的增加,活性炭逐渐趋于饱和,活性炭对UV254的去除率逐渐降低。BAC接种微生物后,具有稳定的有机污染物去除效果,BAC1、BAC2的UV254去除率稳定在49.0%、54.0%以上。说明投加功能菌的BAC2对难降解有机物具有较强的生物降解能力。
2.2.4 出水色度的变化
生物活性炭对废水色度的去除很明显,见图5。在挂膜初期,活性炭的物理吸附占废水净化的主要作用,BAC1、BAC2对色度的去除率均较高。挂膜后期,活性炭的吸附空位很少,BAC主要依赖微生物的降解作用,色度去除率基本稳定在55%以上,而BAC2的色度去除率高于BAC1。
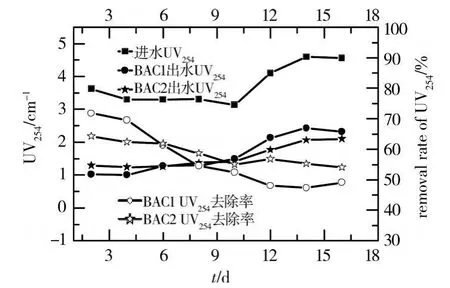
图4 生物活性炭对UV254的去除

图5 生物活性炭对色度的去除
挂膜后 BAC1、BAC2对的色度去除规律与UV254的去除相似,且色度、UV254的去除率明显高于TOC去除率,说明生物活性炭具有对难生物降解有机物的去除优越性。
2.3 BAC对难生物降解有机物的去除特性分析
采用HM系列平片超滤膜按照分子量大小对水样有机物进行分离,不同分子量范围的有机物在BAC中的去除效果见表2和图6。

表2 BAC反应器对水中UV254的去除
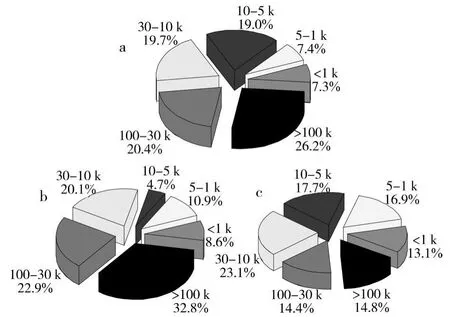
图6 水样的分子量分布
从表2可以看出,未投加功能菌的BAC1对水样中分子量M为10~5 kDa的有机污染物去除很明显;而BAC2对分子量M>100 kDa的有机污染物去除率最大,其次是分子量M 为100~30 kDa的有机污染物,分别达到80.9%、76.1%,说明该实验筛选的功能菌群更易于降解大分子有机物。BAC2出水中,分子量M 为5~1 kDa和<1 kDa的有机物的UV254光密度值比BAC1略高,其原因在于BAC2中的功能菌使更多的高分子量有机污染物降解成了分子量更小的有机物,使得出水中小分子量组分的含量反而更高。测试结果表明,BAC2的总UV254去除率达到 66.2%,而 BAC1的总 UV254去除率为54.1%。
从图6可以看出,就 UV254分布而言,试验进水的分子量M主要以>5 kDa为主,M<5 kDa的有机污染物只占14.9%。经自然挂膜的BAC1降解后,出水中分子量M 在10~5 kDa的有机物明显减少,组合含量从19.0%降至4.7%,说明BAC1对于分子量M<10 kDa的有机物具有更显著的降解性能。BAC2出水中,分子量M<10 kDa的有机物含量明显增加,尤其是分子量M<5 kDa的有机物含量从14.9%提高到27%;而大分子量有机物含量明显降低,M>100 kDa的有机物含量从26.7%降至14.8%,M为100~30 kDa的有机物含量也从30.4%降至14.%。两种BAC处理系统出水的分子量分布差异表明,功能菌更容易将大分子有机污染物降解为小分子有机物,改善了BAC处理系统的降解性能。
3 结论
以三峡库区某渗滤液二级生物处理系统的曝气池污泥作为菌种分离源,采用生物强化技术驯化和筛选了深度处理渗滤液生化尾水的3种优势菌。经16SrDNA鉴定表明,3株功能菌分别为海杆菌属(Marinobacter)、不动杆菌属(Acinetobacter)和埃希式菌属(Escherichia)。
功能菌都对渗滤液生化尾水中的有机污染物都具很强的降解能力。静态实验中,海杆菌属、不动杆菌和埃希式菌属属对水样 TOC的去除率分别为61.3%、52.4%、49.1%,UV254去除率分别为59.0%、53.6%、48.7%。
功能菌接种于生物活性炭后,BAC生物量和生物活性随着通水倍数的增加而增加,并在挂膜后期基本稳定。投加功能菌的BAC2比自然挂膜的BAC1具有更高的生物量和生物活性,具有更好的TOC、UV254和色度去除效果,这表明功能菌对渗滤液生化出水具有良好的降解能力。
功能菌易于将大分子有机物降解为小分子有机物,改善了BAC处理系统的降解性能。投加功能菌的BAC2反应器对分子量M为100~30 kDa的有机物去除率为76.1%,分子量M>100 kDa的有机物去除率达到80.9%。采用自然挂膜的BAC1反应器对水样中分子量M为10~5 kDa的有机物具有良好的降解能力。BAC2的总 UV254去除率达到66.2%,而BAC1的总 UV254去除率为54.1%。
[1]龙腾锐,易洁,林于廉,等.垃圾渗滤液处理难点及其对策研究[J].土木建筑与环境工程,2009,31(1):114-119.LONG TENG-RUI,YI JIE,LIN YU-LIAB,et al.T reatment difficulties and strategies for landfill leachate[J].Journal of Civil,Architectural&Environmental Engineering,2009,31(1):114-119.
[2]RENOU S,GIVAUDAN J G,POULAIN S,et al.Landfill leachate treatment:Review and opportunity[J].Journal of Hazardous Materials,2008,150(3):468-493.
[3]YEE NAH LIM,M D GHAZA LY SHAABAN,CHUN YANG YIN.Treatment of landfill leachate using palm shell-activated carbon column:Axial dispersion modeling and treatment profile[J].Chemical Engineering Journal,2009,146(1):86-89.
[4]IMAI A,ONUMA K,INAMORI Y,et al.Biodegradation and adsorption in refractory leachate treatment by the biological activated carbon fluidized bed process[J].WaterResearch,1995,29(2):687-694.
[5]张宝安,张宏伟,张雪花,等.生物活性炭技术在水处理中的研究应用进展[J].工业水处理,2008,28(7):6-8.ZHANG BAO-AN,ZHANG HONG-WEI,ZHANG XUE-HUA,et al.Development of the application of biological activated carbon to water treatment[J].Industrial Water Treatment,2008,28(7):6-8.
[6]邱忠平,杨立中,刘丹,等.优势菌株对垃圾渗滤液COD的降解特性[J].西南交通大学学报,2006,41(2):264-268.QIU ZHONG-PING,YANG LI-ZHONG,LIU DAN,et al .Performances ofdominant straints for degradation of COD in Leachate[J].Journalof SouthwestJiaoTyong University,2006,41(2):264-268.
[7]姚国,王建卫.污水色度的测定[J].理化检验-化学分册,2008,44(1):61-62.YAO GUO,WANG JIANG-WEI.Determination of colority of sewage water[J].PTCA Part B:Chem.Anal.,2008,44(1):61~62.
[8]魏谷,于鑫,叶林,等.脂磷生物量作为活性生物量指标的研究[J].中国给水排水,2007,23(9):1-4.WEI GU,YU XIN,YE LIN.Study on lipid-P as viable biomass indicator[J].China W.Ater.&W Astew.Ater,2007,23(9):1-4.
[9]朱小彪,许春华,高宝玉,等.曝气生物滤池生物量和生物活性的试验研究[J].环境科学学报,2007,27(7):1135-1140.ZHU XIAO-BIAO,XU CHUN-HUA,GAO BAOYU,et al.Studies of biomass and microbial activity in a biologicalaerated filter [J].Acta Scientiae Circumstantiae,2007,27(7):1135-1140.
[10]梁文艳,王珂,阮清鸳,等.TTC-脱氢酶还原法测定铜绿微囊藻活性[J].环境科学学报,2008,28(9):1745-1750.LIANG WENYAN, WANG KE, Viability determination ofMicrocystis aeruginosa by TTC-dehydrogenase assay.Acta Scientiae Circumstantiae,2008,28(9):1745-1750.
[11]顿咪娜,胡文容,裴海燕,等.脱氢酶活性检测方法及应用[J].工业水处理,2008,28(10):1-4.DUN MI-NA,HU WEN-RONG,PEI HAI-YAN,et al.Determination of dehydrogenase activity and its applica-tion[J]..Industrial Water Treatment,2008,28(10):1-4.
[12]VERSALOVICJ,KOEUTH T,LUPSKIJR.Distribution of repetitive DNA sequences in eubacteria and application to finerpriting of bacterial enomes[J].Nucleic Acids Res,1991,19(24):6823-6831.
[13]薛峻峰,何品晶,邵立明,等.高氨氮难降解渗滤液电解氧化处理的特性[J].同济大学学报:自然科学版,2005,33(12):1630-1634.XUE JUN-FENG,HE PIN-JING,SHAO LI-MING,et al.Study on characteristics of refractory leachate with high NH3-N concentration by electrolytic oxidation[J].Journal of Tongji University:Natural Science.2005,33(12):1630-1634.
[14]乔春光,魏群山,王东升,等.典型南方水源溶解性有机物分子量分布变化及去除特性[J].环境科学学报,2007,27(2):195-200.QIAO CHUNGUANG,WEI QUNSHAN,WANG DONGSHENG,et al.Molecular weight distribution and removal characters of DOM in the typical source waterin south of China [J].Acta Scientiae Circumstantiae,2007,27(2):195-200.
[15]THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The Clustal_X windows interface:flexible strategies formultiple sequence alignmentaided by quality analysis tools[J].Nucleic Acids Research,1997,25(24):4876-4882.
