磷酸泰乐菌素脂质体的制备及体外释放动力学研究
2010-11-14符华林戴玉娇
符华林,戴玉娇
(四川农业大学动物医学院药学系,四川雅安 625014)
泰乐菌素是从弗氏链霉菌的培养液中提取获得的一种大环内酯类动物专用型抗生素,主要作用于革兰氏阳性菌和支原体,对部分革兰氏阴性菌、螺旋体、球虫和某些真菌都有不同程度的抑制作用[1]。作为治疗药物,泰乐菌素广泛用于畜禽支原体疾病、细菌性疾病、螺旋体病和寄生虫病等的防治,特别是其强烈的抗支原体特性,使其成为治疗畜禽支原体疾病的首选药物;泰乐菌素作为饲料药物添加剂,广泛添加于鸡、猪、牛等的饲料中,能促进动物生长发育,提高饲料利用率。在生产实践中,常使用其盐类 -酒石酸泰乐菌素和磷酸泰乐菌素[2]。由于泰乐菌素消除半衰期较短,体内分布广泛,常规剂型酸度大、给药频繁,且肌注对局部刺激性较大,易造成动物的应激反应,因而一定程度上限制了它在临床上的应用效果[3]。
脂质体是靶向给药系统的一种药物新剂型,该剂型具有靶向、缓释、低毒、低残留、无免疫原性等特点,可以包裹水溶性和脂溶性两类药物。药物经脂质体包载后,可以延长药物的半衰期,提高治疗指数,达到缓控释及靶向的目的[4]。为改善药物在体内的药动学特征,提高生物利用度,延长作用时间,减少给药次数,笔者将磷酸泰乐菌素制成脂质体剂型,并以包封率为指标,对脂质体的处方组成和工艺进行了优化,以期获得较高的包封率。同时对其理化性质及体外释放行为进行了初步评价。
1 仪器与试药
1.1 仪器 旋转蒸发器 RE-2000,上海亚荣生化仪器厂;HZS-H水浴振荡仪,哈尔滨市东明医疗仪器厂;数显恒温水浴锅 HH-2,常州国华电器有限公司;岛津 LC-2010C HT高效液相色谱系统,岛津国际贸易上海有限公司;D-37520osterode高速冷冻离心机,美国科峻仪器公司;H-6010型透射电子显微镜,日本日立公司;Mastersizer 2000型激光散射粒度分析仪,英国 Malvern公司。
1.2 试药 磷酸泰乐菌素原料药,西安亨通光华制药有限公司,效价 830 u/mg;注射用大豆卵磷脂(SPC)成都市科龙化工试剂厂;胆固醇(CH),成都市科龙化工试剂厂;硫酸铵、氯化钠、磷酸二氢钾、氢氧化钠、高氯酸钠、盐酸、氯仿、异丙醇,均为分析纯;甲醇、乙腈,均为色谱纯;自制双蒸水。
2 方法
2.1 磷酸泰乐菌素脂质体的制备
2.1.1 制备方法的筛选 根据磷酸泰乐菌素的理化性质,采用不同的方法制备磷酸泰乐菌素脂质体,以包封率为指标,筛选最佳制备方法。
2.1.1.1 薄膜分散法(thin film dispersionmethod,TFV) 将 SPC和 CH按质量 4∶1的比例混合,加适量氯仿溶解,减压蒸发,制备磷脂膜后,加入含 2 mg/m L磷酸泰乐菌素的 pH7.0磷酸盐缓冲液(PBS)水化脂膜,继续减压蒸发至氯仿完全除尽,即得磷酸泰乐菌素脂质体。
2.1.1.2 乙醚注入法(ether injection,EI) 将 SPC和 CH按质量比 4∶1的比例混合,加适量乙醚溶解得类脂溶液(油相),将油相缓慢匀速地注入到磁力搅拌的 50℃含 2mg/m L磷酸泰乐菌素的 PBS溶液中,继续恒温搅拌至无乙醚味,即得脂质体混悬液。
2.1.1.3 逆相蒸发法(reverse-phase evaporation method,REV) 将 SPC和 CH按质量比 4∶1的比例混合,加适量氯仿溶解(油相),加入含 2 mg/m L磷酸泰乐菌素的 PBS溶液(水相),两相体积比为3∶1,短时超声得稳定的 W/O型乳剂,减压蒸发至瓶壁上形成凝胶,滴加 PBS溶液,继续蒸发除尽氯仿,即得脂质体。
2.1.1.4 硫酸铵梯度法(ammonium sulfate gradient method,ASG) 将 SPC和 CH按质量比 4∶1的比例混合,加适量氯仿溶解,减压蒸发,制备磷脂膜后,加入 300mmol/L的硫酸铵溶液水化得到空白脂质体。将空白脂质体依次通过 0.8μm、0.45μm和 0.22μm的微孔滤膜,进行整粒。整粒后的脂质体装入透析袋中,于0.9%生理盐水中 37℃恒温透析 6 h,透析后的脂质体中加入含 2 mg/mL磷酸泰乐菌素的 PBS溶液,50℃孵化 20 min,取出即得磷酸泰乐菌素脂质体。
2.1.2 单因素考察制备工艺和处方 通过 2.1.1项的比较与筛选,选择包封率最高的硫酸铵梯度法制备磷酸泰乐菌素脂质体。分别考察载药体系不同 pH值 (5.0,6.0,7.0,8.0)、孵化温度 (30,40,50,60℃)、孵化时间 (5,10,20,30 min)、药脂比(1∶2,1 ∶4,1 ∶8,1 ∶10,1 ∶15,1 ∶20)、磷脂与胆固醇质量比 (10∶1,8∶1,4∶1,2∶1,1∶1)及硫酸铵浓度(100,200,250,300,400 mmol/L)等对包封率的影响。
2.1.3 正交设计优化处方组成 根据单因素考察结果,选取磷脂与胆固醇之比(A)、药脂比(B)和硫酸铵浓度(C)3个主要因素,每个因素各拟 3个水平,根据正交试验表 L9(34)设计实验(表 1),以脂质体包封率为考察指标,采用硫酸铵梯度法制备脂质体,筛选最佳处方组成。
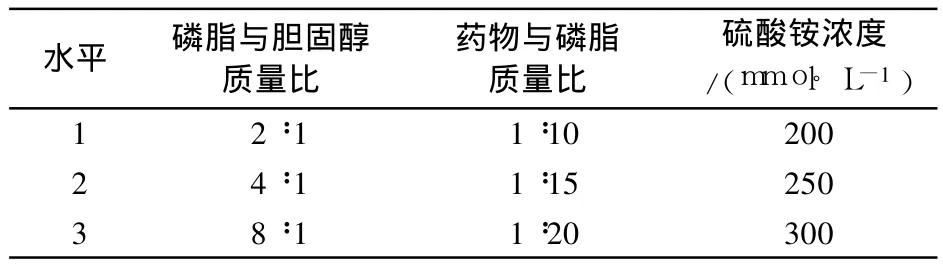
表1 正交实验的因素和水平
2.2 脂质体中磷酸泰乐菌素的含量测定(HPLC)
2.2.1 色谱条件[3,5-6]色谱柱为 KromasilC18柱(4.6mm×150 mm,5μm);流动相为 0.05 mol/L高氯酸钠溶液 pH(3.0±0.1)-乙腈(65∶35,V/V);柱温为 30℃;流速为 1.0mL/m in;检测波长为 290 nm;进样量为 20℃。理论塔板数按泰乐菌素 A组分色谱峰计,应不低于 2 000,各杂质峰与泰乐菌素 A峰的分离度应符合要求。
2.2.2 标准曲线的制备 精密称取适量经 60℃减压干燥至恒重的磷酸泰乐菌素精制品,用流动相配成一定浓度的药物溶液。准确量取上述溶液适量,用流动相配成浓度为 5.0,10.0,20.0,40.0,80.0,160.0,320.0μg/mL的系列溶液,分别进样测定,记录峰面积 A,求标准曲线方程。
2.2.3 回收率与精密度试验 精密吸取一定量空白脂质体混悬液,依次准确加入适量浓度为 1 mg/mL的磷酸泰乐菌素标准溶液和异丙醇,用流动相溶解并稀释成 10.0,80.0,160.0μg/mL三个低、中、高浓度的样品溶液,分别进样,记录峰面积,计算回收率。1 d内测定 5次,求得日内精密度;1 d 1次,连续测定 5 d,求得日间精密度。
2.2.4 含量测定 精密吸取磷酸泰乐菌素脂质体0.5m L(相当于磷酸泰乐菌素1.0mg),置于 25 mL容量瓶中,加入适量异丙醇破乳,用流动相溶解并稀释至刻度,进样分析,记录峰面积,代入标准曲线方程,计算磷酸泰乐菌素的含量。
2.3 脂质体包封率测定 采用低温高速离心法[7]分离磷酸泰乐菌素脂质体和游离药物,HPLC法测定药物浓度。精密量取脂质体 1 mL于聚丙烯离心管中,4℃,12 000 r/min,离心 45min。准确移取上清液 0.5mL,流动相稀释至 25mL,进样测定,记录峰面积,代入标准曲线计算游离药物浓度 C游。另取 0.5m L脂质体于 25 mL容量瓶中,异丙醇破乳,流动相稀释并定容,进样测定,记录峰面积,代入标准曲线计算总药物浓度 C总,按下式计算:包封率 =(1-C游/C总)×100%。
2.4 脂质体形态、粒径及其分布 取脂质体混悬液适量,加入 PBS缓冲液稀释,采用激光散射粒度分析仪测定粒径及其分布。另取适量脂质体混悬液置于铜网上,滴加 2%磷钨酸溶液负染,自然挥干后,用透射电镜观察粒子的形态。
2.5 体外释放动力学 采用动态透析法进行体外释放实验[8]。精密移取脂质体 2 m L,装入经处理过的透析袋内,置于 100m L pH 7.0 PBS溶液中,温度控制在(37±1)℃,转速为 100 r/min。定时吸取透析液 5 m L,并及时补充等量恒温的 PBS溶液。另取 2 mL脂质体于 100m L容量瓶中,加入适量异丙醇破乳,流动相稀释至刻度,作为总药量。同时取药物的 PBS溶液 2 mL于透析袋内作为对照。样品经稀释过滤后,用高效液相色谱法测定药物浓度,计算累积释放百分量 Q,绘制累积释放曲线。
3 结果与讨论
3.1 脂质体制备方法的筛选 采用不同方法制备磷酸泰乐菌素脂质体,其包封率测定结果见表 2。

表2 不同方法制备脂质体的包封率测定结果
由结果可知,硫酸铵梯度法制备的脂质体包封率明显高于其他三种方法。根据药物装载机制的不同,脂质体的制备可分为被动载药法和主动载药法[9-10]。对脂溶性或水溶性好的药物,被动载药法如薄膜分散法、逆向蒸发法、注入法等较为适用;而对于两亲性药物,其油水分配系数受介质 pH和离子强度的影响较大,主动载药法,如 pH梯度法、硫酸铵梯度法,利用此类药物能以电中性形式跨越脂质双层,而其电离形式却不能跨越的原理,通过形成脂质体内外水相跨膜的离子或化合物梯度,使外水相的药物自发地向内部聚集,使药物稳定地包封于脂质体内部,不易泄漏。主动载药法广义上是指pH梯度法,硫酸铵梯度法是 pH梯度法的一种,即通过硫酸铵梯度诱导产生 pH梯度,从而实现对弱碱性药物的包封[11],如磷酸泰乐菌素。因此,最终确定选用硫酸铵梯度法制备磷酸泰乐菌素脂质体,以提高包封率和稳定性。
3.2 单因素考察结果 采用硫酸铵梯度法制备磷酸泰乐菌素脂质体,对制备过程中影响包封率较大的因素进行考察,结果见表 3。

表3 各因素对包封率的影响(n=3)
由表 3可知,pH7.0时包封率最高。在一定pH范围内,磷酸泰乐菌素的 logP随 pH增大而增大,药物以分子态存在,更易跨过双分子层进入内水相。超过该 pH,包封率下降,可能与药物性质及磷脂稳定性有关。50℃时孵化最完全,载药最快,5min有 50%以上的药物进入脂质体,20min达到最大值,随着时间的延长,包封率有下降的趋势,可能是长时间的作用,使膜流动性增加,部分药物泄漏。药脂比为 1∶10时包封率相对最高。投药量过多,超出了磷脂的承载能力,则无法形成稳定合格的脂质体。一般而言,药脂比越小,包封率越大[12]。磷脂与胆固醇质量比为 4∶1时,包封率最大。胆固醇量越大,包封率反而下降,甚至很难形成脂质体,主要是由于药物是嵌入双分子膜之间的,脂质量相同时,胆固醇的加入,使膜的刚性增强,曲率、总表面积变小,从而使包封药量减少[13]。随着硫酸铵浓度的增大,包封率逐渐升高。浓度越大,间接产生的 pH梯度和驱动力越大,药物进入内水相的量就越多,包封率也就越高。但是过高的浓度会导致脂质体内外的渗透压差过大,在储存和使用中易引起磷脂膜破裂而导致药物渗漏,包封率下降[10-11]。
综合以上实验结果,确定最佳工艺条件为:载药时体系 pH为 7.0,孵化温度为 50℃,孵化时间为20m in。
3.3 正交试验结果 最佳制备处方为:药脂比为1∶10,磷脂与胆固醇之比为 4∶1,硫酸铵浓度为 300 mmol/L。极差分析说明,药脂比对包封率的影响最大。正交试验结果见表 4。

表4 正交实验结果
3.4 含量测定方法的考察 HPLC是文献报道中测定磷酸泰乐菌素含量最普遍的一种方法[5-6,14]。在所选定的色谱条件下,磷酸泰乐菌素各组分峰与辅料及溶剂峰分离良好,磷酸泰乐菌素在 5.0 μg/mL~320.0μg/mL浓度范围内与峰面积呈良好线性关系,回归方程为 A=9890.364C+2431.2701(r=0.999 9)。高、中、低三个浓度的平均回收率在 99.86%~100.06%之间,日内 RSD及日间 RSD均小于 2%(n=5),测得药物平均含量为100.05%。由此可见,该方法可排除辅料及溶剂等的干扰,回收率高,简单快速,重现性好,结果准确可靠,适合于磷酸泰乐菌素脂质体含量及包封率的测定。

图1 磷酸泰乐菌素脂质体透射电镜照片(80.0×1000)
3.5 脂质体的理化性质 按最优的处方工艺制备的脂质体,电镜下观察呈球形或类球形,规则均匀(图 1)。平均粒径为 6.526μm,1μm~12μm范围内的粒子占总数的 90.3%以上(粒度分布见图 2)。包封率为 58.32%。测定包封率时,通常先将游离药物与脂质体进行分离,常用的分离方法有[15-16]:葡聚糖凝胶过滤法、高速离心法和透析法等。由于所制备的脂质体粒径较大,分子量较高,在 4℃,12 000 r/min,45 min的低温高速离心条件下,脂质体可与游离药物完全分开,且破坏较少。该方法回收率高,方便快捷,可用于磷酸泰乐菌素脂质体包封率的测定。

图2 磷酸泰乐菌素脂质体粒径分布图

图3 磷酸泰乐菌素溶液与脂质体的体外释放动力学曲线(n=3)

表6 磷酸泰乐菌素脂质体与溶液动力学方程
3.6 体外释放结果 磷酸泰乐菌素溶液和磷酸泰乐菌素脂质体的累积释放率见表5,释放曲线见图3。
从结果中可以看到,药物溶液在 8 h内已基本释放完全。而脂质体在 8 h时累积释放率约为51.25%,表现出缓释作用。将两者的体外释药数据分别与零级动力学方程、一级动力学方程、Higuchi方程及 Weibull方程相拟合,结果见表 6。
根据以上回归方程及相关系数可知,r值均大于自由度V=n-2=10,a=0.01时的相关系数临界值 r=0.708[17],表明各方程均显著相关,可用这些方程描述磷酸泰乐菌素脂质体的体外释药规律。
结果显示,磷酸泰乐菌素溶液的体外释药过程可用 Higuchi方程描述,8 h内药物已基本释放完全。而脂质体则更好地符合 Weibu ll方程。药物的释放可分为前期相对较快和后期相对缓慢的两个释药过程。前期的快速释药过程主要是由于脂质体外未包封的药物首先释放出来,而脂质体内的药物要跨过双分子层才能进入介质。脂质体作为储备系统,可缓慢释放药物。因此,将磷酸泰乐菌素制成脂质体剂型,可以获得较为明显的缓释效果。
4 小结
首先采用不同方法制备磷酸泰乐菌素脂质体,选择包封率较高的硫酸铵梯度法作为最终的制备方法。通过单因素考察,正交试验优化得到了最佳的制备工艺和处方,并对其理化性质及体外释放特性进行了考察。按此方法制备的脂质体形态均匀,包封率高,稳定性好。药物经脂质体装载后,呈现较为明显的缓释作用,为磷酸泰乐菌新制剂的研究提供了剂型参考。
[1] 陈杖榴.兽医药理学[M].北京:中国农业出版社,2001:221-222.
[2] 葛 蔚,张 莉,董越春.泰乐菌素的药用性能及促生长作用[J].兽药与饲料添加剂,2000,5:14.
[3] 李英伦,张福华,谢 君.复方泰乐菌素注射液的药代动力学研究[J].四川农业大学学报,1998,20(2):256-257.
[4] 王 弘,吴梧桐,顾学裘.脂质体作为生物大分子载体的研究[J].药物生物技术,2002,9(3):171-174.
[5] 陈建军,张广胜,李京士,等.HPLC法测定酒石酸泰乐菌素及利巴韦林可溶性粉含量[J].河北畜牧兽医,2002,4(10):19.
[6] Prats C,E L Korchl G,Francesch R,et al.Disposition Kinetics of Tylosin Administered Intravenously and Intramuscularly to Pigs[J].Res Vet Sci,2002,41(73):141-144.
[7] 刘利萍,胡六江,周晓芬.HPLC法测定阿达帕林脂质体中药物含量及包封率[J].药物分析杂志,2007,27(9):1462-1465.
[8] 孙维彤,张 娜.托氟啶脂质体的研究[J].中国药学杂志,2007,42(6):445-449.
[9] 苗彩云,邓树海,李艳辉.主动载药法制备两亲性药物脂质体的研究进展[J].中国医药工业杂志,2005,36(7):433-437.
[10]徐力昆,曹德英.主动载药法制备药物脂质体的研究与应用[J].河北医科大学学报,2005,26(5):390-392.
[11]Haran G,Cohen R,Bar L K,et al.Transmembrane Ammonium Sulfate Gradients in Liposomes Produce Efficient and Stable Entrapment of Amphipathic Weak Bases[J].Biochim Biophys Acta,1993,1151(2):201-215.
[12]Bangham A D,Standish M M,Watkins J C,et al.Diffusion of Univalent Ions Across the Lamellae of Swollen Phospholipids[J].JMol Biol,1965,13:238-252.
[13]胡兰荣,翟 原,郑昌学.掺入胆固醇和阴离子磷脂对阿霉素免疫脂质体性能的影响[J].生物物理学报,1991,7(4):524-529.
[14]孔 科,袁宗辉,范盛先,等.高效液相色谱法检测泰乐菌素在肉鸡组织中的残留[J].中国兽医学报,1999,15(5):489-491.
[15]于波涛,张志荣,刘文胜.提高脂质体包封率的方法及其研究进展[J].中国医药工业杂志,2002,33(11):564-568.
[16]DIPALI S R,Kulkavni S B,Betageri G V,et al.Comparative Study ofSeparation of Non-encapsulated Drug from Unilamellar Liposomes by Various Methods[J].JPharm Pharmacol,1996,48(11):1112.
[17]Ammoury N,FessiH,Devissaguet JP,et al.In vitro Release Kinetic Pattern of Indomethacin from Poly(d,lactic)nanoCapsules[J].JPharm Sci,1990,79:763.
