隐孢子虫对宿主细胞凋亡的调控机制研究进展
2010-11-14逯兆喜陈盛霞曹建平
逯兆喜,吴 亮,陈盛霞,曹建平
隐孢子虫(Cryptosporidium spp.)是一种在世界范围内广泛流行的人兽共患寄生虫。隐孢子虫感染人类后,主要寄生于消化道上皮细胞,引起隐孢子虫病(cryptosporidiosis),症状包括腹痛、腹泻和消瘦等,是WHO认定的6种常见感染性腹泻的病因之一。免疫功能正常患者,腹泻通常呈自限性,2~3w可自行消失;但免疫功能低下(婴幼儿)和免疫功能缺陷(AIDS等)患者的腹泻则会导致严重后果,甚至可致死亡〔1〕。细胞凋亡作为清除胞内病原体的一种有效措施,在宿主对抗病原体感染中具有重要作用。同时,许多胞内寄生虫,如弓形虫、疟原虫、利什曼原虫、隐孢子虫等可采用多种手段调控宿主细胞凋亡从而有利于其寄生生活〔2〕。本文对隐孢子虫调控宿主细胞凋亡的机制进行综述。
1 隐孢子虫调控宿主细胞凋亡及意义
凋亡是细胞死亡的内在机制,受多种信号通路调节,在清除受损细胞、维持内环境稳定及促进机体成熟过程中起重要作用。此外,凋亡作为一种重要的防御机制,可对抗病毒、细菌及寄生虫感染。
Chen等首次报道微小隐孢子虫(C.parvum)感染可致胆管上皮细胞凋亡〔3〕。Ojcius等报道微小隐孢子虫感染HCT-8(human ileocecal adenocarcinoma cell line,人回盲肠腺癌细胞系)细胞后,可致细胞凋亡,且凋亡率随虫体感染量的增加而增加〔4〕。Widmer等研究表明微小隐孢子虫感染可致MDBK(Madin Darby bovine kidney,牛肾细胞)及 HCT-8细胞凋亡,并降低细胞贴壁能力。当培养液中加入Caspase(半胱氨酸蛋白酶)抑制剂后,细胞脱落量显著减少,但未增加细胞中虫体数量;而用层粘连蛋白包被的培养板时,可减少细胞脱落量并增加细胞感染率。这说明感染早期细胞脱落及凋亡不利于隐孢子虫存活〔5〕。McCole等研究发现微小隐孢子虫感染Caco-2(colonic adenocarcinoma cell line,结肠腺癌细胞系)和HCT-8细胞后,可致细胞中度凋亡,但可抑制星状孢子素、依托泊苷和5-氟尿嘧啶等凋亡诱导剂所致的细胞凋亡〔6〕。Liu等研究表明微小隐孢子虫感染早期(6 h和12 h)抗凋亡基因上调,促凋亡基因下调;感染晚期(24、48和72 h)促凋亡基因上调,抗凋亡基因下调〔7〕。此外,Sasahara等研究发现微小隐孢子虫可致小鼠回肠上皮细胞凋亡〔8〕。
由此可见,隐孢子虫可通过调控宿主细胞凋亡,以促进自身发育和增殖。此外,微小隐孢子虫感染所致细胞凋亡可能与爱滋病患者硬化性胆管炎的发病机制有关〔3〕;并可能破坏细胞间紧密连接及细胞屏障功能,增加肠粘膜通透性,致患者严重腹泻,甚至死亡〔9-10〕。
2 隐孢子虫感染宿主细胞凋亡的调控机制
目前已知的参与隐孢子虫调控宿主细胞凋亡相关的因子主要包括Fas/FasL 、Caspases、核因子-κ B(nuclear factor-kappa B,NF-κ B)以及 Tat(transactivator of transcription,Tat,反式转录激活因子)蛋白、生存素、骨保护素和表皮生长因子等其他凋亡相关因子。
2.1 Fas/FasL在隐孢子虫调控宿主细胞凋亡中的作用 死亡受体Fas(又称APO-1/CD 95) 属于肿瘤坏死因子α受体家族成员,FasL(Fas ligand)为Fas的配体。Fas/FasL是目前研究得较清楚的外源性凋亡途径。Fas具有3个富含半胱氨酸的胞外区和1个称为死亡结构域(Death domain,DD)的胞内区。FasL与 Fas结合后,Fas三聚化使胞内的DD区构象改变,与接头蛋白FADD(Fas-associated death domain,Fas相关死亡结构域)的DD区结合;而后FADD的N端DED(death effector domain,死亡效应结构域)区与Caspase 8(或10)前体蛋白结合,形成 DISC(death-inducing signaling complex,死亡诱导信号复合物)。富集在一起的Caspase 8前体可在其大小亚基之间进行切割,产生有活性的Caspase 8,启动 Caspase级联反应,使 Caspase 3、6、7激活。这3种Caspase可降解胞内结构蛋白和功能蛋白,最终导致细胞凋亡〔11〕。已有研究表明Fas/FasL在原虫(如刚地弓形虫、克氏锥虫等)调节宿主细胞凋亡中发挥重要作用。
Chen等报道微小隐孢子虫感染H69细胞24 h,经 DAPI(4',6-diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚)染色可见凋亡细胞,且细胞凋亡率明显高于对照组。在感染后的24 h内,细胞凋亡率随虫体感染量及感染时间的增加而增加。若在微小隐孢子虫感染前30 min将培养基换为含Fas/FasL抗体或Caspase抑制剂的培养基,虫体感染24 h和48 h后细胞凋亡率显著减少,Caspase抑制剂对细胞凋亡的抑制率达80%。这表明Fas/FasL途径是微小隐孢子虫致细胞凋亡的主要机制。进而经Western blotting证实微小隐孢子虫感染6 h,FasL表达量降低;而感染12 h和24 h FasL表达量显著增加;Fas表达量仅在感染24 h显著增加。研究还发现当微小隐孢子虫感染的H69细胞与未感染的Fas敏感的Jurkat E6-1细胞共培养24 h后,Jurkat E6-1细胞凋亡率显著增加,而FasL抗体可完全抑制此细胞的凋亡;当Fas抗性的Jurkat JM-3A5细胞与隐孢子虫感染的 H69细胞共培养时,Jurkat JM-3A5细胞凋亡率未见增加。此外,免疫细胞化学技术及激光共聚焦显微镜检测结果表明,微小隐孢子虫可增加FasL的膜迁移,并诱导细胞膜表面FasL裂解为sFasL(soluble FasL,可溶性FasL),进而导致Jurkat E6-1细胞凋亡。由此推测微小隐孢子虫通过自分泌和旁分泌途径,以Fas/FasL依赖机制诱导胆管上皮细胞凋亡(图1〔12〕)。
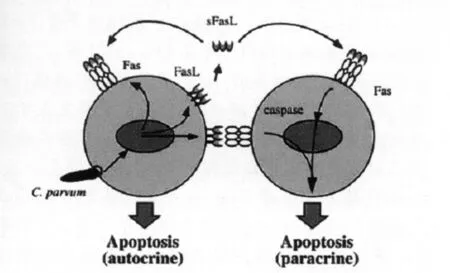
图1 微小隐孢子虫诱导胆道上皮细胞凋亡模型Fig.1 Schematic model of C.parvum-induced apoptosis in biliary epithelial cells
Motta等报道微小隐孢子虫感染HCT-8细胞24 h后,感染虫体的细胞膜表面FasL表达量显著增加;而未感染虫体的细胞,其膜表面FasL表达量未见改变。此外,小鼠模型实验显示微小隐孢子虫感染第16d,小肠上皮细胞FasL表达量显著增加。当以微小隐孢子虫感染野生型及lpr(lymphoproliferative disorder,淋巴增生性障碍)小鼠时,感染第14d CD4+细胞缺陷的野生型小鼠体重减轻,而后随着感染时间延长体重增加,但增加速度低于对照组;而lpr及CD4+细胞缺陷lpr小鼠感染后体重增加,两者之间无显著性差异。这表明Fas蛋白表达可影响CD4+细胞缺陷的野生型小鼠的体重,故推测Fas依赖的未感染细胞的凋亡加剧隐孢子虫病所致的体重减轻〔13〕。
Mele等以抗体标记实验,经流式细胞仪分选微小隐孢子虫感染及未感染细胞,结果显示FasL仅在感染后2 h和24 h的感染细胞中表达,而Fas在感染及未感染细胞中表达量无显著差异。由此可见,微小隐孢子虫通过Fas受体下游效应酶调控细胞凋亡〔14〕。
2.2 Caspase级联反应在隐孢子虫调控宿主细胞凋亡中的作用 Caspase属于半胱氨酸蛋白酶,是细胞凋亡反应的重要组成部分。Caspase参与的细胞凋亡反应一般分为两类。一类是Caspase启动酶 ,包括 Caspase 2 、8、9 、10,位于 Caspase 级联活化途径上游,可通过蛋白质与蛋白质相互作用自我激活。另一类是 Caspase效应酶,包括 Caspase 3、6、7,位于整个凋亡信号的下游,多种来自上游的信号最终都汇集于此。此酶可被Caspase启动酶激活,进而降解胞内蛋白,使细胞不可逆地走向死亡〔15〕。
Ojcius等以 DAPI、流式细胞术及 DNA ladder实验证实微小隐孢子虫感染HCT-8后,细胞发生凋亡。在微小隐孢子虫(卵囊/细胞为1∶1)感染前30 min加入Caspase抑制剂Z-VAD-FMK后,可抑制细胞凋亡,增加细胞感染率。这表明Caspase参与微小隐孢子虫感染所致的细胞凋亡〔4〕。Mele等研究显示微小隐孢子虫感染 HCT-8细胞后,Caspase 3活性在2 h显著增加,24 h减少,48 h再次增加,54 h达高峰。经流式细胞仪分选感染及未感染细胞后,测得Caspase 3活性在2 h时感染细胞中较高,未感染细胞较低;而在24 h时则相反。这说明在微小隐孢子虫感染后的不同时间,Caspase 3活性不同,因而细胞凋亡率也存在差异。同时,通过免疫组化证实感染后6h、24 h、48 h和 72 h,微小隐孢子虫的发育阶段分别为卵囊和子孢子、滋养体和裂殖体、裂殖体和裂殖子、裂殖子和雄配子体期。由此推测隐孢子虫在发育的不同时期,通过调节宿主细胞凋亡基因的表达,抑制或促进细胞凋亡,以维持自身生存〔14〕。
Liu等研究发现微小隐孢子虫感染HCT-8细胞24 h后Caspase 4、3、6活性增加,48 h后其活性降低;加入Caspase抑制剂未影响细胞感染率,但可显著降低细胞凋亡率;而降低虫体感染量(卵囊/细胞为10∶1),Caspase抑制剂可显著降低细胞感染率。以星状孢子素处理未感染HCT-8细胞2 h,其细胞凋亡率为60%,Caspase 3/7活性增加7倍;而微小隐孢子虫感染HCT-8细胞24 h,Caspase 3/7活性仅增加 2.5倍;然而当微小隐孢子虫感染HCT-8细胞24 h后,再以星状孢子素处理细胞2 h,Caspase 3/7活性未见增加。这表明微小隐孢子虫可抑制星状孢子素诱导Caspase 3/7的激活。由此推测微小隐孢子虫可通过激活Caspase介导细胞凋亡,但也可抑制肠上皮细胞Caspase的激活。此外,研究还发现微小隐孢子虫感染HCT-8细胞24 h和48 h,裂殖体和裂殖子数量无明显改变,但滋养体数量增加;而当加入Caspase抑制剂后,子孢子数量显著增加,裂殖体数量显著减少,滋养体数量仅在感染的24 h显著增加。由此推测激活Caspase是微小隐孢子虫生长所必须的,在感染晚期,抑制细胞凋亡和/或抑制Caspase可阻碍微小隐孢子虫的正常发育〔7,16〕。
2.3 NF-κ B在隐孢子虫调控宿主细胞凋亡中的作用 NF-κ B是一种核蛋白因子,几乎存在于所有细胞。静息状态下 ,NF-κ B 与 Iκ B(inhibitor of NF-κ B,NF-κ B抑制蛋白)以非活性形式存在于胞浆中;细胞受刺激后,IKK(Iκ B kinase,Iκ B 激酶)被激活,Iκ B经快速磷酸化、泛素化后降解,使NF-κ B游离于胞浆中,并迅速转入到细胞核内,与特定基因的启动子区域结合,启动基因转录,调节细胞功能。Iκ Bα是NF-κ B最重要的调节因子,可抑制 NF-κ B的激活。当病原体(如小泰勒虫)侵袭时,核转录因子的激活在胃肠上皮细胞免疫反应中发挥重要作用。在上皮细胞免疫或炎症反应中,转录因子NF-κ B家族可激活多种基因,如 IFN-γ(interferon-γ,γ干扰素)、IL-8(interleukin-8,白细胞介素 8)等〔17〕。NF-κ B还可激活某些胞内生存信号,如原癌基因(c-Myc)、凋亡抑制蛋白(inhibitor of apoptosis,IAP)等,在抑制 TNF-α、Fas抗体、射线、化疗药物诱导的细胞凋亡中起重要作用〔18〕。
Chen等以免疫印迹、电泳凝胶阻滞及免疫荧光实验证实,NF-κ B系统激活仅发生于微小隐孢子虫感染的细胞,进而导致Iκ Bα蛋白降解。ELISA 结果显示隐孢子虫感染细胞后,可增加IL-8分泌且具有时间依赖性,而抑制剂MG-132及SN50可分别抑制 Iκ Bα蛋白降解 ,阻止 NF-κ B 与 DNA 结合 ,显著降低IL-8分泌。DAPI染色结果表明微小隐孢子虫感染24 h,细胞凋亡率增加,且MG-132或SN50可显著增加微小隐孢子虫所致H69细胞的凋亡。进一步经微小隐孢子虫多克隆抗体及DAPI染色证实细胞凋亡仅发生于未感染细胞。由此推测微小隐孢子虫感染直接激活NF-κ B/Iκ B途径,抑制感染细胞凋亡,维持自身生存和繁殖;通过旁分泌途径诱导未感染细胞凋亡,限制感染扩散(图2〔18〕)。
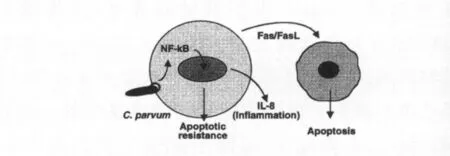
图2 微小隐孢子虫诱导NF-κ B激活、IL-8分泌及胆管上皮细胞凋亡模型Fig.2 Schematic model of C.parvum-induced NF-κ B activation and its relevance to IL-8 secretion from,and associated epithelial apoptosis in biliary epithelial cells
2.4 其他凋亡相关因子在隐孢子虫调控宿主细胞凋亡中的作用
2.4.1 Tat蛋白 Tat蛋白是HIV-1基因组编码的一个重要调控蛋白,含 101个氨基酸残基,是HIV转录和复制所必须,还有旁分泌、促细胞生长、免疫抑制及内化等多种效应〔19〕。Tat蛋白还可抑制沙门氏菌侵入H T-29细胞。此外,表达Tat蛋白的细胞对凋亡刺激更敏感,且协同 T细胞增加FasL表达,激活Fas死亡受体,导致细胞凋亡性死亡〔20〕。
O'Hara等证实 Tat蛋白可增加胞质中FasL表达,而不影响细胞凋亡率及FasL膜迁移,但当微小隐孢子虫感染细胞后,FasL及细胞凋亡率随Tat蛋白浓度的增加而增加,且细胞凋亡主要发生于未感染细胞。经微小隐孢子虫与Tat蛋白共存实验证实,Tat蛋白增加感染细胞中FasL膜迁移及释放。FasL抗体NOK1或Caspase 8抑制剂Z-IETD-fmk可抑制Tat蛋白的作用,减少细胞凋亡率。这表明Tat蛋白以FasL途径促进隐孢子虫诱导的细胞凋亡〔21〕。
2.4.2 生存素 近年发现的凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)是一种重要的抗凋亡因子。目前人类 IAP家族已发现 8个成员:c-IAP1、c-IAP2、NAIP、XIAP、Survivin、ML-IAP,Livin、Bruce(Apollon)和 ILP2。其中生存素(Survivin)是IAP家族中最小的成员,仅有一个半胱氨酸/组氨酸的杆状病毒IAP的BIR功能区,此功能区可直接或间接作用于Caspase,抑制其活性,实现抗凋亡功能〔22〕。
Liu等研究发现凋亡抑制蛋白降低Caspase活性,且与微小隐孢子虫感染抑制宿主细胞凋亡是同步的。通过siRNA技术敲除Survivin或XIAP可致感染24 h和48 h的Caspase 3/7活性显著增加。然而仅敲除Survivin时,感染24 h和48 h细胞凋亡率显著增加。这表明Survivin和 XIAP可抑制Caspase 3/7活性,但仅 Survivin抑制宿主细胞凋亡〔16〕。
2.4.3 骨保护素 骨保护素(osteoprotegerin,OPG)是一种分泌性糖蛋白,为目前已发现的T RAIL(TNF-related apoptosis-inducing ligand,肿瘤坏死因子相关凋亡诱导配体)受体(DR4,DR5,DcR1,DcR2和OPG)中的一种。其中DR4和DR5为死亡受体,可与T RAIL结合,导致相应受体三聚化,通过FADD与胞质中Caspase 8前体蛋白结合,激活 Caspase 系统,诱导细胞凋亡〔21〕;而 OPG,DcR1和DcR2为死亡诱骗受体(death decoy receptor),可竞争性与 TRAIL结合,但缺乏完整的死亡结构域,因此不能诱导细胞凋亡〔23〕。
Gonzalez等研究表明隐孢子虫感染人肠上皮细胞后,OPG基因表达量显著增加,且人隐孢子虫(C.hominis)感染的细胞OPG表达量高于微小隐孢子虫感染的细胞。研究还发现感染火鸡隐孢子虫(C.meleagridis)的志愿者,空肠组织中OPG表达量显著增加。微小隐孢子虫感染HCT-8细胞1 h,OPG mRNA及上清中OPG蛋白表达量增加;感染3 h OPG mRNA表达量显著增加;而感染12 h,OPG mRNA及上清中OPG蛋白表达量与对照组相比无显著差异。这表明OPG mRNA及蛋白分泌增加始于感染早期,抑制细胞凋亡,有利于隐孢子虫完成生活史。而T RAIL可显著降低隐孢子虫感染量,增加细胞凋亡率。由此表明OPG作为一种可溶性诱骗受体与T RAIL结合,抑制细胞凋亡〔24〕。
2.4.4 表皮生长因子 表皮生长因子(epidermal grow th factor,EGF)是由53个氨基酸组成的低分子量(6.4kD)多肽。多种组织如唾液腺、肾脏、小肠、肝脏及胰脏等可分泌EGF。EGF与特异性受体结合后发挥多种生物学效应,如促进细胞增殖、伤口愈合、胃肠功能成熟。曾有研究认为EGF可有效刺激肠道修复,且口服EGF抑制病原微生物在肠道的定居〔25〕。
Buret等经 Hoechst染色证实安氏隐孢子虫(C.andersoni)感染人(SCBN和CacO2)和牛(MDBK和NBL-1)上皮细胞24 h,细胞凋亡率均显著增加。当隐孢子虫感染经 rhEGF(recombinant human EGF,重组人表皮生长因子)预处理的上皮细胞后,24 h细胞感染率显著降低,凋亡率与对照组相比无显著差异。此外,PI(propidium iodine,碘化丙啶)及免疫荧光实验显示EGF不影响安氏隐孢子虫的活力。由此推测,EGF可降低安氏隐孢子虫感染率并抑制其介导的细胞凋亡〔10〕。
3 结 语
隐孢子虫作为一种专性胞内寄生虫,在发育的不同时期抑制或促进细胞凋亡对其生存和繁殖具有重要意义。对隐孢子虫调控宿主细胞凋亡的研究,有助于进一步了解宿主与隐孢子虫之间的关系。然而细胞凋亡是一个复杂的过程,是多种抗凋亡和/或促凋亡因子共同作用的结果。因此,探讨细胞凋亡发生的机制,选择性的抑制或促进细胞凋亡的发生,将为隐孢子虫病治疗提供新途径。
〔1〕〔1〕Mosier DA,Oberst RD.Cryptosporidiosis:a global challenge〔J〕.Ann N Y A cad Sci,2000,916(1):102-111.
〔2〕Heussler VT,Kuenzi P,Rottenberg S.Inhibition of apoptosis by intracellular protozoan parasites〔 J〕.Int J Parasitol,2001,31(11):1166-1176.
〔3〕Chen XM,Levine SA,T ietz P,et al.Cry ptosporidium parvumis cytopathic for cultured human biliary epithelia via an apoptotic mechanism〔J〕.Hepatology,1998,28(4):906-913.
〔4〕Ojcius DM,Perfettini JL,Bonnin A,et al.Caspase-dependent apoptosis during infection withCry ptosporidium parvum〔J〕.Microbes and infect,1999,1(14):1163-1168.
〔5〕Widmer G,Corey EA,Stein B,et al.Host cell apoptosis impairsCryptosporidiumparvumdevelopment in vitro〔J〕.J Parasitol,2000,86(5):922-928.
〔6〕McCole DF,Eckmann L,Laurent F,et al.Intestinal epithelial cell apoptosis followingCryptosporidium parvuminfection〔J〕.Infect Immun,2000,68(3):1710-1713.
〔7〕Liu J,Deng M,Lancto CA,et al.Biphasic modulation of apoptotic pathways inCryptosporidium parvum-infected human intestinal epithelial cells〔J〕.Infect Immun,2009,77(2):837-849.
〔8〕Sasahara T,Maruyama H,Aoki M,et al.Apoptosis of intestinal crypt epithelium afterCryptosporidium parvuminfection〔J〕.J Infect Chemother,2003,9(3):278-281.
〔9〕Roche JK,Martins CA,Cosme R,et al.T ransforming growth factor beta1 ameliorates intestinal epithelial barrier disruption byCry ptosporidium parvumin vitro in the absence of mucosal T ly mphocytes〔J〕.Infect Immun,2000,68(10):5635-5644.
〔10〕Buret AG,Chin AC,Scott KG.Infection of human and bovine epithelial cells withCryptosporidium andersoniinduces apoptosis and disrupts tight junctional ZO-1:effects of epidermal growth factor〔J〕 .Int J Parasitol,2003,33(12):1363-1371.
〔11〕Kischkel FC,Hellbardt S,Behrmann I,et al.Cytotoxicity-dependent APO-1(Fas/CD95)-associated proteins form a death-inducing signaling complex(DISC)with the receptor〔J〕.EMBO J,1995,14(22):5579-5588.
〔12〕Chen XM,Gores GJ,Paya CV,et al.Cryptosporidium parvuminduces apoptosis in biliary epithelia by a Fas/Fas liganddependent mechanism〔J〕.Am J Physiol,1999,277(3 Pt 1):G599-608.
〔13〕 Motta I,Gissot M,Kanellopoulos JM,et al.Absence of weight loss duringCryptosporidiuminfection in susceptible mice deficient in Fas-mediated apoptosis〔J〕.Microbes Infect,2002,4(8):821-827.
〔14〕M ele R,Gomez Morales MA,T osini F,et al.Cryptosporidium parvumat different developmental stages modulates host cell apoptosis in vitro〔J〕.Infect Immun,2004,72(10):6061-6067.
〔15〕Shi Y.M echanisms of caspase activation and inhibition during apoptosis〔J〕.Mol Cell,2002,9(3):459-470.
〔16〕Liu J,Enomoto S,Lancto CA,et al.Inhibition of Apoptosis inCry ptosporidium parvum-Infected Intestinal Epithelial Cells Is Dependent on Survivin〔J〕.Infect Immun,2008,76(8):3784-3792.
〔17〕Li Q,Verma IM.NF-kappaB regulation in the immune system〔J〕.Nat Rev Immunol,2002,2(10):725-734.
〔18〕Chen XM,Levine SA,Splinter PL,et al.Cry ptosporidium parvumactivates nuclear facto r kappaB in biliary epithelia preventing epithelial cell apoptosis〔J〕.Gastroenterology,2001,120(7):1774-1783.
〔19〕艾菁,王丽梅,夏威,等.Tat蛋白结构与功能的研究进展〔J〕.细胞与分子免疫学杂志,2005,21(B03):133-135.
〔20〕Bartz SR,Emerman M.Human immunodeficiency virus type 1 T at induces apoptosis and increases sensitivity to apoptotic signals by up-regulating FLICE/caspase-8〔J〕.J Virol,1999,73(3):1956-1963.
〔21〕O'Hara SP,Small AJ,Nelson JB,et al.The human immunodeficiency virus type 1 tat protein enhancesCryptosporidium parv um-induced apoptosis in cholangiocytes via a Fas ligand-dependent mechanism〔J〕.Infect Immun,2007,75(2):684-696.
〔22〕Johnson ME,Howerth EW.Survivin:a bifunctional inhibitor of apoptosis protein〔J〕.Vet Pathol,2004,41(6):599-607.
〔23〕Emery JG,McDonnell P,Burke MB,et al.Osteoprotegerin is a receptor for the cy totoxic ligand T RAIL〔J〕.J Biol Chem,1998,273(23):14363-14367.
〔24〕Castellanos-Gonzalez A,Yancey LS,Wang HC,et al.Cryptosporidiuminfection of human intestinal epithelial cells increases expression of osteoprotegerin:a novel mechanism for evasion of host defenses〔J〕 .J Infect Dis,2008,197(6):916-923.
〔25〕Playford RJ,Wright NA.Why is epidermal growth factor present in the gut lumen〔J〕.Gut,1996,38(3):303-305.
