灵香草浸膏及其净油的抗氧化活性研究
2010-11-10刘贤贤邹碧群义祥辉
刘贤贤,张 业,覃 雯,邹碧群,2,义祥辉,*
(1.桂林师范高等专科学校化学与工程技术系,广西桂林541001;2.广西师范大学化学化工学院,广西桂林541004)
灵香草浸膏及其净油的抗氧化活性研究
刘贤贤1,张 业1,覃 雯1,邹碧群1,2,义祥辉1,*
(1.桂林师范高等专科学校化学与工程技术系,广西桂林541001;2.广西师范大学化学化工学院,广西桂林541004)
以二苯代苦味酰自由基(DPPH·)法分别测试了灵香草浸膏及其净油的清除自由基活性,然后利用荧光猝灭法分别研究了浸膏、净油与Cu2+、Fe2+的螯合作用。结果表明,灵香草浸膏及其净油均对自由基DPPH·有良好的清除作用,不同溶液的半清除浓度IC50为0.16~0.37mg·mL-1;浸膏、净油对Cu2+、Fe2+表现出良好的螯合作用,净油对Fe2+的螯合作用最强,螯合常数为3.74×102mL·mg-1,浸膏对Fe2+的螯合作用次之,螯合常数为1.56×102mL·mg-1,净油对Cu2+的螯合作用最小,螯合常数为1.20×102mL·mg-1。研究说明灵香草浸膏、净油具有开发成为新型功能性抗氧化剂的潜力。
灵香草,抗氧化,自由基清除活性,螯合作用
灵香草(Lysimachia foenum-graecum Hance)又名零陵香、薰香、排草等,为报春花科排草属植物的全草,系广西大瑶山珍贵的天然香料植物。灵香草提取物具有极其特殊的芳香气息,且香气持久、稳定,属名贵香料,被用于高档烟的加香[1]。此外,医药上其可用于治疗头疼、感冒、驱蛔虫,具有清热、行气、止痛、驱虫等功效[2]。然而,尽管灵香草天然资源丰富,经济价值高,人们对其研究仍主要集中在灵香草化学成分的表征方面[3-4],十八碳二烯酸、十七酸、叶绿醇等是其主要化学成分[3-4],而抗氧化性能的研究则甚少涉及。为了考察灵香草开发成为抗氧化剂的潜力,本文对灵香草的提取物灵香草浸膏、净油的抗氧化能力进行测试,为功能型灵香草抗氧化剂产品的开发提供指导意义。
1 材料与方法
1.1 材料与仪器
灵香草浸膏 棕黑色油状物;净油 棕褐色油状物,二者都易溶于水,均由广西金秀香料香精有限公司提供,冷藏备用;其余试剂(除蒸馏水制备外)均为分析纯。
TU-1901双光束紫外可见分光度计,RF-5301荧光分光光度计,恒温水浴锅,冷冻设备。

表1 浸膏、净油的紫外、荧光光谱参数
1.2 实验方法
1.2.1 紫外、荧光吸收光谱测试 把灵香草浸膏、净油分别配成1mg/mL的水溶液,扫描它们的紫外、荧光吸收光谱。
1.2.2 DPPH法测定抗氧化活性 对DPPH·的清除作用的测定参考文献[5]。将待测灵香草浸膏、净油提取液配制成系列溶液,分别移取各不同浓度的灵香草浸膏、净油提取液的溶液0.1mL加入到3.9mL的DPPH·溶液中,混合均匀,30min后测其吸光度。灵香草浸膏、净油的清除自由基能力采用半抑制浓度IC50值表示。测定待测灵香草浸膏、净油提取液浓度与自由基清除率,并绘制自由基清除率对灵香草浸膏、净油提取液浓度曲线,按式(1)计算IC50值。
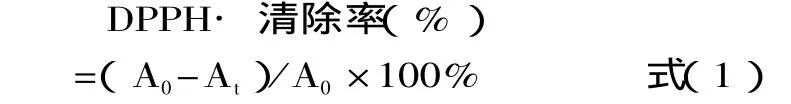
A0与At分别代表自由基在波长为517nm时空白与样品对其作用后的吸光度,然后作图求出线性方程,再通过线性方程把它们对DPPH·自由基清除的半抑制浓度IC50计算出来。
1.2.3 螯合作用测定 分别将灵香草浸膏、净油配成1mg·mL-1的水溶液。然后,把过渡金属离子Cu2+、Fe2+分别配制成不同浓度的水溶液。分别移取各离子不同浓度的溶液0.1mL加入到3.9mL提取物水溶液中,混合均匀后在37℃反应,30min后扫描荧光光谱,由荧光光谱的变化来探讨灵香草浸膏、净油与各金属离子的螯合情况。
2 结果与讨论
2.1 灵香草浸膏及其净油的紫外、荧光吸收光谱
由灵香草浸膏及其净油的紫外吸收光谱(图1A)可知,浸膏的最大吸收波长和最大吸收值分别为λmax=243nm,Amax=4.259;净油的最大吸收波长和吸收值分别为λmax=235nm,Amax=4.136。浸膏、净油的最大吸收峰的位置与酚类化合物的吸收基本一致,说明了浸膏、净油含有大量的酚类化合物[4]。
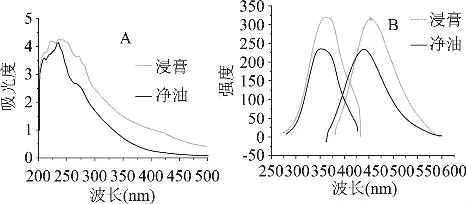
图1 灵香草浸膏、净油水溶液的紫外(A)、荧光(B)吸收光谱
由灵香草浸膏、净油的荧光吸收光谱(图1B)可以看出,浸膏的荧光吸收强度较净油的大;浸膏的激发波长λex=361nm,发射波长λem=454nm,净油的λex=352nm,发射波长λem=440nm,见表1。
2.2 灵香草浸膏、净油清除自由基的作用
随着自由基生物学与自由基医学的迅速发展,现已证明多种疾病的发生和发展与自由基对组织细胞的损伤关系密切[6]。自由基(free radical)通常指独立存在的带有未成对电子的原子或原子基团,分子或离子,如HO·、O-2·、ArO·等。在人体生命活动进程中,自由基发挥着重要的作用。正常情况下,人体内自由基的产生和清除是平衡的,一旦自由基产生过多或抗氧化体系出现故障,体内自由基代谢就会出现失衡,可引起蛋白质、核酸(DNA)变性,导致细胞和组织器官损伤,诱发各种疾病,加速机体衰老,抗氧化剂的加入则能防止或改善这些损害[7]。
二苯代苦味酰自由基(DPPH·)在有机醇溶剂中是一种很稳定的自由基,其孤电子在517nm附近有强吸收,溶液呈深紫色[8],当自由基清除剂存在时,孤电子被配对,吸收消失或减弱,因此通过测定吸收减弱的程度,可评价该自由基清除剂的活性。由于DPPH·自由基对受试物活性成分灵敏度较高,而且操作简单易行,这种方法得到了比较广泛的应用。IC50通常被用来评价化合物对自由基的清除能力的大小,即清除自由基一半浓度时所需自由基清除剂浓度,其是评估化合物抗氧化活性的参数之一。IC50值越低,说明自由基清除剂对自由基的清除能力越强,灵香草浸膏、净油不同溶液的IC50分别为0.16、0.17、0.36、0.37mg·mL-1(表2),说明了浸膏、净油对DPPH·有良好的清除作用,这对开发新型功能性灵香草自由基清除剂、抗氧化剂具有重要的指导意义。

表2 灵香草浸膏、净油对自由基DPPH·的清除作用
2.3 灵香草浸膏及其净油与金属离子的螯合作用
Fenton反应是评估螯合型抗氧化剂的活性与机理的重要方法[9-10],具体做法是通过对抗氧化剂与Fe3+、Fe2+和Cu2+等金属离子的螯合作用进行表征。目前的表征手段主要有紫外光谱法、荧光光谱法、核磁共振等,由表征结果可以了解抗氧化剂与金属离子的螯合情况。螯合常数可以反映该抗氧化剂的活性,其与抗氧化剂的活性呈现良好的线性关系。本文中,我们采用荧光光谱猝灭法研究提取物与金属离子的螯合作用。
当荧光体与猝灭体由于热运动等发生碰撞时,可引起荧光体的荧光猝灭,设想为动态猝灭,则这种动态猝灭服从Stern-Volmer方程[11-13]。
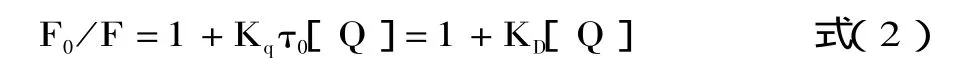
其中:F0为猝灭体不存在时荧光体的荧光强度;F为加入猝灭体后的荧光强度;Kq为双分子猝灭常数;[Q]为猝灭体浓度;τ0为猝灭体不存在时荧光体的荧光寿命;KD为Stern-Volmer常数。
当荧光体与猝灭体之间形成不发荧光的复合物时,或者出现无辐射能量转移时,根据化学平衡关系可得静态猝灭服从的关系为:

Ks为荧光体与猝灭体之间的螯合常数。对于静态猝灭通常采用 Lineweaver-Burk双倒数函数关系[11-13],即由式(4)变形可得
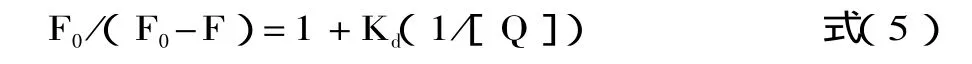
其中:Kd为离解常数。

然后分别利用式(4)和式(6)作图,判断其线性从而确定螯合常数的计算方法。
灵香草浸膏及其净油水溶液与不同浓度Fe2+和Cu2+离子螯合结果见图2、图3。
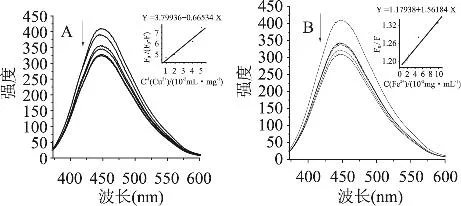
图2 Cu2+(A)和Fe2+(B)分别对浸膏的荧光猝灭图
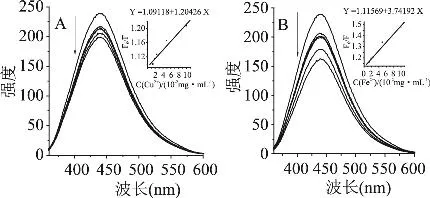
图3 Cu2+(A)和Fe2+(B)分别对净油的荧光猝灭图
由图2和图3可见,随着Cu2+和Fe2+浓度的增加,浸膏、净油的的荧光发射峰发生了猝灭现象。参考文献[11-13]并结合公式(2)、式(4)作图并代入数据,可计算浸膏、净油分别与Cu2+和Fe2+的螯合常数(表3)。

表3 灵香草浸膏及其净油与Fe2+、Cu2+的螯合常数
由表3可见,灵香草浸膏及其净油对 Cu2+和Fe2+具有良好的螯合作用。其中,净油与Fe2+的螯合作用最强,螯合常数为3.74×102mL·mg-1;浸膏对Fe2+的螯合作用次之,螯合常数为1.56×102mL·mg-1;灵香草净油与 Cu2+的螯合作用最小,螯合常数为1.20×102mL·mg-1。由此推测,灵香草浸膏、净油是良好的螯合型抗氧化剂,其可防止Cu2+和Fe2+参与人体内的Fenton反应[14],间接阻碍或降低了羟自由基和氧自由基的产生[15]:

总之,以上研究充分说明了灵香草浸膏及其净油具有良好的清除自由基的能力,具备开发为能够通过螯合过渡金属阳离子来阻止人体Fenton反应发生的抗氧化剂的潜力。
3 结论
对灵香草浸膏及其净油清除自由基DPPH·的性能进行研究发现,灵香草浸膏的DMF、水溶液清除自由基DPPH·的IC50分别为0.16、0.17mg·mL-1,灵香草净油的DMF、水溶液清除自由基DPPH·的IC50分别为0.36、0.37mg·mL-1,说明其浸膏、净油均具有良好的清除自由基活性,其中浸膏的清除活性比净油大;对灵香草浸膏及其净油与Cu2+和Fe2+的螯合作用研究表明,净油对Fe2+的螯合作用最强,螯合常数为3.74×102mL·mg-1,浸膏对Fe2+的螯合作用次之,螯合常数为1.56×102mL·mg-1,净油对Cu2+的螯合作用最小,螯合常数为1.20×102mL·mg-1。由上可见,灵香草浸膏、净油不仅具有良好的清除自由基活性,还具有与过渡金属阳离子螯合的性能,故灵香草浸膏、净油具有开发为新型功能性自由基清除剂、螯合性抗氧化剂的潜力。
[1]朱凯,王庆六,马吉玲.灵香草浸膏系列产品的研究[J].林产化学与工业,1995,15(2):67-71.
[2]江苏新医学院.中药大辞典[M].下册.上海:上海人民出版社,1977:2470-2472.
[3]莫彬彬,余德顺,李典鹏,等.广西灵香草提取物的化学成分研究及香气评价[J].香料香精化妆品,2003(1):5-7.
[4]Shen Y H,Weng Z Y,Zhao Q S,et al.Five new triterpene glycosides from Lysimachia foenum-graecum and evaluation of their effect on the arachidonic acid metabolizing enzyme[J]. Planta Med,2005,71(8):770-775.
[5]Pan Y M,Zhu J C,Wang H S,et al.Antioxidant activity of ethanolic extract of Cortex fraxini and use in peanut oil[J].Food Chemistry,2007,103:913-918.
[6]AMES BN.Micronutrients prevent cancer and delay aging[J].Toxicology Letters,1998,102(3):5-18.
[7]赵保路.氧自由基和天然抗氧化剂[M].北京:科学出版社,1999:53-382.
[8]Cotelle N,Bemier JL,Catteau J P,et a1.Antioxidant properties of hydroxy-flavones[J].Free Radic Biol Med,1996,20(1):35-43.
[9]Brown J E,Khodr H,Hider RC,et al.Structural dependence of flavonoid interactions with Cu2+ions:implications for their antioxidant properties[J].Biochem J,1998,330:1173-1178.
[10]Van Acker SA,Van den Berg DJ,Tromp MN,et al. Structural aspects of antioxidant activity of flavonoids[J].Free Radic Biol Med,1996,20:331-342.
[11]陈晓波,李崧.铜、钠和钼离子与牛血清白蛋白作用的荧光光谱研究[J].光谱学与光谱分析,2006,26(2):309-312.
[12]宋峥,梁宏.荧光猝灭法研究Cu(Ⅱ)和Zn(Ⅱ)离子与牛血清蛋白结合竞争[J].光谱学与光谱分析,2003,23(5):892-894.
[13]Leopoldini M,Russo N,Chiodo S,et al.2006.Iron chelation by the powerful antioxidant flavonoid quercetin[J].J Agric Food Chem,54:6343-6351.
[14]陈瑗,周玫.自由基医学[M].北京:人民军医出版社,1991:5-7.
[15]Neyens E,Baeyens J.A review of classic Fenton’s peroxidation as an advanced oxidation technique[J].Hazard Mater,2003,98:33-50,611-617.
Study on the antioxidation of the concrete and essential oil of Lysimachia foenum-graecum Hance
LIU Xian-xian1,ZHANG Ye1,QIN Wen1,ZOU Bi-qun1,2,YI Xiang-hui1,*
(1.Department of Chemistry and Engineering Technology,Guilin Normal College,Guilin 541001,China;2.School of Chemistry and Chemical Engineering,Guangxi Normal University,Guilin 541004,China)
The free radical scavenging activities and the binding properties of the concrete and essential oil of Lysimachia foenum-graecum Hance were measured with 2,2-Diphenyl-1-picrylhydrazy(lDPPH·)method and fluorescence-quenching spectroscopy,respectively.The results showed that both of the concrete and essential oil displayed good free radical activities against DPPH·with lC500.16~0.37mg·mL-1.And the copper and ferrous ion led to obvious statistic quenching of the concrete and essential oil fluorescence.The essential oil exhibited the best binding property with ferrous ion,and the concrete presented good binding property with ferrous ion,while the essential oil displayed the least binding property with copper ion.Their dissociation constants were 3.74×102,1.56×102and 1.20×102mL·mg-1,respectively.lt was suggested that the concrete and essential oil of Lysimachia foenum-graecum Hance should be developed as an efficient new antioxidant.
Lysimachia foenum-graecum Hance;antioxidant;free radical scavenging activity;binding property
TS210.1
A
1002-0306(2010)12-0137-04
2009-12-14 *通讯联系人
刘贤贤(1962-),女,教授,主要从事有机合成、天然产物化学与应用、杯芳烃的合成及应用的研究等领域的研究。
广西区教育厅科研项目(200807MS076、200807MS075、200507067、No.200911MS281、200911MS282);来宾市科技项目。
