柱前衍生高效液相色谱法测定鲍鱼中糖原含量
2010-11-10李国云王玉明陈士国尹利昂薛长湖
李国云,王玉明,陈士国,尹利昂,薛 勇,李 琳,薛长湖
(中国海洋大学食品科学与工程学院,山东青岛266003)
柱前衍生高效液相色谱法测定鲍鱼中糖原含量
李国云,王玉明,陈士国,尹利昂,薛 勇,李 琳,薛长湖*
(中国海洋大学食品科学与工程学院,山东青岛266003)
建立了双水解-柱前衍生高效液相色谱法测定鲍鱼中糖原含量的方法。以木瓜蛋白酶水解鲍鱼样品,释放出的糖原于2mol/L的三氟乙酸中,110℃条件下水解4h,彻底水解为葡萄糖,利用PMP柱前衍生高效液相色谱法对葡萄糖进行定量。该方法在葡萄糖含量为0.05~1.0mmol/L范围内线性关系良好(R2=0.9994),RSD为2.35%,平均回收率为96.53%,检测限为0.036mmol/L,定量限为0.06mmol/L。
高效液相色谱,糖原测定,葡萄糖,鲍鱼
糖原(C6H10O5)n又称动物淀粉,作为主要能量贮藏形式[1],鲍鱼中糖原含量较高,并具有调和浸出物成分的风味,增加浓厚感,使之产生特有风味的作用[2],鲍鱼的风味品质与糖原含量呈正相关;当受到外界刺激时,鲜活鲍鱼的糖原极易水解,因而糖原含量可作为评价鲍鱼鲜度的指标。鲍鱼中糖原的定量测定对于鲍鱼风味品质质量评价体系的建立具有重要意义。目前关于鲍鱼中糖原的高效液相色谱测定方法尚未见报道。文献报道,1-苯基-3-甲基-5-吡唑啉酮(PMP)可修饰糖环的还原端,使其具有高度紫外吸收,修饰糖能在反相高效液相色谱柱上能得到很好的分离,并且衍生过程简便快捷,用于单糖测定非常有效[3-8]。以高效液相色谱为基础的多糖的定量方法具有灵敏度高,准确性好的特点。因此,本文利用PMP作为柱前衍生剂,使用高效液相色谱法,研究了鲍鱼中糖原含量的测定方法,并对该方法的准确度、稳定性和重现性进行了验证,结果表明,PMP-柱前衍生高效液相色谱法具有准确度高、重复性及稳定性好等优点,可作为水生动物体内糖原含量准确测定的分析方法。
1 材料与方法
1.1 材料与仪器
D-(+)-氨基葡萄糖标准 Fluka公司;L-鼠李糖、D-木糖、D-葡萄糖醛酸、D-(+)-半乳糖醛酸、D-(+)-氨基半乳糖盐酸盐、L-岩藻糖标准 Sigma公司;乙腈、甲醇 色谱纯,Muskegon公司;其余试剂均为国产分析纯。
Agilent 1100高效液相色谱仪、二极管阵列检测器(DAD) 美国安捷伦公司;超纯水系统 美国Millipore公司。
1.2 样品预处理[9-10]
称量鲍鱼鲜品2g或干样0.4g经水泡发,剪碎,加入少量水,高速充分匀浆。匀浆液全部加入到30mL的 0.1mol/L乙酸钠缓冲溶液(pH6.0,内含5mmol/L EDTA溶液和5mmol/L半胱氨酸溶液)中,并加入5%(w/w)木瓜蛋白酶,于60℃水浴下恒温振荡反应12h之后,酶解液定容至100mL。取0.5mL定容后的酶解液于安倍瓶中,加入0.5mL 4mol/L TFA,充氮封管,于110℃下水解4h后,50℃下氮气吹干,以水超声溶解,0.3mol/L NaOH调节pH至中性后定容至 5mL。取 200μL加入 200μL 0.5mol/L PMP、200μL 0.3mol/L NaOH,70℃水浴反应30min,取出冷却,用200μL 0.3mol/L HCl中和,加入1mL氯仿萃取,充分振荡,小心吸弃下层,重复3次后,将上层水相过0.45μm微孔滤膜,待高效液相色谱测定。

表1 重复性和精密度实验结果(n=6)
1.3 色谱条件[5-6]
色谱柱:ZORBAX Eclipse XDB-C18分离柱(4.6× 250mm i.d,5μm),柱温:25℃。流动相 A:10%(V/V)乙腈 +0.1mol/L乙酸铵(pH 5.5),流动相B:25%(V/V)乙腈+0.1mol/L乙酸铵(pH 5.5)。采用梯度洗脱:0~40min,45%B~100%B,流速:1.0mL/min。进样量10μL,检测波长:245nm。
2 结果与分析
2.1 样品预处理条件选择与优化
目前,鲍鱼体内糖原测定过程多采用醇沉的提取方法,造成糖原损失严重,测量误差较大。本文采用木瓜蛋白酶将鲍鱼水解,释放糖原,再利用酸水解将糖原彻底水解为葡萄糖,避免了糖原的损失。本文研究了不同浓度的三氟乙酸及不同水解时间对鲍鱼中糖原水解条件的影响,确定了最佳的酸水解条件:2mol/L TFA,110℃,4h,如图1所示。

图1 不同浓度的TFA、不同水解时间对鲜活鲍鱼糖原中糖原含量测定结果
2.2 色谱条件选择
参照Fu和O’Neill[5]文献中所述的色谱条件,实现了葡萄糖和其他9种单糖的有效分离,为了分析测定方便,通过条件摸索,缩短了分析时间,标准品和样品色谱图分别见图2、图3。
2.3 线性范围和检测限考察
准确称量葡萄糖标准品,配制成0.05、0.1、0.2、0.4、0.6、0.8、1.0mmol/L系列浓度的标准溶液,采用上述方法衍生测定,每个浓度重复测定三次,以平均值计算。以葡萄糖标准品峰面积(y)对其相应浓度(x)进行线性回归计算,得标准曲线y=2570.4x-9.0243(R2=0.9994)。
在上述条件下,以仪器的信噪比(S/N)为3条件下相对应的浓度定为检出限,以S/N为10条件下相对应的浓度为定量限,结果得到葡萄糖的检测限为0.036mmol/L,定量限为0.06mmol/L。

图3 鲍鱼水解物高效液相色谱分离图
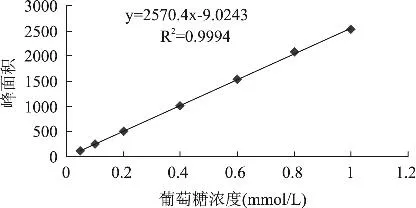
图4 葡萄糖标准曲线
2.4 重复性和精密度
六组皱纹盘鲍平行样,测定糖原含量的RSD为2.35%,表明该方法对葡萄糖衍生物的检测重复性良好;吸取0.6mmol/L葡萄糖标准溶液衍生物,连续进样6次,得到葡萄糖的RSD=0.23%,表明仪器精密度良好,方法精密度符合要求,结果见表1。
2.5 回收率实验
分别向鲍鱼样品酶解液中添加低浓度(0.2mmol/L)、中浓度(0.5mmol/L)和高浓度(0.8mmol/L)三个水平的葡萄糖标准液,按测定方法要求进行回收实验,水平样品平行测定6份,结果见表2。回收率分别为94.11%、97.13%、98.34%,平均加标回收率为96.53%;平行测定的RSD(n=6)分别为3.49%、2.99%、2.72%。均为在置信区间为95%的回收率,在可接受的范围之内。
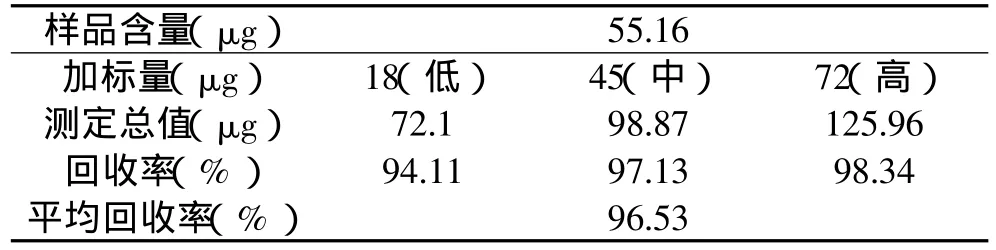
表2 鲍鱼样品中葡萄糖的加标回收率
3 结论
本文建立了高效液相色谱法测定鲍鱼中糖原含量的方法,与其他方法相比[11-16],具有很多优势。目前传统的糖原测定方法主要有蒽酮比色法[12]、碘盐显色法[13]、酶解分析法[14]等,这些方法主要是对动物组织浸提,二次醇沉等步骤后进行测定。首先二次醇沉法对鲍鱼中糖原提取不完全,而测定时采用比色法,易受样品中的杂质如盐、微量元素、蛋白质、色素等的干扰,对目标测定物的选择性不强,引起较大的测定误差。本方法采取的木瓜蛋白酶酶解联合酸水解可使鲍鱼中糖原充分水解为葡萄糖,排除了糖原提取率的影响,测定结果更为准确。2001年张淑珍等[15]建立了共振瑞利散射法测定糖原含量,但是该方法仅适用于合成样品及注射样品中糖原的测定,不适合复杂的鲍鱼样品的测定,而本文建立的方法实现了对酸性、碱性和中性单糖的同步分离,可对葡萄糖进行准确的定量计算,专属性好,分析时间较Fu等报道[5]的明显缩短。2008年高瑞昌等[16]建立了一种离子色谱测定牡蛎中糖原的方法,但是该方法中使用的葡萄糖淀粉酶较昂贵,比较而言,本文中糖原的水解采用酸水解,降低测试费用。
综上所述,本文建立的糖原测定方法具有快速、准确、专属性好、灵敏度高等特点,可应用于多种鲍鱼制品及其他水生动物体内糖原含量的测定,并为鲍鱼质量标准的建立以及鲍鱼风味物质研究提供了基础方法。
[1]陈骞,杨瑞金,顾聆琳.牡蛎糖原的研究(II)—牡蛎糖原的分子结构[J].食品科学,2005,26(7):43-47.
[2]鸿巢章二,桥本周久编.水产利用化学[M].郭晓风,邹胜祥译.中国农业出版社,1999.
[3]S HONDA,E AKAO,S SUZUKI,et al.High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3 -methyl-5-pyrazolone derivatives[J].Anal Biochem,1989,180:351-357.
[4]D J STRYDOM.Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone-derivatized neutral,acidic and basic aldoses[J].J Chromatogr A,1994,678:17-23.
[5]D.FU,R.A.O’NEILL.Monosaccharide composition analysis of oligosaccharides and glycoproteins by high-performance liquid chromatography[J].Anal Biochem,1995,227(2):377-384.
[6]杨兴斌,赵燕,王海芳,等.柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J].分析化学,2005,33(9):1287-1290.
[7]林雪,贾敬芬,黄琳娟,等.RP-HPLC用于芦荟多糖的单糖组成研究[J].食品科学,2006,27(4):192-195.
[8]周斌,张承明,张承聪,等.烟草中糖类的1-苯基-3-甲基-5-吡唑啉酮衍生化与HPLC分析方法研究[J].云南化工,2006,33(6):40-44.
[9]李海棠,周清凯,蔡云见,等.玉足海参多糖的分离及理化性质研究[J].中药材,1999,22(7):327-328.
[10]盛文静.不同海参多糖的提取分离及化学组成分析比较[J].中国海洋药物,2007,26(1).
[11]吴定.单一显色法测定肌肉中糖原含量[J].中国兽医学报,1992,22(5):35-37.
[12]NICHOLASV,CARROLL,ROBERTW.The determination of glycogen in liver and muscle by use of anthrone reagent[J].The Journal of Biological Chemistry,1955:584-594.
[13]C E DREILING,D E BROWN,L,CASALEETLE,et al. Muscle Glycogen:comparison of Iodine Binding and Enzyme Digestion Assays and Application to Meat Samples[J].Meat Science,1987,20:167-177.
[14]路桂红,吴定.酶法测定肉品中糖原含量研究[J].肉品卫生,1996(5):8-9.
[15]ZHANG S Z,ZHAO F L,LI K A.Determination of glycogen by Rayleigh light scattering[J].Analytica Chimica Acta,2001,431:133-139
[16]GAO R C,YUAN L,WANG Q.Innovative method for determining glycogen content in the Pacific oyster(Crassostrea gigas)by ion chromatography[J].Journal of Chromatography A,2008,1208:239-241.
Pre-column derivatization—HPLC for the determination of glycogen in abalone
LI Guo-yun,WANG Yu-ming,CHEN Shi-guo,YIN li-ang,XUE Yong,LI Lin,XUE Chang-hu*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
The method of double hydrolysis PMP derivatization HPLC determining the glycogen content of abalone was established.Abalone samples were hydrolyzed by papain,to release glycogen,then the hydrolysate was further hydrolyzed for 4h by 2mol/L of trifluoroacetic acid at 110℃,to completely hydrolyze glycogen to glucose. The content of glucose was determined by utilizing PMP pre-column derivatization high-performance liquid chromatography.The linear relationship is good in range of 0.05~1.0mmol/L of the glucose conten(tR2=0.9994). RSD was 2.35%,average recovery was 96.53%,the limit of detection was 0.036mmol/L,and the limit of quantification was 0.06mmol/L.
HPLC;glycogen determination;glucose;abalone
TS254.7
A
1002-0306(2010)12-0341-03
2009-12-16 *通讯联系人
李国云(1987-),女,硕士研究生,主要从事海洋生物多糖研究。
国家科技支撑计划(2008BAD94B05)。
