聚阴离子掺杂LiMnO2-yXy(X=B,Si,Mo,P,B)材料的合成及其电化学性能
2010-11-09叶世海王永龙
粟 智 叶世海 王永龙
(1新疆师范大学生命科学与化学学院,乌鲁木齐 830054)
(2南开大学化学学院,新能源材料化学研究所,天津 300071)
聚阴离子掺杂LiMnO2-yXy(X=B,Si,Mo,P,B)材料的合成及其电化学性能
粟 智*,1叶世海2王永龙2
(1新疆师范大学生命科学与化学学院,乌鲁木齐 830054)
(2南开大学化学学院,新能源材料化学研究所,天津 300071)
采用水热法合成了聚阴离子掺杂LiMnO2-yXy(X=BF4-,SiO32-,MoO42-,PO43-,BO33-,y=0.01、0.03、0.05)锂离子电池正极材料。通过X射线粉末衍射(XRD)、X光电子能谱(XPS)、扫描电镜(SEM)和恒电流充放实验,研究了不同掺杂离子和掺杂量对产物结构和电化学性能的影响。结果表明,少量聚阴离子的掺杂未改变正交LiMnO2的晶体类型,但增大了材料晶胞体积,改善了材料的电化学循环性能。电化学交流阻抗(EIS)测试结果表明,聚阴离子掺杂增大了材料电荷转移阻抗,但明显提高了材料中Li+的扩散能力。
聚阴离子;掺杂;锂离子电池;层状LiMnO2;电化学性能
0 引 言
LiMnO2性能改善采用最多的方法是阳离子掺杂,阳离子掺杂方法对改善正极材料LiMnO2的循环性能方面已取得了较好的效果,其不足之处在于掺杂阳离子取代部分Mn的位置,或者提高锰的价态(Mn3+减少,Mn4+增加)都使有效物质Mn3+减少,材料的初始容量降低[23-24]。近年来,一些研究小组报道了聚阴离子型化合物作为锂离子电池正极材料具有良好的性能。聚阴离子型化合物是一系列含有四面体或者八面体阴离子结构单元(XOm)n-(X=P、S、As、Mo、V、Si、B、W等)和(XFm)n-(X=Al,Si,B)的化合物的总称。这些结构单元通过强共价键连成的三维网络结构并形成更高配位的由其它金属离子占据的空隙,使得聚阴离子型化合物正极材料具有和金属氧化物正极材料不同的晶相结构以及由结构决定的各种突出的性能[25-33]。文中研究了B,Si,Mo, P,B聚阴离子掺杂LiMnO2,通过对材料的微观结构、表面形态、初始容量、循环稳定及高倍率放电性能进行了研究,探讨了聚阴离子掺杂改性LiMnO2正极材料的机制,为改善LiMnO2电化学循环性能提供了有效的途径。
1 实验部分
1.1 材料制备
LiMnO2材料的制备:将6 mol·L-1的LiOH溶液30 mL和2 g Mn2O3(将分析纯的Mn(CH3COO)2·4H2O在500℃恒温15 h)置入高压反应釜中,150℃保温36 h。产物随炉冷却,取出后用去离子水洗涤,直至pH值为9左右,于105℃烘干12 h备用。
LiMnO2-y(PO4)y(y=0.01、0.03、0.05)材料的制备:分别按Mn/PO4=0.99/0.01,0.97/0.03,0.95/0.05计量比的Mn2O3和NH4H2PO4,加5 mL去离子水制成悬浊液后,边搅拌边加入6 mol·L-1的LiOH溶液30mL,然后按以上操作掺杂P材料的制备。
LiMnO1.99X0.01(X=B,Si,Mo,B)材料的制备:分别按Mn/X=0.99/0.01计量比的Mn2O3和KBF4或Na2SiO3·9H2O或NaMoO4·2H2O或H3BO3,加5 mL去离子水制成悬浊液后,边搅拌边加入6 mol·L-1的LiOH溶液30 mL,然后按以上操作进行掺杂材料的制备。
1.2 材料表征
样品物相结构分析在Rigaku D/max-2500型X-射线衍射仪上进行。采用Cu Kα(λ=0.15418 nm)辐射源,石墨单色检测器,管压40 kV,管流100 mA,衍射角2θ范围3°~80°,扫描速度2°·min-1。采用日本S-3500N型扫描电镜对样品形貌进行了观察。实验时,将少量样品粘附在导电铜胶布上,样品表面经离子溅射仪喷金处理,送进样品室,抽真空后,以不同的放大倍率观察样品的颗粒大小、形状和分布。材料的组成采用IRIS Advantage型ICP-AES等离子体光谱仪(美国Thermo公司),中阶梯光栅,采用CID摄相技术测定谱线强度。测定时载气的辅助气流量0.5 L·min-1,雾化室压力152 kPa,泵速:110 r·min-1,RF功率:1150 W;长波积分5 s,短波积分15 s。采用PHI-5300ESCA能谱仪对最终产品的进行XPS测试,用Mg Kα辐射作为激发源(1 253.6 eV),功率为25 W,入射角为45°,扫描方式为全谱扫描。
1.3 电化学性能测试
作者简介:杨艾艾,女,汉族,黑龙江人,海南科技职业学院,助教,本科学历,研究方向:航海类学生实习期间管理。
将活性物质、乙炔黑、粘结剂PTFE按质量比75∶20∶5混合,用无水乙醇作为分散剂将其碾压成片,然后切成直径为8 mm的圆片,在烘箱中105℃干燥8 h,得到所需的正极极片。电解质液使用1 mol·L-1的LiPF6/PC(10%)+EC(30%)+DEC(60%)的有机混合溶液。负极使用锂片,在手套操作箱里组装好模拟电池,将电池静置 12 h以后,在 Land CT2001A电池测试系统上进行比容量和循环性能测试。测试温度为室温25℃,充放电流密度为50 mA·g-1,充放电压为2.0~4.3 V。循环伏安实验采用LK2005电化学工作站进行测试,扫描速度为0.1 mV·s-1。运用了Zahner IM6ex型电化学工作站测定材料的电化学阻抗,测定频率范围为10 kHz~10 mHz,微扰电压为5 mV。
2 结果与讨论
2.1 材料组成与结构
表1列出了合成材料的化学组成。图1显示了聚阴离子掺杂掺杂前后材料的XRD。表2列出了用Rietveld软件精修后得到晶胞参数。从图1中可以看出材料掺杂前后所得到的最终产物均为正交结构。所得到的材料衍射峰比较尖锐,衍射峰的位置与纯正交结构LiMnO2(o-LiMnO2)相同,未出现其它明显的杂质峰,图谱与标准XRD图(PDF No.88-0345)吻合。衍射峰很尖锐,说明掺杂后的材料具有很好的结晶程度。掺杂的样品与未掺杂的样品相比,峰形和峰的位置几乎没有什么变化,说明掺杂离子已进入到材料的晶格中,没有新相生成证明聚阴离子离子掺杂没有影响到样品的晶体类型。通过计算得其晶胞体积,比未掺杂样品的晶胞体积大,并随掺杂量的增加而增大。这是由于掺杂的聚阴离子B(0.232nm)、Mo(0.313nm)、Si(0.237nm)、B(0.271 nm)和P(0.278 nm)的离子半径均大于被取代的O2-(0.132 nm)离子半径而引起的。

表1 材料的化学组成Table 1 Chemical composition of the as-prepared materials

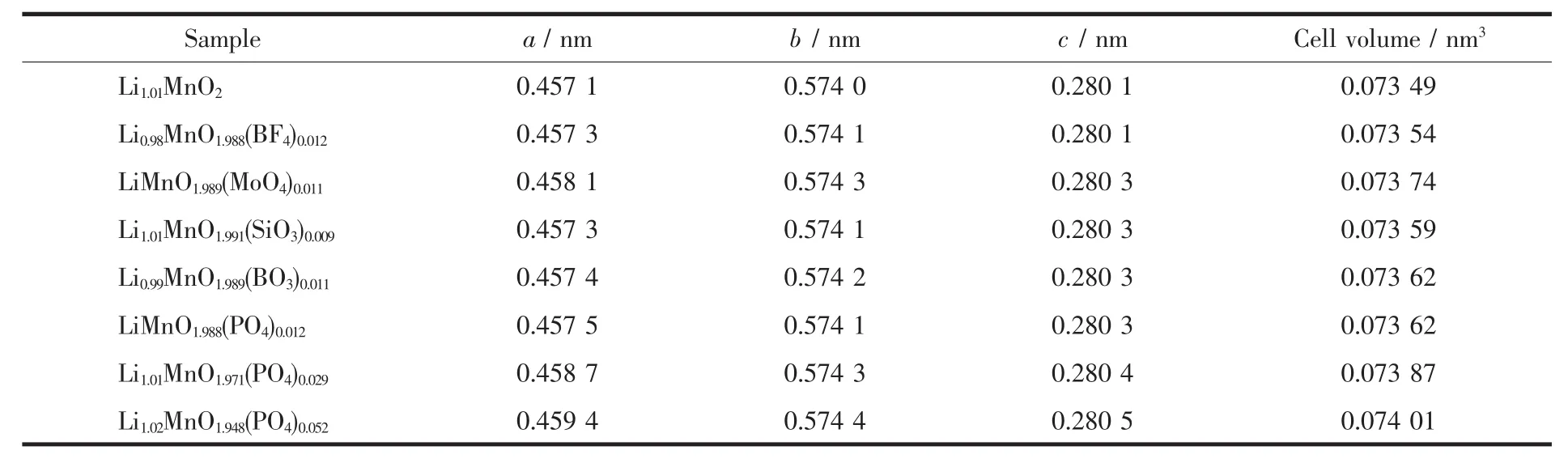
表2 样品经Rietveld精修后的晶胞参数Table 2 Lattice parameters of the as-prepared samples after Rietveld refinement
2.2 材料形貌
图2显示了合成材料的SEM图。从图中可以看出,水热法得到产物在各个晶面上的生长均匀,形成较为规则的颗粒。颗粒尺寸为200~300 nm,颗粒分布均匀。聚阴离子掺杂后也未改变材料的形貌。

2.3 材料电化学性能测试
采用不同的充放电倍率对掺杂化合物进行电化学循环性能测试,材料的电化学循环寿命如图3。表3列出了不同材料在50 mA·g-1的电流密度下的第一周放电容量。
从图3中可以看出,o-LiMnO2正极材料在电化学嵌/脱锂过程中,无论掺杂与否,材料的放电容量在循环的初期,是逐步增大的,这与尖晶石结构的LiMn2O4以及单斜层状LiMnO2循环初期容量快速衰减正好相反,在容量达到一定值后趋于稳定。这说明o-LiMnO2在电化学循环过程的初期有一个活化的过程。这种活化的过程也是一个向尖晶石相LiMn2O4转化的过程,这种电化学循环过程中形成的尖晶石相不同于直接合成的标准尖晶石相LiMn2O4,这种结构具有更强的稳定性。而由表3可知,在掺入1%的聚阴离子后,材料的初始容量均有所增加,但随着掺杂量的增加,材料的放电容量逐渐下降,如:掺入2%与3%的P时,材料的初始放电容量分别为110.7和101.8 mAh·g-1,低于掺入1%时的放电容量119.4 mAh·g-1,其它离子掺杂后结果基本一致。
对电极材料来说,材料的容量是由其有效的+3价锰含量决定的。对掺入低价态聚阴离子,如:掺入B。由于B的电荷低于被取代的O2-,为了保持电荷平衡,将产生部分Mn2+。由于Mn2+(0.080 nm)离子半径大于Mn3+,B的离子半径大于O2-的离子半径,因此在材料中掺入价B聚阴离子后,材料的晶胞体积增大,电极材料的离子分布形式发生了变化,电极材料在充放电过程中的结构相变能得到抑制,因而掺入B后能增强材料的结构稳定性。尽管掺入Mo和Si不能改变材料的Mn3+的化学状态,但由于Mo和Si的离子半径大于被取代的O2-的离子半径,在增强材料的晶体框架结构稳定性的同时,为材料中Li+嵌入和脱出提供了更有利的三维通道,从而提高了材料的初始容量和改善了材料的电化学循环性能。在LiMnO2材料中掺入高价聚阴离子B和P时,由于高价聚阴离子的电荷和离子半径均高于被取代的O2-,为保持电荷平衡将产生部分Mn4+,其结构能有效抑制材料中由于Mn3+的Jahn-Teller效应而产生的结构畸变,增强材料的结构稳定性和改善材料循环性能。但由于聚离子均是非活性物质,因此随离子的含量增大会造成材料的初始容量下降。

表3 材料的首次放电容量Table 3 First discharge capacity of different doped materials

图4显示了在充放电流密度为50 mA·g-1时,材料的第1周和第60周充放电曲线。从曲线可以看出,样品第1周期只有在3.0 V左右有1个明显的充电平台,但只出现较弱的放电平台,表明存在较大的不可逆容量,而第10周在3.0和4.0 V出现了2个平台,表明材料在电化学过程中已发生了结构变化。

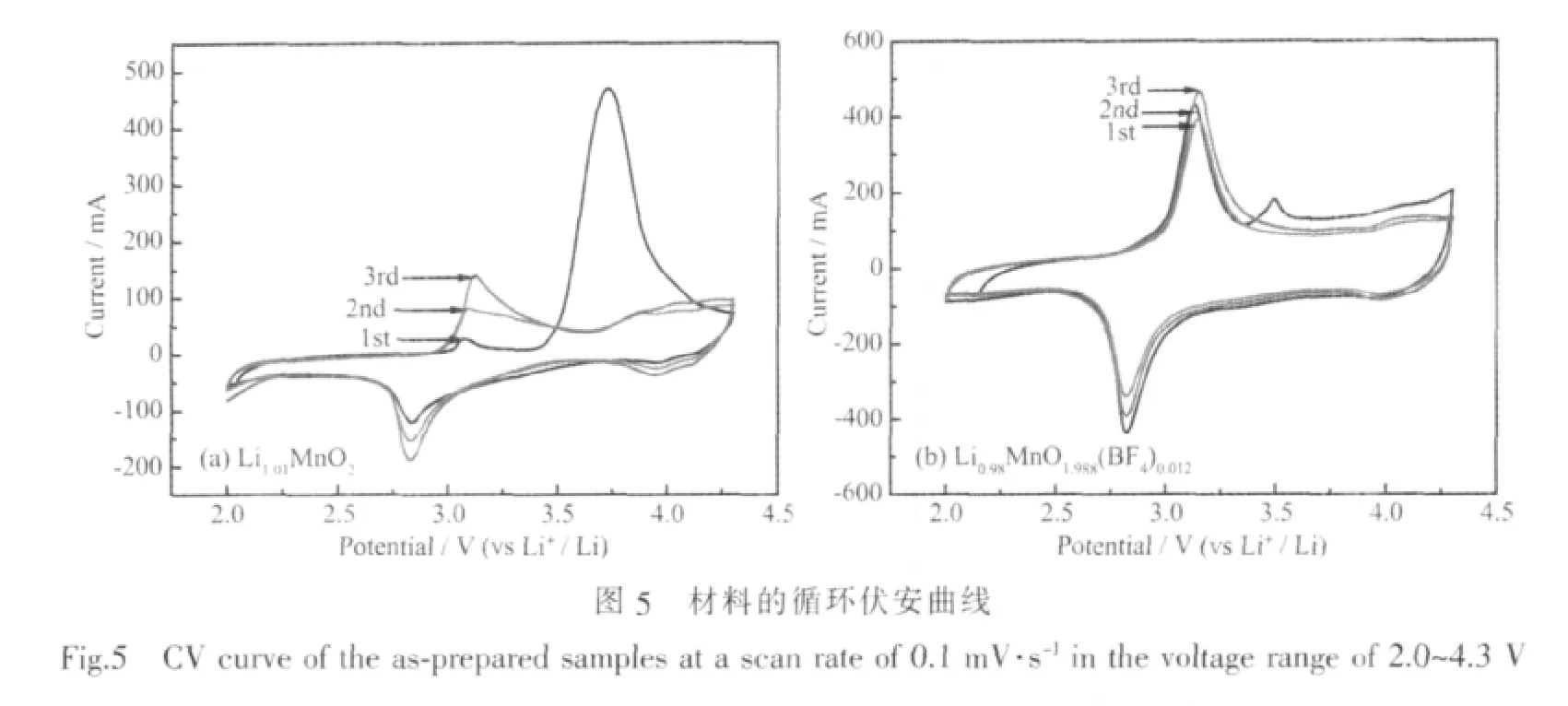
图5显示了Li1.01MnO2和Li0.98MnO1.988(BF4)0.012材料的循环伏安曲线图。由图可知,第1周阳极过程中,锂离子从电极材料o-LiMnO2中脱嵌,在4.0 V左右有一个很宽的氧化峰,说明大多数的锂离子都能够脱嵌出来。而阴极过程中,2.8 V左右的还原峰强度较弱,说明第1周锂离子可逆嵌入/脱出的效率相对较低,与材料的充放电行为基本一致。在随后的循环中,在3.0 V左右的氧化峰强度逐渐增强。对于掺杂1%BF4-聚阴离子后,材料的可逆性明显得到提高,材料第一周可逆容量比率为85.9%,高出未掺杂材料的32.3%,表明掺杂材料的活化速率增大且循环可逆性增强。
2.4 材料的交流阻抗分析
为了进一步证实聚阴离子掺杂对样品中Li+的扩散能力的影响,对合成的材料进行了交流阻抗的测试。图6为所得到材料经电化学循环10周后的交流阻抗图。采用图中所示的等效电路对测定数据进行拟合,结果见表4。

图6 样品经电化学循环10周后的交流阻抗测试图Fig.6 Impedance spectra of the as-prepared samples after 10 cycles
对于阴离子来说,由于晶格结合电阻很相近,因此掺杂后对结构的改变是相似的,但电荷转移电阻和Warburg阻抗存在着差别,特别是Warburg阻抗差别比较大,这就反映出掺杂不同的离子对锂离子的扩散能力有着一定的影响。掺杂聚阴离子后,由于聚阴离子较低的导电率,导致材料的电荷转移反应就难一些,表现为增大了材料的电荷转移阻抗。但聚阴离子较大的离子半径,掺入能增大了材料的晶胞体积,提供更有利于锂离子扩散的三维通道,在电化学过程中锂离子嵌脱更容易,表现在材料的Warburg阻抗值变小,反映在电化学性能上就是其高倍率充放电能力得到了提高[34]。

表4 样品交流阻抗测试数据拟合结果Table 4 Fitting results of EIS data for as-prepared samples
2.5 材料的X光电子能谱分析
电化学性能测试结果推断材料的循环性能提高是由于掺入增加了材料的结构稳定性。为了更直接的验证这一推断,对材料进行了X射线光电子能谱检测,以验证掺杂元素进行入到了材料的晶格中对Mn的化学状态产生影响。图7为掺杂前后材料的Mn2p的XPS谱图。表5列出了用ICP-AES和XPS对材料进行分析后得到的材料组成。


表5 材料化学组成和表面组成Table 5 Chemical and surface composition of as-prepared materials
从图7可以看出,尽管掺杂后Mn2p1/2和Mn2p3/2光电子能谱峰的裂分距离几乎未发生改变,但掺杂低价或高价聚阴离子结合能均发生了变化。其中掺杂低价BF-时Mn2p光电子谱峰总体向低能量方向移动,说明Mn的氧化状态发生了变化,Mn的平均价态下降,定性地证明了掺杂低价阴离子可以降低Mn的价态。还掺杂B和P时Mn2p光电子谱峰总体向高能量方向移动,说明了Mn的氧化状态也发生了变化,Mn的平均价态升高,定性地证明了掺杂高价阴离子可以提高Mn的价态。表5数据说明用XPS测定合成材料的表面组成与用ICP-AES法测定材料的体相组成基本一致,说明掺杂离子进入了材料的晶格,这与材料XRD的分析结果一致。
[1]XU Tian-Jun(许天军),YE Shi-Hai(叶世海),WANG Yong-Long(王永龙),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(7):993-998
[2]LI Yi-Bing(李义兵),CHEN Bai-Zhen(陈白珍),HU Yong-Jun(胡拥军),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(6):983-987
[3]Bruce P G,Armstrong A R,Gitzendanner R L.J.Mater.Chem., 1999,9:193-198
[4]Armstrong A R,Paterson A J,Dupre N,et al.Chem.Mater., 2007,19:1016-1023
[5]Paulse J M,Thomas C L,Dahn J R.J.Electrochem.Soc., 1999,146(10):3560-3565
[6]Choi S,Manthiran A.J.Electrochem.Soc.,2002,149(9): A1157-A1163
[7]Mishra S K,Ceder G.Phys.Rev.B,1999,59(9):6120-6130
[8]Wang H F,Jang Y-II,Chiang Y M.Electrochem.Solid State Lett.,1999,2(10):490-493
[9]Huang Z F,Meng X,Wang C Z,et al.J.Power Sources, 2006,158(2):1394-1400
[10]Cho J.J.Mater.Chem.,2001,13:4537-4541
[11]Kim Y,Kim H S,Martin S W.Electrochim.Acta,2006,52: 1316:1322
[12]Kang S H,Amine K.J.Power Sources,2003,124:533-537
[13]Cho J,Kim Y J,Kim T J et al.J.Electrochem.Soc.,2002, 149(2):A127-A132
[14]Li C,Zhang H P,Fu L J,et al.Electrochim.Acta,2006,51: 3872-3883
[15]Park C W,Ruth I M,Ryu H W et al.J.Phys.Chem.Solids, 2007,68(5/6):1126-1130
[16]Suresh P,Shukla A K,Munichandraiah N.J.Power Sources, 2006,161(2):1307-1313
[17]Huang Z F,Wang C Z,Meng X et al.J.Solid State Chem., 2006,179:1602-1609
[18]Guo Z P,Zhong S,Wang G X et al.J.Alloys Compd.,2003, 348:231-235
[19]Xiao J,Hui Z,Zhou Y H.Mater.Lett.,2004,58:1620-1624
[20]Suresh P,Shukla A K,Munichandraiah N.Mater.Lett., 2005,59:953-958
[21]XIAO Jing(肖 劲),ZENG Lei-Ying(曾雷英),CHEN Zhao-Yong(陈召勇),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(6):685-690
[22]Liu Q,Li Y X,Hu Z L,et al.Electrochim.Acta,2008,53 (24):7298-7302
[23]Huang Y J,Gao D S,Lei G T et al.Mater.Chem.Phys., 2007,106:354-359
[24]Park S H,Lee Y S,Sun Y K.Electrochem.Commun.,2003, 5:124-128
[25]Dominko R,Bele M,Gaberscek M,et al.Electrochem. Commun.,2006,8:217-222
[26]SONG Shi-Tao(宋士涛),MA Pei-Hua(马培华),LI Fa-Qiang (李发强),et al.J.Funct.Mater.(Gongneng Cailiao),2008, 39(10):1694-1696
[27]Nanjundaswamy K S,Padhi A K,Goodenough J B,et al. Solid State Ionics,1996,92(1/2):1-10
[28]Padhi A K,Nanjundaswamy K S,Goodenough J B.J.Electrochem.Soc.,1997,144(4):1188-1194
[29]Huang H,Yin S C,Nazar L F.Electrochem.Solid State Lett.,2001,4(10):A170-A172
[30]Yamada A,Hosoya M,Chung S C,et al.J.Power Sources, 2003,119-121:232-238
[31]Padhi A K,Nanjundaswamy K S,Masquelier C,et al.J. Electrochem.Soc.,1997,144(8):2581-2586
[32]SHI Zhi-Cong(施志聪),YANG Yong(杨 勇).Prog.Chem. (Huaxue Jinzhan),2005,17(4):604-703
[33]Tarascon J M,Armand M.Nature,2001,414:359-367
[34]Su Z,Ye S H,Yan T Y et al.J.Electrochem.Soc.,2008, 155(11):A839-A844
Synthesis and Electrochemical Properties of Polyanion Doped LiMnO2-yXy(X=B,Si,Mo,P,B)Materials
SU Zhi*,1YE Shi-Hai2WANG Yong-Long2
(1College of Life and Chemistry Science,Xinjiang Normal University,Urumqi830054)
(2Institute of New Energy Material Chemistry,Nankai University,Tianjin300071)
Hydrothermal methods were used to prepare the polyanion-doping LiMnO2-yXy(X=B,S,Mo, P,B)as cathode materials for lithium-ion batteries.The samples were characterized by X-ray diffraction (XRD),X-ray photoelectron spectra (XPS),scanning electron microscope (SEM)and their electrochemical performances were investigated including cycling behavior (CV)and constant current charge-discharge experiment.The results indicate that the low concent ration polyanion dopant does not affect the crystal type of orthorhombic LiMnO2but considerable improves its electrochemical performances.Electrochemical impedance spectroscopy (EIS)analysis shows that the charge-tranfer resitance and the Warburg impendance decrease obviously as compared to that the undoped LiMnO2samples,however,The large polyanion doping can enhances fast mobility of Li+ions.
polyanion;doping;lithium-ion batteries;orthorhombic structure;electrochemical properties
O614.111;TM919.9
A
1001-4861(2010)04-0693-08
2009-07-06。收修改稿日期:2009-10-18。
国家自然科学基金课题(No.20773070);新疆师范大学博士科研基金项目(No.XJNUBS0807)资助,新疆高科研计划重点项目(No.XJEDU2009I28)资助。
*通讯联系人。E-mail:suzhixj@sina.com
粟 智,男,41岁,博士,教授;研究方向:无机功能材料和锂离子电池材料。
