蝉拟青霉深层发酵的研究
2010-11-07李忠刘爱英金道超
李忠,刘爱英,金道超
(1.贵州大学 农学院,贵州贵阳 550025;2.贵州大学 贵州山地农业病虫害重点实验室,贵州贵阳 550025;3.贵州大学真菌资源研究所;贵州贵阳 550025)
蝉拟青霉深层发酵的研究
李忠1,2,刘爱英3,金道超2
(1.贵州大学 农学院,贵州贵阳 550025;2.贵州大学 贵州山地农业病虫害重点实验室,贵州贵阳 550025;3.贵州大学真菌资源研究所;贵州贵阳 550025)
为了筛选到蝉拟青霉优良的培养基及摇瓶发酵条件,通过对碳、氮源筛选的单因素实验,筛选出葡萄糖为碳源、蛋白胨为氮源;在此基础上以筛选的碳源、氮源及无机盐K2HPO4,M gSO4·7H2O为考察因素,以菌丝体生物量为指标,利用正交实验筛选出生物量较高的培养基组合.结果表明,最优培养基按质量分数为葡萄糖3%,蛋白胨1.5%,K2HPO40.1%,M gSO4·7H2O 0.05%.适宜的摇瓶发酵条件为培养温度25~27℃,培养基起始p H 6~7,接种量6%,摇床转速为150 r/min,500 m L三角瓶最适装液量为100 mL,发酵周期为7 d.
蝉拟青霉;深层发酵;培养基优化;培养条件
蝉拟青霉Paecilomycescicadae(M iquel)Sam son是麦角菌科(Clavicipitaceae)真菌蝉棒束孢菌及其寄主山蝉幼虫的干燥复合体,又称蝉花P.cicadae,是一种传统的药用真菌.蝉花性寒味甘,具散风热、定惊、镇痛解痉等功效[1].据《中药大辞典》中记载,蝉拟青霉含有糖原、甘露醇、生物碱及麦角甾醇等多种活性物[2].陈祝安[3]、刘广玉[4]等证明蝉拟青霉及人工培养物有明显的镇痛、镇静和解热等功效,且其作用与天然蝉花和冬虫夏草(Cordycepssinensis)十分相似,而且蝉拟青霉对机体的毒性甚微[5],其主要化学成分与天然冬虫夏草相似[6].蝉拟青霉P.cicadae是不仅具有药理活性,还具有极为广谱、较强致病性的虫生真菌,可以寄生鳞翅目(Lep idop tera)、膜翅目(Hym enop tera)中的很多昆虫[7-9],对蚜虫、粉虱等刺吸式口器害虫的致病性也有报道[10-13].
目前蝉花的使用中存在着资源有限、人工采集困难,功能活性组分不明、作用机制不清楚,甚至原料不纯等问题,这就成为蝉花这种传统中药走向世界的一个很大障碍[1].由于天然蝉花资源有限,为解决这个矛盾,人们便开始了用分离自蝉花的蝉拟青霉P.cicadae进行人工发酵的方法来生产其菌丝体,可较好地解决天然蝉花资源短缺的问题.为此,十分有必要对蝉拟青霉的发酵工艺进行研究,以便于用发酵的菌丝体替代子实体作为保健品、药品的原料或生产杀虫制剂等.
1 材料与方法
1.1 菌种
蝉拟青霉(P.cicadae)LB菌株,采自贵州省茂兰自然保护区,现保存于贵州大学植保科学实验室.
1.2 培养方法
1.2.1 菌种活化
将保存菌种用接种针接入斜面培养基上,25℃恒温培养7 d.
1.2.2 液体培养方法
从活化斜面菌种中挑取3~4块大小相同的菌块接入装有100 m L PDA液体培养基的三角瓶(500 m L)中,26℃,120 r/min,培养3 d得一级菌种.将一级菌种按10%(V/V)的接种量接入盛有90 m L供试培养基(500 m L三角瓶)中,自然p H值,26℃,120 r/m in,培养7 d后收集菌丝体.
1.3 碳源筛选培养基
以质量分数酵母膏1%,K2HPO40.2%,M gSO4·7H2O 0.1%为基本培养基,p H自然.分别以葡萄糖、蔗糖、麦芽糖、果糖、乳糖为碳源,添加量均为3%.
1.4 氮源筛选培养基
以质量分数葡萄糖3%,K2HPO40.2%,M gSO4·7H2O 0.1%为基本培养基,p H自然.分别以酵母膏,牛肉膏,蛋白胨,NH4NO3,(NH4)2SO4,NaNO3为氮源,添加量均为1%.
1.5 培养基正交筛选实验
根据1.3和1.4中碳、氮源单因素实验结果,选择最好的碳、氮源各1个,再配以K2HPO4,M gSO4的不同浓度,按L9(34)设计4因素3水平正交实验,9个组合,3次重复.因素水平见表1.

表1 正交实验因子及水平Tab.1 Factorsand levelsof the orthogonal test
1.6 菌丝干重的测定
发酵结束后,将发酵液用4层纱布过滤后,菌丝体经蒸馏水冲洗3次后,在45℃的条件下烘干至恒重,电子天平称菌丝体干重.
1.7 数据处理
实验数据均用平均值表示,用SPSS13.0软件进行统计分析.
2 结果与分析
2.1 培养基成分对菌丝生物量的影响
2.1.1 碳源的筛选
由表2结果可知,以葡萄糖作碳源的培养基中,菌丝体生物量最高,为20.48 g/L,其次是蔗糖、麦芽糖和果糖,以乳糖作碳源时生物量最小,其中葡萄糖与蔗糖对菌丝生物量的影响差异未达到极显著水平,而与其他各种碳源之间菌丝生物量差异达到极显著水平.因此以下实验选用葡萄糖为碳源.

表2 不同碳氮源对蝉拟青霉菌丝体生物量的影响Tab.2 Effects of different carbon and n itrogen sourceson biomasses
2.1.2 氮源的筛选
由表2结果可知,不同的氮源对蝉拟青霉菌丝生物量的影响顺序依次是:蛋白胨>酵母膏>牛肉膏>硫酸铵>硝酸钠,有机氮源明显优于无机氮源,铵态氮优于硝态氮.其中蛋白胨与其他各种氮源对菌丝生物量的影响差异达到极显著水平,即以蛋白胨作为氮源效果最好(22.86 g/L),其次是酵母膏,因此下面正交实验选用蛋白胨为氮源.
2.1.3 培养基成分综合实验
选用葡萄糖作为碳源,蛋白胨作为氮源,K2HPO4和M gSO4作为无机盐,进行L9(34)正交实验(表3).实验结果表明,葡萄糖的极差最大,是影响发酵菌丝体生物量的主要因素,其次是蛋白胨,K2HPO4的极差最小,各因素对菌丝产量影响的主次顺序为A>B>D>C.从发酵菌丝体生物量来考察各因素水平值,A可取A2,B可取B3,C可取C1,D可取D2,最佳培养基组合为A2B3C1D2,即以菌丝生物量来考察,选定最适合培养基的组合为葡萄糖3%(质量分数,下同),蛋白胨1.5%,磷酸氢二钾0.1%,硫酸镁0.2%.
2.2 培养条件对菌丝生物量的影响
以筛选出的培养基(质量分数葡萄糖3%,蛋白胨1.5%,磷酸氢二钾0.1%,硫酸镁0.2%)来进行如下实验.
2.2.1 温度对菌丝生物量的影响
500 m L三角瓶装100 m L培养液,接种量10%,转速120 r/min,置于21,23,25,27,29℃下接种培养,7 d后测定培养温度对菌丝生物量的影响.结果如图1所示,21~25℃,菌丝体生物量随温度升高而增加,25℃时菌丝生物量达到最大(22.90 g/L),与27℃菌丝体生物量(22.61 g/L)差异不显著.当温度超过
27℃菌丝体生物量逐渐下降,表明25~27℃为适宜培养温度.

表3 各组分L9(34)正交实验结果Tab.3 Var iance analysis of the orthogonal test
2.2.2 初始p H值对菌丝生物量的影响
500 m L三角瓶装100 m L培养液,接种量10%,转速120 r/min,将p H值分别调为4~10进行实验,25℃下培养7 d后,结果如图2所示.由图2可知,在p H 6时菌丝产量最高,达到22.51 g/L,但与p H 7菌丝生物量差异不显著,若提高p H,则菌丝生物量会很快下降,因此应选择初始p H为6~7,一般选择自然即可.

图1 温度对菌丝生物量的影响Fig.1 Effects of the tem perature on biomasses of mycelia
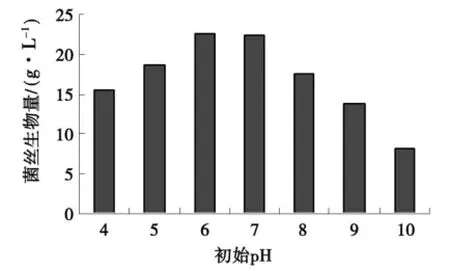
图2 初始p H对菌丝生物量的影响Fig.2 Effects of initial pH on biomasses of mycelia
2.2.3 瓶装量对菌丝生物量的影响
500 mL三角瓶中分别装入100,150,200,250 mL培养液,接种量10%,转速120 r/min,25℃下培养7 d后,结果如图3.图3显示,装液量为100 m L时,发酵菌丝体的菌丝干重最高,达到22.53 g/L.因此选用500 m L三角瓶装100 m L液体培养液为好.
2.2.4 摇床转速对菌丝生物量的影响
选择10%接种量,分别选取100,125,150,175,200 r/min转速,25℃振荡培养7 d.从图4可知,转速增加,通气量增大,溶解氧增多,菌丝生长量增多,菌丝球直径变小.当转速达到200 r/min时,菌丝生长量最大(23.5 g/L);其次是150 r/min,但二者无差异,除了175 r/min外,与其他差异显著.综合菌丝生长和菌丝球直径大小2个因素的关系,振荡转速以150 r/min为宜.

图3 瓶装量对菌丝生物量的影响Fig.3 Effectsof culture volumeson biomasses of mycelia
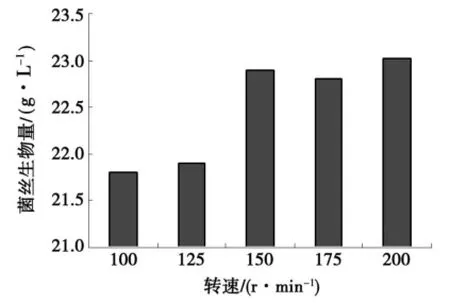
图4 转速对菌丝生物量的影响Fig.4 Effects of rotation speed on biomasses of mycelia
2.2.5 接种量对菌丝生物量的影响
500 m L三角瓶装100 m L培养液,温度25℃,转速150 r/min,选择接种量分别为2%,4%,6%,8%,10%,12%,14%,16%进行实验,结果见图5.7 d后各处理菌丝生物量在接种量为2%~8%时,随着接种量的增加菌丝生物量逐渐增加,当接种量为8%时,菌丝生物量为23.03 g/L,达到最高,但与6%,10%接种量差异不显著,考虑到工业化大规模生产的实际,可以选择6%的接种量.
2.2.6 培养时间对菌丝生物量的影响
在500 mL摇瓶中,采用上述已确定的最佳发酵条件进行发酵实验,以确定最适发酵周期,选择培养时间分别为3,4,5,6,7,8,9,10 d进行实验,结果见图6.在发酵过程中,随着培养时间的延长,菌丝生物量逐渐增加,到第8天菌丝生物量为22.6 g/L,达到最大,但与第7天菌丝生物量无差异.此后若再继续培养,则因溶氧量降低,菌体老化自溶,导致菌丝生物量有所下降.

图5 接种量对菌丝生物量的影响Fig.5 Effectsof amount of inoculum on biomassesof mycelia

图6 培养时间对菌丝生物量的影响Fig.6 Effects of culture time on biomasses of mycelia
3 讨论
影响微生物生长的因子很多,本文初步探讨了C源、N源、无机盐以及液体培养参数对蝉拟青霉菌丝生长的影响.研究结果表明,蝉拟青霉对供试碳源都有不同程度的利用,但葡萄糖和蔗糖较为理想.菌丝体能利用有机氮和铵态氮,有机氮比无机氮更利于菌丝生长.
蝉拟青霉液体发酵研究表明,25~27℃为最适温度段;该菌对p H值要求不高,在初始p H 6~7内生长最快;发酵过程中通气状况对菌丝的生长状况影响很大,而装液量的多少直接影响培养基的通气状况.若装液量过大则影响通气,菌丝缺氧而生长缓慢,通气过多(装液量少),菌体过度生长,反而影响菌球数量,使菌球干重减少.实验表明,当装液量为500 m L三角瓶装100 m L时菌丝干重达到最高;考察菌丝生物量,培养7 d即可终止发酵,但若要考察其他代谢产物,还需要进一步研究.
本实验是摇瓶研究结果,对小规模的发酵生产有指导作用,为大规模发酵生产的研究提供参考,但对于在工厂化生产中的应用有待进一步研究.
[1]王琪,刘作易.药用真菌蝉花的研究进展[J].中草药,2004,34(4):469-471.
[2]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1999:2557.
[3]陈祝安.蝉花的人工培养及其药理作用研究[J].真菌学报,1993,12(2):138-144.
[4]刘广玉,胡菽英.天然蝉花和人工培养品镇静镇痛作用的比较[J].现代应用药学,1991,8(2):5-8.
[5]陈万群,陈古荣.冬虫夏草代用品研究进展[J].中草药,1994,25(5):269-271.
[6]俞滢,顾蕾,陈启琪,等.蝉花的化学成分分析[J].杭州师范学院学报,1997(6):61-66.
[7]邓淑群.中国的真菌[M].北京:科学出版社,1963.
[8]陈祝安.虫生真菌蝉拟青霉的研究[J].真菌学报,1991,10(4):280-287.
[9]KA TSUH IKO,YAGINUMA.PaecilomycescicadaeSam son isolated from soil and cicada and its virulence to the peach fruit mothCarposinasasakiiMatsumura[J].Japanese Journal of App lied Entomology and Zoology,2002,46(4):225-231.
[10]张永军,刘爱英,梁宗琦.紫外线对蝉拟青霉原生质体的诱变效果[J].贵州农业科学,1998,26(6):1-3.
[11]邹晓,刘爱英,梁宗琦.紫外线诱变蝉拟青霉对白粉虱致病性的影响[J].菌物研究,2004,2(4):35-39.
[12]赵杰宏,韩洁,邹晓,等.蝉拟青霉异核体菌株和亲本菌株对蚜虫致病力的研究[J].莱阳农学院学报:自然科学版,2006,23(4):276-279.
[13]李忠,金道超,邹晓,等.蝉拟青霉不同来源菌株的生长特性及对蚜虫的致病性[J].植物保护学报,2007,34(6):637-641.
(责任编辑:赵藏赏)
Study on Submerged Fermentation of Paecilom yces cicadae
LIZhong1,2,LIU Ai-ying3,JIN Dao-chao2
(1.Co llege of Agriculture,Guizhou University,Guiyang 550025,China;2.Key Labo ratory fo r Plant Pest M anagement in M ountain A gricultu re,Guizhou University,Guiyang 550025,China;3.Institute of Fungus Resources,Guizhou University,Guiyang 550025,China)
In order to screen an op timum culturingmedium and fermentation conditionsofPaecilomyces cicadae,single facto r test in flask w as carried out.The results show ed that glucose w as good carbon source,and pep tone was nitrogen source.Then,in the o rthogonal test,C-sources,N-sources and inorganic salts K2HPO4and M gSO4were considered as influencing factors,and themycelia biomassas themajo r perfo rmance index.The op tim um medium components(mass fraction)w ere as follow:glucose 3%,pep tone 1.5%,K2HPO40.1%,M gSO40.1%.The highest yield of mycelia w asobtained after fermentation for 7 dayson the conditions that the temperaturewasat 25—27℃,the initial p H was6—7,the shaker rotation speed was at150 r/min,the amountof inoculum was6%,themedium capacity was100mL in 500 mL flask.
Paecilomycescicadae;submerged fermentation;medium op timization;fermentative condition
Q 946
A
1000-1565(2010)06-0682-06
2009-04-19
国家自然科学基金资助项目(30360064);贵州大学人才基金项目(贵大人基合字(2008)031号)
李忠(1971—),男,贵州瓮安人,贵州大学副教授,博士,主要从事微生物学、植物病虫害生物防治研究.
