毛细管电泳-联吡啶钌电化学发光测定利多卡因
2010-11-07孙汉文问海芳苏明
孙汉文,问海芳,苏明
(1.河北大学化学与环境科学学院,河北保定 071002;2.河北化工医药职业技术学院,河北石家庄 050026)
毛细管电泳-联吡啶钌电化学发光测定利多卡因
孙汉文1,问海芳1,苏明2
(1.河北大学化学与环境科学学院,河北保定 071002;2.河北化工医药职业技术学院,河北石家庄 050026)
基于利多卡因对联吡啶钌在铂电极上的电致发光信号有增敏作用,建立了一种测定利多卡因的毛细管电泳-电化学发光分析方法.讨论了磷酸盐缓冲液p H值、浓度、分离电压、检测电位等实验参数对利多卡因分离检测的影响.在优化的实验条件下,利多卡因在1.5~740μmo l/L内呈良好线性,检出限为0.1μmol/L.应用此法测定了尿液中利多卡因的含量,回收率为90%~93.5%.
毛细管电泳;电化学发光;利多卡因
利多卡因为酰胺类局麻药及抗心律失常药,麻醉作用比普鲁卡因强2倍,主要用于浸润麻醉、硬膜外麻醉、表面麻醉及神经传导阻滞.血液吸收后或静脉给药,对中枢神经系统有明显的兴奋和抑制双相作用,血药浓度较低时,出现镇痛和思睡、痛阈提高;随着剂量加大,作用或毒性增强,亚中毒血药浓度时有抗惊厥作用.当血药浓度超过5μg/m L可发生惊厥.本药在低剂量时,可促进心肌细胞内K+外流,降低心肌的自律性,而具有抗室性心率失常作用;在治疗剂量时,对心肌细胞的电活动、房室传导和心肌的收缩无明显影响;血药浓度进一步升高,可引起心脏传导速度减慢,房室传导阻滞,抑制心肌收缩力和使心排血量下降.目前,高效液相色谱法[1-11]、液质联用[12-14]、气相色谱法[15]、分光光度法[16]、毛细管电泳法[17]等已用于研究利多卡因,但这些方法操作繁琐,耗时,使用有机溶剂,运行成本较高.
电化学发光(ECL)是通过施加一定的电压进行电化学反应,在电极表面产生的电生物质之间或电生物质与体系中某些组分之间通过电子传递形成激发态,由激发态返回基态的发光现象.由于钌联吡啶具有水溶性好、稳定性强、发光效率高、电化学可逆、灵敏度高、检测范围宽等优点,是如今应用最广的电化学发光试剂之一.自1987年发现Ru(bpy)32+-烷基胺的ECL强度与胺的结构有关,开始用于分析化学.将毛细管电泳(CE)-电化学发光(ECL)结合起来,不仅具有CE的高效快速分离等特点,又发挥了ECL高选择性、高灵敏的优点,已成功应用于一些胺类药物和氨基酸等生化物质的检测.本实验通过优化参数条件建立了一种高效、快速、简单、灵敏测定利多卡因的新方法,并用于实际样品中利多卡因的测定.
1 实验部分
1.1 仪器与试剂
M PI-B型多参数化学发光分析测试系统(西安瑞迈电子科技有限公司);电化学检测采用三电极系统:直径300μm铂盘电极为工作电极,Ag/AgCl电极为参比电极,铂电极为辅助电极;p HS-3C酸度计(上海雷磁分析仪器厂);未涂层石英毛细管40 cm×25μm(i.d.)(河北永年光导纤维厂).
联吡啶钌(Sigma-A ldrich),盐酸利多卡因(中国药品生物制品检定所).联吡啶钌和利多卡因储备液用二次水配制,并于4℃保存在冰箱中,实验前稀释到所需浓度.电泳缓冲液为磷酸二氢钠-磷酸氢二钠溶液,p H由0.1 mo l/L氢氧化钠和磷酸调节.所用试剂均为分析纯.
1.2 实验方法
工作电极每两星期取出用0.3μm A l2O3粉末抛光,在水中用超声波洗净后,将其放置在正对毛细管出口末端处.采用10 kV×10 s电动进样,分离电压为15 kV.每次使用前用0.1 mo l/L氢氧化钠,水,10 mmol/L磷酸盐缓冲液各冲洗5 min.所有溶液在进入毛细管前须用0.22μm混合纤维素膜过滤.实验前ECL池中充满5 mmol/L Ru(bpy)32+和70 mmo l/L p H=8.53磷酸盐缓冲液350μL,实验3 h后更换新鲜ECL溶液,以保持实验重现性;光电倍增管的高压设为800 V.
1.3 尿样处理
取志愿者新鲜尿样1 m L于10 m L离心管中,加入乙腈5 m L,混合,旋涡震荡2 min,以4 000 r/min离心5 min,取上层清液于50℃氮气流下吹干,残余物溶于1 m L水中,过滤后滤液用于测定.
2 结果与讨论
2.1 ECL检测条件的优化
2.1.1 工作电极电位的影响
施加在工作电极上的电位是影响ECL强度的一个重要因素.工作电极电位(Ag/AgCl)对ECL强度的影响如图1所示.在1.0~1.25 V内,ECL强度随着工作电极电位的增加而增强,这是因为ECL强度与发光试剂的氧化速率有关,而其氧化速率与施加在工作电极上的电压相关.当电极电位超过1.25 V时,ECL强度随电极电位的增加而下降,可能是水的氧化抑制了电化学发光.故选择1.25 V为最佳检测电位.
2.1.2 检测池中缓冲液的影响
以往实验表明,当ECL检测池中Ru(bpy)32+浓度为5 mmol/L时,有最大信噪比.此外,磷酸盐缓冲液的浓度和p H对Ru(bpy)33+/胺类物质电化学发光中电子转移有较大的影响(图2).实验发现,当缓冲液在p H=4.9~10.0内变化时,ECL强度在p H 8.53达最大值.控制缓冲溶液p H不变,磷酸盐浓度在20~80 mmol/L内变化时,ECL强度在70 mmol/L处最强,故选定ECL池中缓冲溶液p H 8.53,浓度为70 mmol/L.
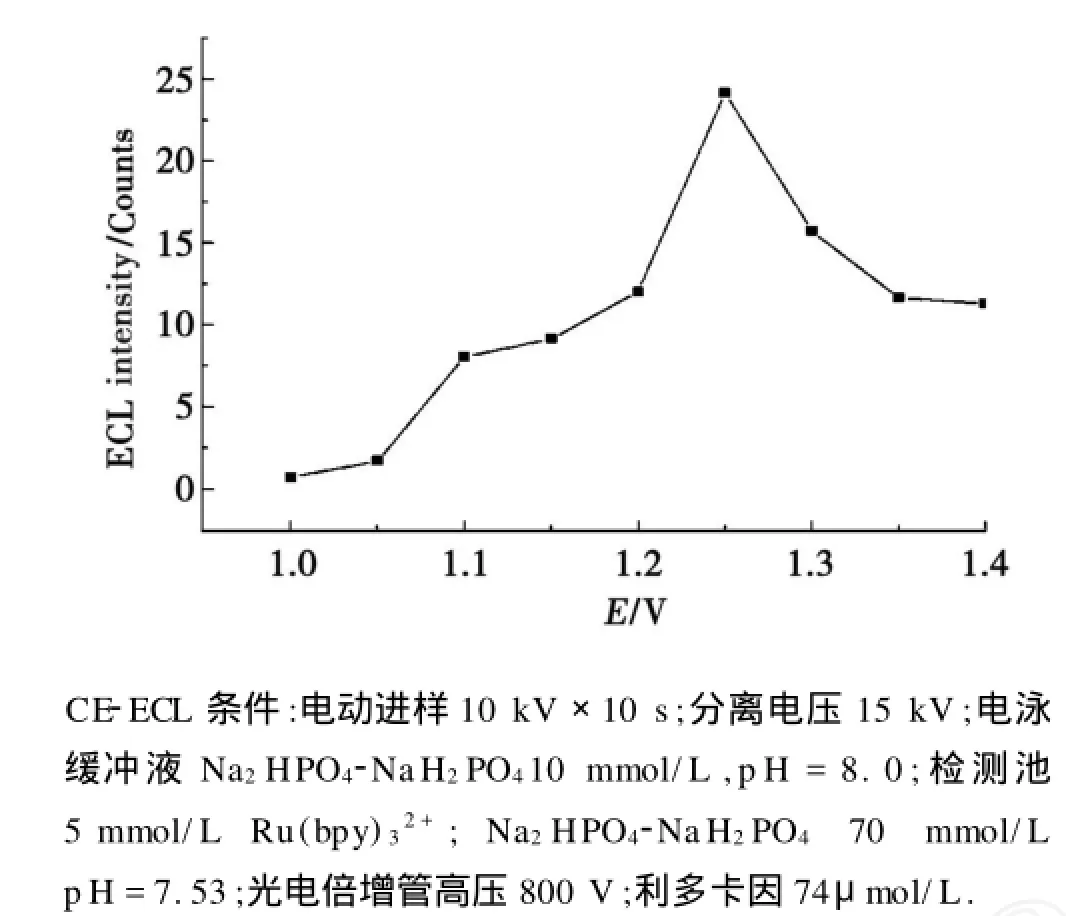
图1 工作电极电位对电化学发光强度的影响Fig.1 Effect of applied voltage on the ECL intensity

图2 检测池中缓冲液pH对电化学发光强度的影响Fig.2 Effect of buffer pH on the ECL intensity
2.2 分离条件的优化
2.2.1 运行缓冲液的影响
在CE-ECL体系中,电泳缓冲液浓度和p H值与分析物的分离效果和ECL强度相关.在p H 5.0~10.0内考察了利多卡因的电泳行为和ECL强度.在p H5.0~8.0内,ECL强度随p H增大而升高,当p H高于8.0时,ECL强度下降,可能是由于p H升高,带正电荷的利多卡因质子化程度降低,对Ru(bpy)32+的催化氧化减弱,与此同时随碱性增强,OH-与Ru(bp y)33+反应消耗了发光试剂,导致ECL强度降低.固定p H为8.0,当缓冲液浓度在5~30 mmo l/L内变化时,利多卡因的迁移时间变长,这是由于随缓冲溶液浓度的增大,离子强度增加,电渗流减小.ECL强度先增强后减小,在浓度为10 mmol/L时,分析时间较短,ECL强度最高.因此,电泳缓冲液以10 mmo l/L,p H=8.0的磷酸盐为宜.
2.2.2 分离电压的选择
分离电压影响分析物的电化学发光强度和迁移时间.考察了利多卡因分离电压在10~20 kV内对ECL强度和电泳行为的影响.在5~15 kV内,随着分离电压的升高,利多卡因的电化学发光强度逐渐增大,迁移时间越来越短.当分离电压超过15 kV时,利多卡因的电化学发光强度开始下降,同时,背景噪音增大,这是由于单位长度毛细管承受高压增加,焦耳热增加的缘故.综合以上几个因素,选择15 kV作为最优分离电压.
2.3 线性范围、精密度和检出限
在所选的最优条件下,对不同浓度的利多卡因进行测定,在1.5~740μmol/内呈良好线性关系,其线性回归方程为y=9 282 x+92,r=0.989 2.对3.7μmo l/L利多卡因进行了5次测定,峰高的RSD为4.0%,迁移时间RSD为0.7%.根据IUPAC对检出限的规定,本方法的检出限(3σ)为0.1μmo l/L.
2.4 样品测定
新鲜尿样经前述方法处理后,将样品平均分成3份,分别向每份添加一定量的利多卡因标准液进行测定,得到加标前后CE-ECL图.从图3可以看出,尿样中的杂质不干扰利多卡因的测定,因此,用CE-ECL法可直接测定尿样中的利多卡因.样品的回收率为90%~93.5%.结果见表1.
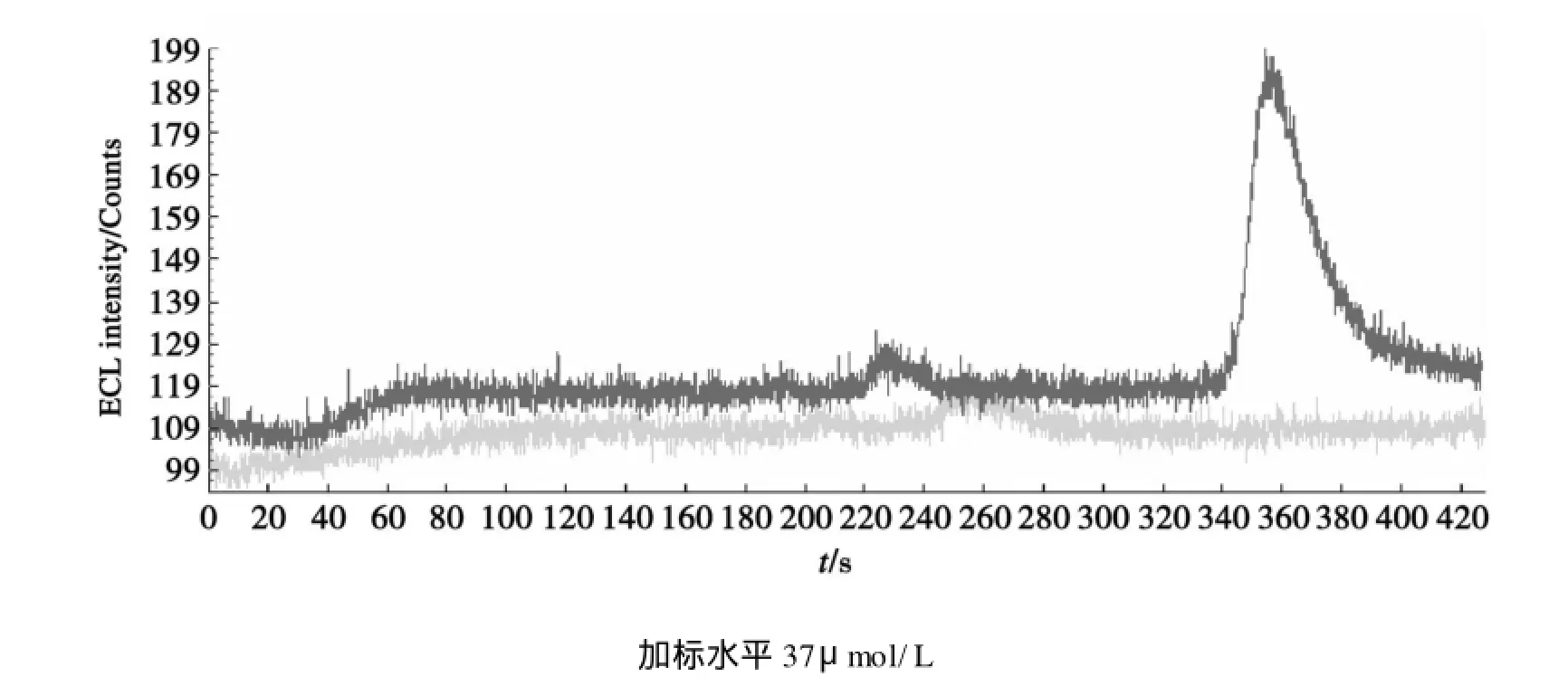
图3 空白和加标尿样电泳图Fig.3 Electropherograms of blank urine and urine sam ple spiked with 37μμmol/L lidocaine
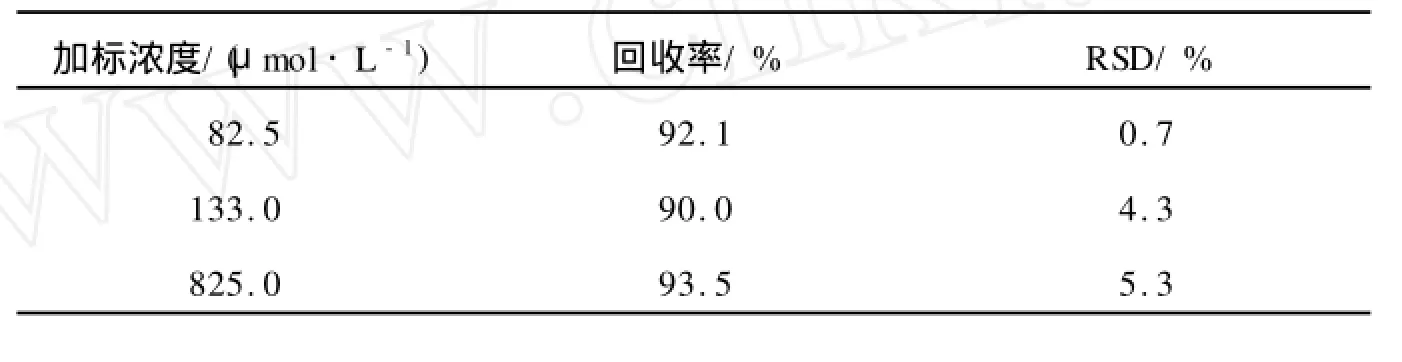
表1 尿样中利多卡因加标回收的测定结果(n=5)Tab.1 Determ ination results of lidocaine in human urine(n=5)
[1]CHEN Lili,L IAO Linchuan,ZUO Zhong,et al.Simultaneous determ ination of nikethamide and lidocaine in human blood and cerebrospinal fluid by high performance liquid chromatography[J].Journalof Pharmaceutical and Biomedical Analysis,2007,43(5):1757-1762.
[2]ZHANG Zhaohui,ZHAO Qian,KANG Shaoying,et al.Determination of local anesthetics in human p lasma by liquid-liquid-liquid microextraction coup led w ith high perfo rmance liquid chromatography[J].Chinese Journalof Analytical Chem istry,2006,34(2):165-169.
[3]MA M ing,KANG Shaoying,ZHAO Qian,et al.Liquid-phasem icroextraction combined w ith high-perfo rmance liquid chromatography fo r the determination of local anaesthetics in human urine[J].Journal of Pharmaceutical and Biomedical Analysis,2006,40(1):128-135.
[4]ZIVANOV IC L J,ZECEV IC M,MARKOV IC S,et al.Validation of liquid chromatographic method fo r analysis of lidocaine hydrochlo ride,dexamethasone acetate,calcium dobesilate,buthylhydroxyanisol and degradation p roduct hydroquinone in supposito ries and ointment[J].Journalof Chromatography A,2005,1088(1-2):182-186.
[5]MALENOV IC A,M EDEN ICA M,IVANOV ICD,et al.Development and validation of RP-HPLCmethod fo r cetrimonium bromide and lidocaine determination[J].Il Farmaco,2005,60(2):157-161.
[6]JADW IGA PIWOWARSKA,JUL ITA KUCZYñSKA,JAN PACHECKA.L iquid chromatographic method fo r the determination of lidocaine and monoethylglycine xylidide in human serum containing various concentrations of bilirubin fo r the assessment of liver function[J].Journal of Chromatography B,2004,805(1):1-5.
[7]NAPAPORN YOUNGV ISES,BOONSOM L IAWRUANGRA TH,SA ISUNEE L IAWRUANGRA TH.Simultaneous mi-cellar LC determination of lidocaine and tolperisone[J].Journal of Pharmaceutical and Biomedical Analysis,2003,31(4):629-638.
[8]SA ISUNEE L IAWRUANGRA TH,BOONSOM L IAWRUANGRA TH,PIYAPORN PIBOOL.Simultaneous determination of tolperisone and lidocaine by high performance liquid chromatography[J].Journal of Pharmaceutical and Biomedical Analysis,2001,26(5-6):865-872.
[9]SOM CHART KANJANAW A TTANA,CHU TIM A M ANGKORN KARN,PRAPIN W ILA IRA T,et al.Determination of lidocaine in dental pulp by high-perfo rmance liquid chromatography[J].Journal of Endodontics,2001,27(1):31-35.
[10]龚善初,王乾洲,詹元年.反相高效液相色谱法同时测定人血浆中奎尼丁、利多卡因及普罗帕酮的浓度[J].中国医院药学杂志,2000,20(7):405-407.
[11]吴群林,王捷,王若松,等.RP-HPLC同时测定人血浆丙泊酚和利多卡因[J].中国药学杂志,2001,36(4):271-274.
[12]MAESA,W EILAND L,SANDERSEN C,et al.Croubels.Determination of lidocaine and its two N-desethylated metabolites in dog and ho rse p lasma by high-perfo rmance liquid chromatography combined w ith electrosp ray ionization tandem mass spectrometry[J].Journal of Chromatography B,2007,852(1-2):180-187.
[13]ZEKIAL TUN,MOHAM ED ABDEL-REH IM,LARSGBLOMBERG.New trends in samp le preparation:on-linemicroextraction in packed syringe(M EPS)fo r LC and GC app lications:PartⅢ:Determination and validation of local anaesthetics in human p lasma samp les using a cation-exchange so rbent,and M EPS-LC-MS-MS[J].Journalof Chromatography B,2004,813(1-2):129-135.
[14]MOHAM ED ABDEL-REH IM,MARGARETA B IELENSTEIN,YVONNEASKEMARK,et al.High-perfo rmance liquid chromatography-tandem electrospray mass spectrometry fo r the determination of lidocaine and its metabolites in human p lasma and urine[J].Journal of Chromatography B:Biomedical Sciences and App lications,2000,741(2):175-188.
[15]E H M KOSTER,CWEM ES,JB MORSIN K,et al.Determ ination of lidocaine in p lasma by direct solid-phasemicroextraction combined w ith gas chromatography[J].Journal of Chromatography B:Biomedical Sciences and App lications,2000,739(1):175-182.
[16]秦宗会,沈光明,谭蓉,等.分光光度法测定不同介质中盐酸利多卡因的含量[J].中国药房,2007,18(34):2692-2694.
[17]YING Xuebo,KANGJianzhen,FANGLanyun,et al.Sho rt-capillary electrophoresisw ith electrochemiluminescence detection using po rous etched joint fo r fast analysisof lidocaine and ofloxacin[J].Journalof Chromatography A,2004,1055(1-2):223-228.
(责任编辑:梁俊红)
A Capillary Electrophoresis Method for the Analysis of L idocaine by Electrochem ilum inescence with Tris(2,2′-bipyridyl)ruthen ium(Ⅱ)
SUN Han-wen1,WEN Hai-fang1,SUMing2
(1.College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China;
2.Hebei Chemical and Pharmaceutical College,Shijiazhuang 050026,China)
A rapid,simp le and sensitive method was developed fo r the determination of lidocaine by capillary electrophoresisw ith electrochemiluminescence(ECL)detection,w hich was based on lidocaine enhanced the ECL intensity of tris(2,2′-bip yridyl)ruthenium(Ⅱ)in PBSmedium.Samp le so lution w as injected to separation capillary of 40 cm length(25μm i.d.)by electrokinetic injection for 10 s at 10 kV.Under the op timized conditions,the linear range f rom 1.5 to 740μmo l/L fo r lidocaine and detection limit(S/N=3)of 0.1μmol/L were achieved.The RSD of ECL intensity and the migration time for five continuous injections of 3.7μmol/L were 4.0%and 0.7%,respectively.This method was successfully app lied to lidocaine assay in urine samples w ith the recovery of 90%—93.5%.
capillary electropho resis;electrochemiluminescence;lidocaine
O 657.3
A
1000-1565(2010)06-0652-05
2009-11-26
教育部博士点学科基金资助项目(20050075003);河北省自然科学基金资助项目(B2008000583)
孙汉文(1945—),男,河北魏县人,河北大学教授,博士生导师,主要从事光谱学分析、分离科学技术、环境分析化学与农兽药残留分析研究.
