交联壳聚糖树脂对Ni(Ⅱ)的吸附性能
2010-11-07党明岩贾秀红赵春英
党明岩,贾秀红,赵春英
(沈阳理工大学环境与化学工程学院,辽宁沈阳 110168)
交联壳聚糖树脂对Ni(Ⅱ)的吸附性能
党明岩,贾秀红,赵春英
(沈阳理工大学环境与化学工程学院,辽宁沈阳 110168)
以环硫氯丙烷为交联剂,合成了交联壳聚糖树脂,研究了该树脂对Ni(Ⅱ)的吸附特性及吸附动力学。结果表明,当溶液pH为7~8时,Ni(Ⅱ)去除率较高;在吸附120min时,Ni(Ⅱ)去除率可达到99.1%;当ρ初始(Ni2+)增至60 mg/L时,树脂接近饱和吸附;树脂在20~40℃时以物理吸附为主。对树脂吸附动力学的研究表明,吸附过程符合一级动力学模型,液膜扩散为吸附过程的速率控制步骤。
壳聚糖;镍;吸附动力学
引 言
壳聚糖是自然界大量存在的甲壳素的脱乙酰产物,为链状大分子,含有大量的羟基,氨基,可借助氢键,也可借助盐键形成具有类似网状结构的笼形分子,进而对金属离子产生螯合作用,因此能有效地吸附或捕集溶液中的金属离子。壳聚糖的机械强度可通过适当的化学改性来增强,常用作螯合吸附剂,用于锌、铂、铜等重金属离子的去除或分离[1~3]。
电镀废水中往往含有多种重金属离子,其中镍离子会对生物体产生极大危害。去除水体中的镍可采用化学吸附法、电解法、螯合吸附法等方法,其中螯合吸附法具有去除率高、无二次污染、污泥便于回收、设备要求简单等优点,但常用的螯合吸附剂的成本偏高。本文基于成本低廉的天然产物壳聚糖,合成了新型的螯合吸附树脂,研究了其对Ni(Ⅱ)的吸附性能。
1 实验部分
1.1 仪器与试剂
TAS-990F原子吸收分光光度计;PHS-3C型精密酸度计;THZ-82恒温振荡器。
壳聚糖(脱乙酰度为95.7%,黏度为185mPa· s);高纯镍丝;其它试剂均为分析纯。
1.2 实验方法
1.2.1 交联剂的制备
将15.6mL环氧氯丙烷和50mL的蒸馏水在冰浴冷却后加入16.8g硫脲,搅拌反应4 h,将反应液倒入分液漏斗中静置分层,收集下层有机相,蒸馏,收集85℃馏分,即为交联剂(环硫氯丙烷),在0~5℃下保存备用[4]。
1.2.2 交联壳聚糖树脂的制备
用1%的醋酸水溶液将壳聚糖溶胀至半透明胶状,与过量的硫酸镍溶液混合,在20℃下恒温振荡2h,抽滤后干燥。取干燥后的产品悬浮于50mL蒸馏水中,加入6mL环硫氯丙烷进行交联反应,在搅拌下再滴加适量的NaOH溶液,使之在碱性条件下反应15h。将反应产物过滤洗涤至中性,再用乙醇清洗,在60℃干燥至质量恒定,得交联壳聚糖树脂。
1.2.3 Ni(Ⅱ)标准贮备液的配制
准确称取高纯镍丝1.000g,加硝酸10mL,用水浴加热使其完全溶解,蒸干后,加入5mL盐酸,再蒸干,用去离子水稀释至1 000mL,贮备液中ρ(Ni2+)为1 000mg/L。
1.2.4 树脂对Ni(Ⅱ)的静态吸附
准确称量一定量的交联壳聚糖,加入某一初始质量浓度的Ni(Ⅱ)溶液,调节其pH,在给定的温度下置于恒温振荡器中振荡吸附,定时取样,离心分离后取上清液,用原子吸收分光光度计测定其吸光度[5],通过预先测定的工作曲线求出吸附后溶液中的ρ(Ni2+),并按下式计算出Ni(Ⅱ)的去除率及树脂的吸附量。
树脂吸附量按Г=(ρo-ρ)V/m计算,Ni(Ⅱ)去除率按η=(ρo-ρ)/ρo计算。
式中:ρ0、ρ分别为Ni(Ⅱ)初始质量浓度和吸附后溶液中残留的Ni(Ⅱ)质量浓度,mg/g;V为溶液体积,mL;m为干树脂的质量,g。
2 结果与讨论
2.1 溶液pH对Ni(Ⅱ)去除率的影响
称取0.03g树脂,按1.2.4的实验方法,去除率η与溶液pH的关系如图1所示。
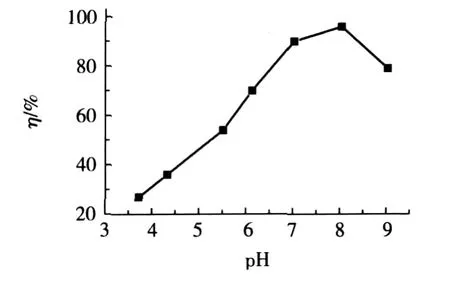
图1 pH对Ni(Ⅱ)去除率的影响
由图1可见,随着溶液pH的增加,Ni(Ⅱ)去除率也会增加,达峰值后pH继续增加时,去除率又随之下降。pH较小时,树脂分子链上的-NH2结合了H+,形成带正电荷的-NH3+,削弱了螯合金属离子的能力,同时由于树脂分子表面带正电荷,与带同种电荷的Ni(Ⅱ)产生静电斥力,也会使螯合机会减小。另外,H+与Ni(Ⅱ)存在着竞争吸附,从而使树脂对Ni(Ⅱ)的吸附量下降。而当溶液pH过大时,则会出现Ni(OH)2沉淀,影响树脂对Ni(Ⅱ)的吸附,因而酸度过低会导致吸附量降低。pH为7~8时Ni(Ⅱ)的去除率最高。
2.2 吸附时间对Ni(Ⅱ)去除率的影响
吸附时间对Ni(Ⅱ)去除率的影响如图2所示。

图2 吸附时间对Ni(Ⅱ)去除率的影响
由图2可见,吸附过程在初始阶段进行得较快,因为Ni(Ⅱ)主要被吸附在树脂颗粒的外表面,吸附过程容易进行,因而吸附速率较大,在30min时,Ni(Ⅱ)去除率已达到71.2%。随着吸附过程的进行,Ni(Ⅱ)开始沿树脂的孔隙向内部迁移、扩散,内扩散成为吸附速率的控制步骤,因此吸附速率逐渐降低。溶液中Ni(Ⅱ)的质量浓度越来越小,在120min时,质量浓度推动力趋近于零,吸附趋于平衡,这时树脂对Ni(Ⅱ)的去除率达99.1%。
2.3 ρo[Ni(Ⅱ)]对吸附量Г的影响
ρo[Ni(Ⅱ)]对吸附量Г的影响如图3所示。
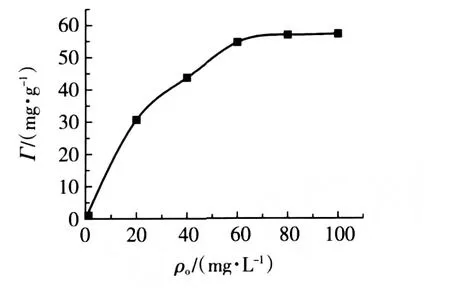
图3 ρo[Ni(Ⅱ)]对树脂吸附量的影响
由图3可见,随着溶液中ρo[Ni(Ⅱ)]的增加,Ni(Ⅱ)的去除率逐渐增大,当ρo[Ni(Ⅱ)]增至60 mg/g时,去除率增加趋势减慢,说明此时吸附过程趋近饱和,再增加ρo[Ni(Ⅱ)]对去除率影响不大。
2.4 温度对Ni(Ⅱ)吸附量的影响
树脂吸附量与温度之间的关系如图4所示。
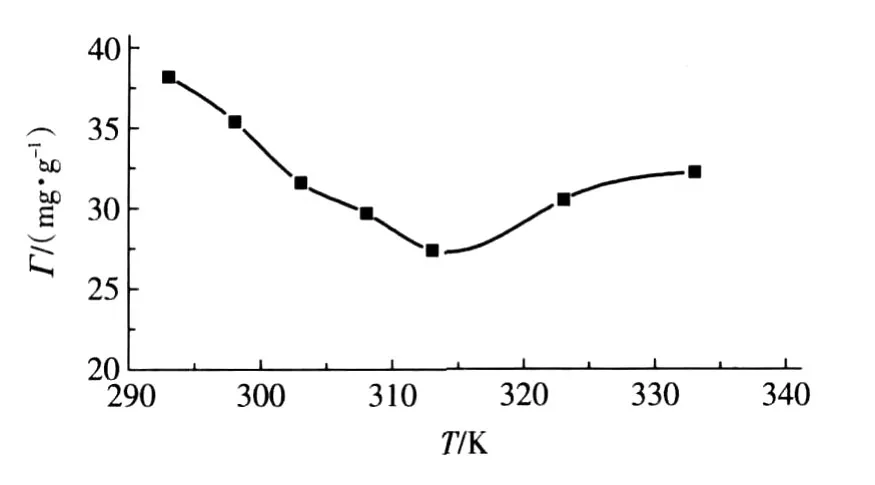
图4 温度对树脂吸附量的影响
由图4可见,在热力学温度为313~333K时,Г随温度升高而增加,因为升高温度时,溶液中离子运动速度加快,树脂活性增加,有利于吸附过程进行,因此树脂吸附量增大。而在293~313K的温度范围内,吸附量随温度升高而下降,这可能是因为在这一温度范围内树脂对Ni(Ⅱ)的吸附机理是以物理吸附为主,因为物理吸附过程是放热过程,根据吸附平衡理论,温度升高不利于吸附。
2.5 吸附动力学
不同温度下,树脂吸附量与吸附时间的关系曲线如图5所示。

图5 树脂吸附Ni(Ⅱ)的动力学曲线
由图5可见,在不同温度下,树脂吸附量随时间增长的趋势相近,都是在初始阶段快速吸附,到一定时间后吸附趋近平衡。采用一级动力学方程对吸附动力学数据进行线性拟合[6]。
一级动力学模型为

式中:t为吸附时间,min;Гt和Гe分别为t时刻和吸附平衡时的树脂吸附量,mg/g;k为表观吸附速率常数,min-1。
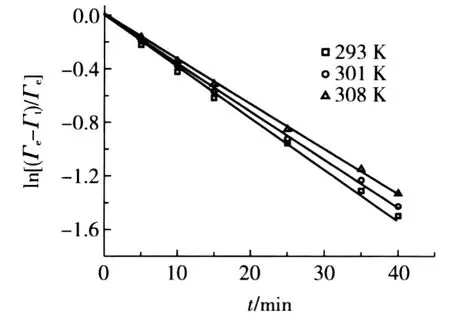
图6 一级动力学方程拟合曲线
由图6中不同温度下的拟合直线的斜率可以分别求得其表观吸附速率常数k,数据拟合的结果见表1。
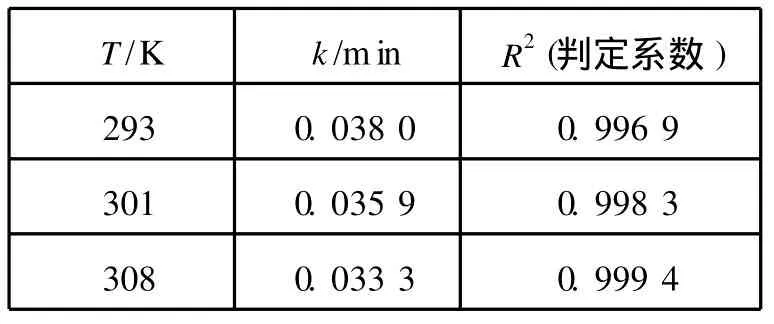
表1 吸附动力学参数
图6中良好的线性关系以及表1中的判定系数R2>0.99,表明了一级吸附动力学方程来描述树脂对Ni(Ⅱ)的吸附量随时间的变化关系是合适的。这也表明液膜扩散为吸附过程的速率控制步骤[7]。
3 结 论
交联壳聚糖树脂对Ni(Ⅱ)有较好的吸附性能,溶液的pH、吸附时间、初始质量浓度、温度等因素均对吸附过程有一定的影响。溶液pH对Ni(Ⅱ)的去除率影响较大,pH为7~8时,去除率较高;在30min时,树脂对Ni(Ⅱ)的去除率可达到71.2%,在120min时,去除率可达99.1%;当ρo[Ni(Ⅱ)]增至60 mg/g时,树脂接近饱和吸附;树脂在20~40℃时以物理吸附为主。
对树脂吸附动力学的研究表明,吸附过程符合一级动力学模型,液膜扩散为吸附过程的速率控制步骤。
[1] 丁萍,黄可龙,李桂银.壳聚糖衍生物对Zn(Ⅱ)的吸
附动力学及机理研究[J].化学通报,2006,(7): 503-507.
[2] 党明岩,张廷安,王娉.新型交联壳聚糖树脂颗粒对铂的吸附行为[J].过程工程学报,2008,8(1):86-90.
[3] Juang Rueyshin,Wu Fengchin,Tseng Ruling.Adsorption removal of copper(Ⅱ)using chitosan from simulated rinse solutions containing chelating agents[J].Wat. Res.,1999,33(10):2403-2409.
[4] Tabushi I,Tamaru Y,Yoshida Z.A Mechanistic Study of the Acetolyses of 3-chloropropene Sulfide and 2-chloroethylMethyl Sulfide[J].Bull Chem Soc Japan,1974,47(6):1455-1459.
[5] 冒爱荣.火焰原子吸收光谱法测定镀铬液中的镍[J].电镀与精饰,2008,30(3):35-37.
[6] Ho Y S,Mckay G.The sorption of lead[Ⅱ〗ionson peat [J].Wat Res,1999,33(2):578-584.
[7] Boyd G E,Adamson A W,Myers L S.The exchange. adsorption of ions from aqueous solutions by organnic zeolitesⅡkinetics[J].J Am Chem Soc,1947,(69):2836-2848.
Adsorption performance of Crossli nked Chitosan Resi n for Nickle(II)ions
DANGMing-yan,J I A Xiu-hong,ZHAO Chun-ying
(School of Environmental&Chemical Engineering,Shenyang Ligong University,Shenyang 110168,China)
Crosslinked chitosan resin was synthesized using chloromethyl thiirane as crosslinking agent. The adsorption properties and the adsorption kinetics of the resin forNi(Ⅱ)were studied.Results show that the optimum pH value for the adsorption is bet ween 7 and 8;the adsorption rate can reach to 99.1% in 120 minutes’adsorption process;the adsorption reaches equilibration when the initial concentration of Ni(Ⅱ)is 60mg/L and the adsorption ismainly physisorbed at 20~40℃.Study on the adsorption kinetics shows that the adsorption follows the first-order kineticsmodel and liquid film diffusion is the control step.
chitosan;nickel;adsorption kinetics
X781.1
:A
1001-3849(2010)05-0008-04
2010-01-05
:2010-01-28
党明岩(1975-),女,辽宁铁岭人,沈阳理工大学环境与化学工程学院讲师,博士.
