谈元素电子构型的速写
2010-11-07王纪学张智敏
王纪学张智敏
(1北京师范大学化学学院 2008级本科生 北京 100875;2北京师范大学化学学院 2007级本科生 北京 100875)
谈元素电子构型的速写
王纪学1张智敏2
(1北京师范大学化学学院 2008级本科生 北京 100875;2北京师范大学化学学院 2007级本科生 北京 100875)
谈对元素电子构型的速写心得,指出与主量子数 n为奇数或偶数相关的经验公式——“奇偶公式”及快速确定轨道符号的“作差加 2”规则。
“多电子原子结构与周期律”一节是“原子结构”一章[1]中的重要内容,原子轨道近似能级图则是这节中的重点,掌握了这一规律才能更好地书写元素的电子构型。学生对此规律的掌握多采用机械式图形记忆,不仅费时、费力,而且易遗忘。虽有徐光宪教授的(n+0.7l)经验公式[2],以及电子填充顺序斜线图、电子填充顺序直线图等,但都不能让我们直接写出元素的电子构型。在《巧记原子轨道近似能级图》一文中,介绍了一种可快速书写元素电子构型的方法[3],但在书写原子序数较大的元素电子构型时该法并不方便。下面总结一种能够快速写出元素电子构型的方法。
1 奇偶公式
根据美国化学家 Pauling绘制的原子轨道能级图[1]可以得到:

轨道符号由主量子数 n和角量子数 l的符号组成;在主量子数 n一定时,角量子数 l的符号总是按 s p d f g h……的顺序排列。这样问题就可以转化为如何确定主量子数 n的排列。
先来观察一个电子填充顺序中主量子数 n的排列:
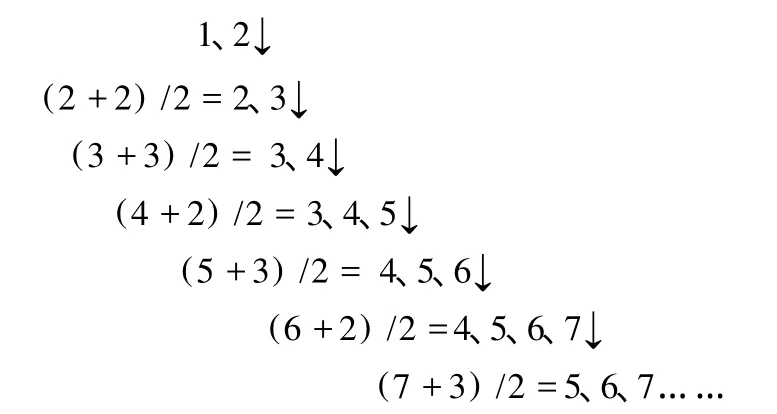
从而总结出“奇偶公式”:当主量子数 n为已出现的最大偶数时,其下一个主量子数为(n+2)/2,即从 (n+2)/2排到 n+1;当主量子数 n为已出现的最大非 1奇数时,其下一个主量子数为 (n+3)/2,即从 (n+3)/2排到 n+1。
例 1写出第 35号元素的电子构型。
解析:
(1)利用上述公式 ,可写出:1 2 2 3 3 4 3 4 5 4 5 6……;
(2)再添加 s2p6d10f14g18……即可得到:1s22s22p63s23p64s23d104p5;
(3)按 n由小到大调整,得其电子构型:1s22s22p63s23p63d104s24p5。
2 “作差加 2”规则
当我们写一些原子序数较大的元素电子构型时,再运用奇偶公式,从主量子数 n为 1写起,就不方便了。笔者认为这时就需要利用惰性气体的周期数、相关原子序数(表 1)及经验规律——“作差加 2”规则:
将 s p d f g h……依次编号为 1 2 3 4 5 6……,在第 n能级组 n n1n2……中,n后为 1号字母 s,n1后为│n-n1│+2号字母,n2后为│n-n2│+2号字母……。
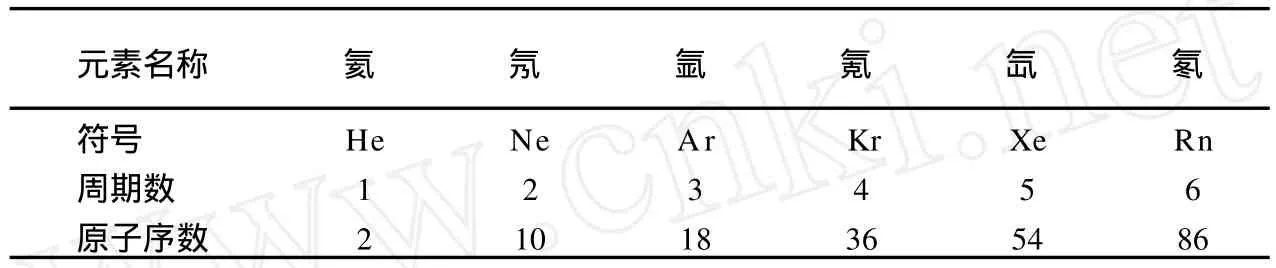
表1 稀有气体相关知识介绍
例 2写出第 72号元素的电子构型。
解析:
(1)由 54<72<86,写出:[Xe]6s24 5 6……
(2)利用“作差加 2”规则,有│6-4│+2=4,s2p6d10f14g18……中第 4个为 f,所以 4后为 f;│6-5│+2=3,s2p6d10f14g18……中第 3个为 d,所以 5后为 d。
(3)写出[Xe]6s24f145d2,按 n由小到大调整,得其电子构型[Xe]4f145d26s2。
例 3写出第 109号元素的电子构型。
同时利用两种方法进行对比解析:
方法一:
(1)利用上述公式,可写出:1 2 2 3 3 4 3 4 5 4 5 6 4 5 6 7 5 6 7 8……
(2)添加 s2p6d10f14g18……
即可得到:1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d7。
(3)按 n由小到大调整,得其外层电子构型,但书写起来很不方便。
方法二:
(1)由第 6周期 Rn——86,写出[Rn]7s2。
(2)由主量子数 7为奇数且首次出现,可知其下一个主量子数为 (7+3)/2=5,紧接着为6 7 8;由主量子数 8为偶数且首次出现,可知其下一个主量子数为 (8+2)/2=5,紧接着为 6 7 8 9……,即可得:[Rn]7s25 6 7 8s25 6 7……
(3)由│7-5│+2=4,知 5后为 s2p6d10f14g18……中的第 4个字母 f;由│7-6│+2= 3,知 6后为 s2p6d10f14g18……中的第 3个字母 d。
(4)可得:[Rn]7s25f146d7,调整后可得:[Rn]5f146d77s2。
3 小结
上述经验公式适用于已知的主族元素和部分副族元素,从另一种角度对元素电子构型进行了思考,利用公式及经验规律,可以巧妙地避开机械式记忆,能化繁琐为简单,使学生记得更牢,做得更快,学得更有趣。
然而,原子的电子构型非常复杂,笔者的“奇偶公式”及“作差加 2”规则只是经验之谈,水平有限,且不能通过理论分析与计算来确定,其局限性是在所难免的。现说明如下:
(1)“奇偶公式”及“作差加 2”规则只适用于判断多原子元素的电子构型,不适于氢原子或类氢原子。
(2)由于受屏蔽效应、洪特规则等因素的影响,有些元素 (特别是副族元素)轨道中的电子数目不符合一般规律,不适用于此经验公式。
(3)有些元素 (如 Pt[Xe]5d96s1及镧系、锕系中的一些元素)尚不能用一般的理论解释(可由光谱实验确定),也不适用于此经验公式。
[1] 华彤文,陈景祖.普通化学原理.第 3版.北京:北京大学出版社,2008
[2] 徐光宪,王祥云.物质结构.第2版.北京:高等教育出版社,1987
[3] 聂晓勤,刘兴前,陈风雷,等.数理医药学杂志,2002,15(5):473
