甘遂药材有毒成分、有效成分及其质量控制标准研究现状△
2010-11-07程显隆刘军玲肖新月马双成
程显隆,刘军玲,肖新月*,马双成
(1.中国药品生物制品检定所,北京 100050;2.安徽省食品药品检验所,安徽 合肥 230051)
甘遂药材有毒成分、有效成分及其质量控制标准研究现状△
程显隆1,刘军玲2,肖新月1*,马双成1
(1.中国药品生物制品检定所,北京 100050;2.安徽省食品药品检验所,安徽 合肥 230051)
综述了甘遂的化学成分、生物活性、分析方法及其质量标准方法的研究进展,为更深入研究开发甘遂及建立安全有效质量标准提供理论依据。
甘遂;化学成分;生物活性;分析方法;质量标准
甘遂始载于 《神农本草经》,列为下品。现行《中国药典》收载的甘遂为大戟科(Euphobiaceae)大戟属(Euphorbia)植物甘遂 Euphorbia kansui T.N.Liou ex T.P.Wang的干燥块根。性寒,味苦;有毒。具有泻水逐饮的功能。用于水肿胀满,胸腹积水,痰饮积聚,气逆咳喘,二便不利[1]。通常认为其毒性较强,临床使用剂量十分有限,过量则引起腹痛、腹泻,严重时会出现剧烈呕吐、血压下降、脱水和呼吸衰竭等症状。炮制后可降低其毒性,缓和峻泻作用[2]。现代研究表明,甘遂化学成分具有抗癌抗肿瘤活性、抗生育、抗病毒、抗胰腺炎等作用,可影响免疫系统的特异性[3]。由于 《中国药典》(2005年版)甘遂项下只收载了性状、显微鉴别、薄层鉴别、水分、灰分、浸出物项,无法有效控制其质量,为此我们开展了甘遂的有毒成分、有效成分及其检测方法和甘遂药用安全性、有效性的质量控制标准研究。本文就甘遂的化学成分及其生物活性的研究进展、质量评价标准情况进行综述。
1 甘遂化学成分研究
甘遂主要含有巨大戟二萜醇型(Ingenane)、假白榄酮型(Jatrophane)二萜类化合物,大戟醇型(Euphane)、甘遂醇型(Triucallane)三萜类化合物及其他成分[3]。
1.1 二萜类成分
1.1.1 巨大戟烷型二萜类化合物 巨大戟烷型二萜醇型化合物(化合物1~28)多为13-Oxyingenol(13-氧化巨大戟萜醇)和20-Deoxyingenol(20-去氧巨大戟萜醇)的衍生物,属于多氧二萜化合物,其基本母核是由5/7/7/3 4个环稠合而成,C-8和 C-10间通过酮基桥而连接[4],C-1,2的双键存在于B环,C-4为β-羟基,A/B环为反式骈环一个环丙烷构成D环。化合物1~28的结构式见图1。
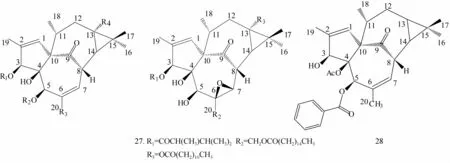

图1 化合物1~28的结构图
1.1.2 假白榄酮型二萜类化合物 假白榄酮型二萜类化合物(化合物29~37)也是甘遂中的二萜类成分之一,多为一个5元环与一个12元环骈合在一起而形成,同时某些位置的羟基形成醚或酯桥。化合物29~37的结构式见图2。
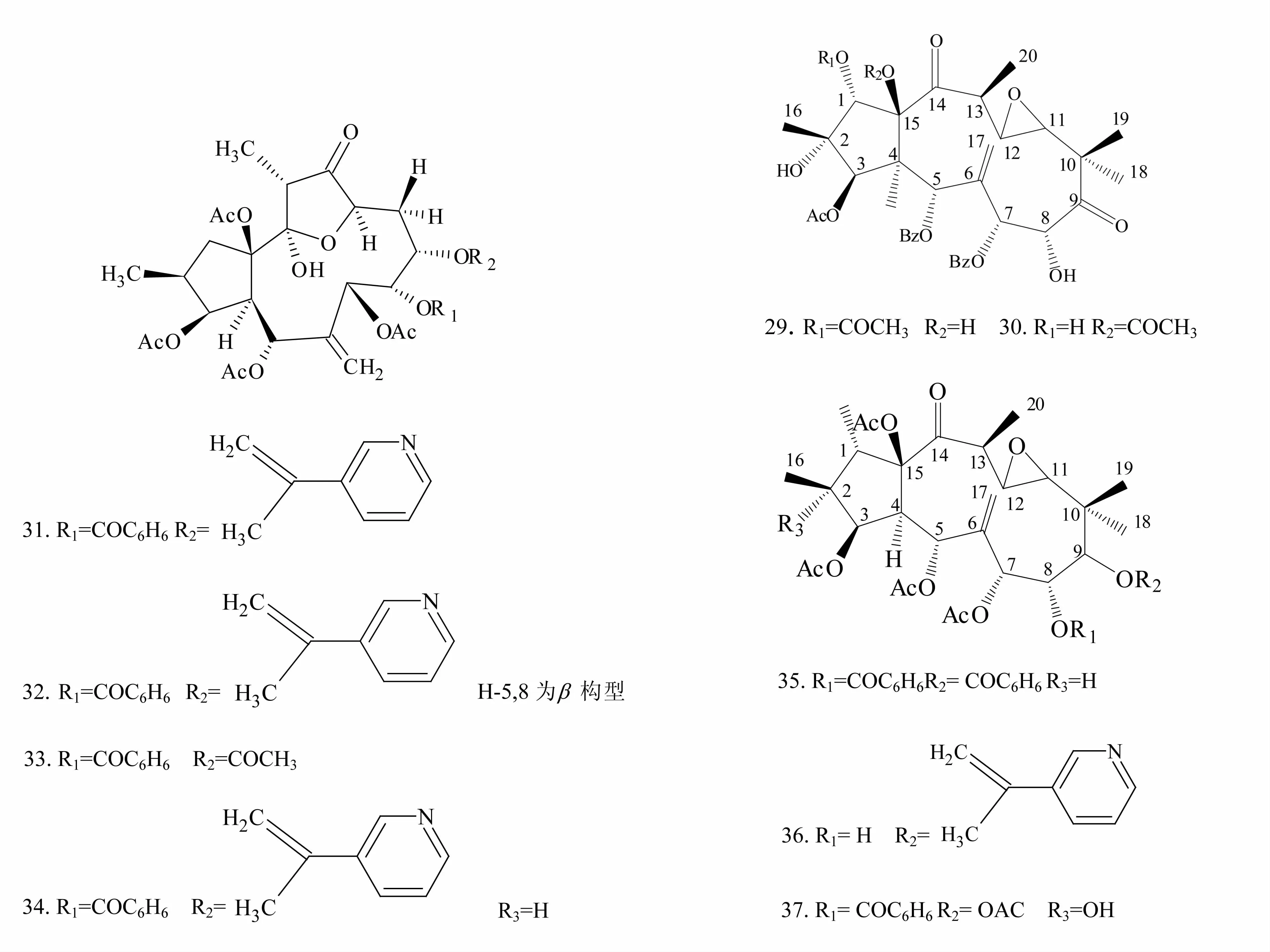
图2 化合物29~37的结构图
甘遂中的二萜类成分汇总见表1。
1.2 三萜类化学成分
三萜类化合物(38~44)均为四环三萜类化合物,分为两种类型,Euphane型化合物和Ttirucallane型化合物。二者区别在于21位甲基取向为α的为Euphane型,21位甲基取向为β的为Tirucallane型。通常在17位的长侧链上有双键,羰基出现在7位时,在8,9位出现双键。化合物39~44的结构式见图3。

图3 化合物39~44的结构图

表1 甘遂中的二萜类成分
甘遂中三萜类成分见表2。

表2 甘遂中的三萜类成分
1.3 其他类成分
王立岩等[11]还从甘遂分离得到了 Stigmast-5-ene-3β,7β-diol和 Stigmast-5-ene-3β,7α-diol,异东莨菪素(Isoscopoletin),β-谷甾醇(β-sitosterol)。此外甘遂中还含有棕榈酸(Palmitic acid)、柠檬酸(Critic acid)、草酸(Oxalic acid)、鞣质、树脂等[3]。
2 甘遂化学成分的生物活性研究
2.1 三萜类成分的生物活性
从甘遂引产有效成分的研究中,发现从甘遂中分离得到的大戟脑(mp116~117℃ )均有兴奋子宫的作用[26]。
甘遂中的三萜成分具有阻止细胞分裂的功能[27],其中7位有酮羰基的化合物表现出了一定的细胞分裂抑制活性和很强的NO抑制活性,如Kansenone;而7位无酮羰基的化合物没有表现出明显的细胞分裂抑制活性,如大戟二烯醇。但是Epi-Kansenone在30μg·mL-1时表现明显的细胞毒性,而Kansenonol则没有表现出明显的细胞毒性,推测可能是由于该化合物侧链上25位羟基的存在造成毒性降低[11]。
Yasukawa K等[24]从甘遂中分离出13种三萜类成分,这些成分均具有抗肿瘤的活性,其中以大戟二烯醇的活性最强。
大戟二烯醇对血压有调节作用。其对麻醉后血压正常的狗及小鼠具有降血压的作用;对使用过阿托品、安替斯丁、β-阻断剂等降压药物的狗及颈动脉窦切除的动物未产生降压作用,对脊柱切断、内脏去除、神经中枢阻断的狗的降血压作用增强。小鼠静脉注射大戟二烯醇的半数致死量为1 500mg·kg-1,小鼠口服大戟二烯醇的半数致死量为 2g·kg-1[28]。
2.2 二萜类成分的生物活性
2.2.1 抑制细胞分裂的活性 王立岩等[5]利用蛙卵动物极细胞分裂抑制活性实验,对从甘遂中分离得到的12种二萜醇类化合物进行了测试,认为其中9个巨大戟二萜醇型化合物和1个假白榄酮型化合物Kansuinin B具有抑制细胞分裂活性。
2.2.2 抗驱线虫活性 甘遂中的3个巨大戟二萜醇型化 合 物,20-O-acetyl-3-O-(2′E,4′Z-decadienoyl)ingenol、20-O-acetyl-5-O-(2′E,4′Z-decadienoyl)ingenol、3-O-(2′E,4′Z-decadienoyl)ingenol具有抗驱线虫活性[6]。
2.2.3 抗病毒活性 甘遂中的二萜醇类化合物,如KansuiphorinA、KansuiphorinB[29],甘遂大戟萜酯 A,13-十一酰基-3-(2,4-二甲基丁酰基)巨大戟萜酯,3-(癸-2,4-二烯酰基)巨大戟萜酯及甘遂萜酯A[30]具有抗病毒的活性,且这种活性与C-3和C-20位有无酰化基团的存在有关。这些成分的体内抗病毒活性可能是通过刺激淋巴细胞的增殖,增强杀伤病毒感染细胞能力来实现[31]。另外,发现甘遂醇提物中的巨大戟二萜醇型二萜酯类化合物有很强的抑制人类免疫缺陷病毒(HIV)增殖作用[32]。
2.2.4 抗癌和抗肿瘤活性 从甘遂中分离得到的两个巨大戟二萜醇型二萜酯[20],甘遂大戟萜酯A及甘遂大戟萜酯 B,对白血病(HL-60TB)、肺癌(H-322)、结肠癌(SW-620)、黑色素瘤(SK-MEL-5)和肾脏癌细胞(A-498)等某些人体癌细胞有选择性细胞毒作用。二萜醇类化合物的酯酰化取代基是影响其抗癌活性强度的主要官能团[33]。Yu FR[34]研究了从甘遂中提取得到的甲酯及其衍生物对于人胃癌细胞株(SGC-7901)的细胞凋亡和细胞周期的作用;其中6种甲酯及衍生物能够导致癌细胞生长抑制和凋亡。
2.2.5 对免疫系统作用 从甘遂中得到的3-O-2,3-二甲基丁酰基13-O-癸酰基巨大戟二萜醇对免疫性疾病具有潜在的治疗作用,是通过抑制IgE引导的肥大细胞的活化作用来实现的[35]。甘遂水煎剂醇沉物能使小鼠胸腺减轻和脾脏加重,能明显抑制小鼠抗羊红细胞(SRBC)抗体产生,提示甘遂对免疫系统有明显的抑制作用[36]。甘遂的热水提取物能提高免疫复合物(GAG)与巨噬细胞的结合能力。从甘遂中分离得到的 3-O-(2′E,4′Z-癸二烯酰基)巨大戟二萜醇及3-O-(2,3-二甲基丁酰基)-13-O-十二烷酰基巨大戟二萜醇能提高免疫复合物GAG(葡萄糖氧化酶-抗葡萄糖氧化酶复合物)与巨噬细胞的结合能力,且表现出量效关系[37-38]。
2.2.6 抗生育作用 王秋静等[36]对复方甘遂制剂宫内给药终止动物中期妊娠及毒性进行了研究,认为甘遂药材和复方皆对小鼠有终止中期妊娠作用。
从甘遂中提取得的巨大戟二萜醇对非洲蟾蜍胞胚期的细胞分裂有明显的抑制作用,同时也能抑制拓扑异构酶Ⅱ的活性。修彦凤等[38]认为甘遂终止妊娠的首要机制不是增加子宫收缩,而可能是对滋养细胞的选择性损害。
2.3 甘遂的急性长期毒性实验
韩向阳[39]研究发现,家兔连续给药7d(10mg·kg-1),第8天处死病检,心肝肾有一定的中毒性组织学改变。王秋静等[36]认为甘遂的急性长期毒性实验,虽然对心、肾显示出一定的病理变化,但均为变性改变,属于可逆性病理变化。
3 甘遂化学成分的分析方法研究
任树林等[40]研究甘遂在炮制前后化学成分的整体变化,以揭示炮制减毒、增效的物质基础,结果发现甘遂经过炮制后水煎液和醇提取液中,有的成分含量显著下降甚至消失,有成分的含量显著上升,还有新成分出现。作者认为甘遂炮制增效、减毒的物质基础可能是有毒成分的消失或含量减少,这些消失或含量减少的成分转变成了新成分或者在水中溶解度小而在醇中溶解度大的成分。
束晓云等[41]建立了甘遂饮片及其炮制品的指纹图谱。采用HPLC法,以胡薄荷酮作为内标参照品,乙腈-水为流动相梯度洗脱,结果甘遂饮片及其醋制品共有17个共有峰。炮制品与生品比较,有2种成分含量增加约40%左右,1种成分含量减少达70%;17个共有峰的相似度均在0.95以上。
修彦凤等[42]比较甘遂炮制前后成分的变化,以3-O-(2,3二甲基丁酸基)-13-O十一烷酸基巨大戟二萜醇为对照,建立生、制甘遂的HPLC-ELSD特征指纹谱并进行比较,结果发现在选定的色谱条件下,生、制甘遂的特征色谱峰分别为31、19个;甘遂炮制后大部分成分含量下降;不同成分间的含量比例有变化,成分的种类没有变化。
张丽等[43]建立了以甘遂的毒效成分之一3-O-(2′E,4′Z-癸二烯酸基)-2-O-乙酰基巨大戟二萜醇为指标的HPLC测定法,用于考察醋甘遂饮片的最佳炮制上艺。
本课题组[44]对甘遂中含有的2个有效成分大戟二烯醇及其同分异构体表大戟二烯醇含量测定方法进行了研究,建立了HPLC法,同时测定两成分的含量。
4 安全性和质量相关标准情况[1]
《中国药典》1963年版一部收载的甘遂为大戟科(Euphobiaceae)植物甘遂Euphorbia sp.的干燥根。均系野生,主产于陕西、山西、河南等地。药材检测项只有性状项;并规定 “以肥大饱满、表面洁白或黄色、细腻、断面粉性足、无纤维为佳。”
《中国药典》1977年版一部,收载的甘遂来源改为大戟科植物甘遂Euphorbia Kansui T.N.Lion ex T.P.wang.的干燥块根。将性状项下修订为 “以肥大、色白、粉性足者为佳”,并增订了粉末显微鉴别项。《中国药典》1985年版、1990年版、1995年版、2000年版未作修订。《中国药典》2005年版增订了以甘遂对照药材为对照的薄层色谱鉴别项,增订了水分、总灰分、酸不溶性灰分检查项和浸出物测定项。
国务院1988年12月27日发布的 《医疗用毒性药品管理方法》中规定,毒性中药管理品种常用剂量:生甘遂0.5~1g。现行 《中国药典》甘遂标准【用法用量】项下规定 “0.5~1.5g,炮制后多入丸散用”。
5 讨论
总之,目前对甘遂的化学成分研究报道较多。研究表明甘遂的化学成分主要是二萜类和三萜类化合物。目前活性研究主要是针对单体化学成分进行的。其中,二萜类化合物有较强的刺激作用,也有抗肿瘤作用;提示其毒性成分与有效成分之间有一定的内在联系。三萜类成分也是有效成分,但未见毒性方面的报道。另外,现代毒理学研究结果表明,甘遂的毒性是可逆的。提示我们在毒性药材研究中,既要继承,也要以科学、辨证的态度进行验证,不盲从古人的说法。开展甘遂毒性及有效成分研究,制定相关安全与有效性标准,极为重要。
[1]国家药典委员会.中国药典(一部)[S].北京:化学工业出版社,2005:60.
[2]叶定江.中药炮制学[M].上海:上海科学技术出版社,1996:248.
[3]郭晓庄.有毒中草药大辞典[S].天津:天津科技翻译出版公司,1992:739.
[4]Evan F J,Taylor S E.Progress in the Chemistry of Organic Natural Products[M].NY:Springer-Verlag,1983,44:1-99.
[5]Wang LY,Wang NL,Yao XS,et al.Diterpenes from the roots of Euphorbia kansuiand their in vitro effects on the cell division of Xenopus[J].J Nat Prod.,2002,65(9):1246-1251.
[6]Shi JX,Li ZX,Nitoda T,et al.Three antinematodal diterpenes from Euphorbia kanbsui[J].Biosci Biotechnol Biochem,2007,71(4):1086-1089.
[7]Matsumoto T,Cyoun JC,Yamada H.Stimulatory effects of ingenols from Euphorbia kansuion the expression ofmacrophage Fc receptor[J].Planta Med.,1992,58:255-258.
[8]Shi J.G,Jia Z.J,Yang.L.Lathyrance and ingenane diterpenoids from Euphorbia micractina[J].Planta Med.,1994,60:588-589.
[9]潘勤,闵知大.甘遂中巨大戟萜醇型二萜酯类化学成分的研究[J].中草药,2003,34(6):489-492.
[10]Bernd S.,Erich H..Chemisty of ingenol.Ⅱ.Esters of ingenol and 7,8-isoingenol.Zeitschrift fuer Naturforschung,Teil B:Anorganische Chemie[J].Organische Chemie,1982,37B(6):748-756.
[11]王立岩.甘遂的化学成分及其生物活性研究[D].沈阳:沈阳药科大学博士学位论文,2000.
[12]Uemura D.,Ohwaki H.,Chen Y.,et al.Isolation and structures of 20-deoxyingenol new diterpene,derivatives and ingenol derivative obtained from kansui[J].Tetrahedron Lett,1974,(29):2527-2528.
[13]Wang LY,Wang NL,Yao XS,et al.Diterpenes from the roots of Euphorbia kansui and their in vitro effects on the cell division of Xenopus(part 2)[J].Chem Pharm Bull(Tokyo),2003,51(8):935-941.
[14] Ott HH.,Hecker E..Highly irritant ingenane type diterpene esters from Euphorbia cyparissias L[J].Experientia,1981,37:88-91.
[15]Wu TS,Lin YM,Haruna M,etal.Antitumor agents,119.Kansuiphorins A and B,two novel antileukemic diterpene esters from Euphorbia kansui[J].JNat Prod.,1991,54(3):823-829.
[16]Pan D.J,HU C.O,Chang J.j,et al.Kanuiphorin C and D cytotoxic diterpenes from Euphorbia Kansui[J].Phytocehmistry,1991,30:1018-1020.
[17]王玉波,李颖玉,王红兵,等.甘遂的化学成分[J].中国天然产物,2007,5(3):182-185.
[18]LiCF,Wang JH,Cong Y,etal.A new diterpene from the processed roots of Euphorbia Kansui[J].JAsian Nat prod Res.,2008,10(1-2):101-104.
[19]Uemura D,Kitayama C.K,ansuinin B.A novel multioxygenated diterpene from Euphorbia Kansui Liu[J].Tetrahedron Lett,1975,(10):1703-1706.
[20]陈云利,袁丹,徐鑫.甘遂中麻风树烷型大环二萜类化学成分的研究[J].中国中药杂志,2008,33(15):1836-1839.
[21]Pan Q,Ip Fc,Ip NY,et al.Activity of macrocyclic jatrophane diterpenes from Euphorbia kansui in a TrkA fibroblast survival assay[J].JNat Prod.,2004,67(9):1548-1551.
[22]Bernd S,Erich H.Chemisty of ingenol.Ⅱ.Esters of ingenol and 7,8-isoingenol.Zeitschrift fuer Naturforschung,Teil B:Anorganische Chemie[J].Organische Chemie,1982,37B(6):748-756.
[23]GewallMB,HattoriM,Tezuka Y,etal.Constituents of the latex of Euphorbia antiquorum[J].Phytochemistry,1990,29:1625-1628.
[24]Yasukawa K,Akihisa T,Yoshida ZY,et al.Inhibitory effect of euphol,a triterpene alcohol from the roots of Euphorbia kansui,on tumour promotion by 12-O-tetradecanoylphorbol-13-acetate in two-stage carcinogenesis in mouse skin[J].J Pharm Pharmacol,2000,52(1):119-124.
[25]Itoh T,Tamura T,Matusumoto T,et al.A new triterpene alcohol from tea seed oil[J].Lipids,1975,11(6):434-441.
[26]陈希琛.甘遂引产成分的初步研究[J].药学通报,1982,17(6):43.
[27] Wang LY,Wang NL,Yao XS,et al.Euphane and tirucallane triterpenes from the roots of Euphorbia kansui and their in vitro effects on the cell division of Xenopus.J Nat Prod[J].2003,66(5):630-633.
[28] Singh G.B.,Singh Surjeet,Sharma M.L.,et al.Hypotensive activity of 8,24-euphadien-3β-ol(euphol)[J].Panta Med.,1989,55(6):498-500.
[29]ZhengWF,Cui Z,Zhu Q.Cytotoxicity and antiviralactivity of the compounds from Euphorbia kansui[J].Planta Med.,1998,64:754-756.
[30]郑维发.甘遂醇提物中4种二萜类化合物的体内抗病毒活性研究[J].中草药,2004,35(1):65-68.
[31]郑维发,陈才法,朱爱华.甘遂醇提物抗流感病毒FM1有效部位的筛选[J].中成药,2002,24(5):362-365.
[32]Fujiwara M,Ijichi K,Konno K,et al.Ingenol Derivatives,Ingredient of Kansui are Highly Potent Inhibitor of HIV[J].Antiviral Res.,1995,26(3):228.
[33]史海明,闵知大,屠鹏飞,等.中国大戟属植物中二萜成分的化学及生物活性[J].化学进展,2008,20(2/3):375-385.
[34]Yu FR,Lian XZ,Guo HY,et al.Isolation and characterization of methyl esters and derivatives from Euphorbia kansui(Euphorbiacead and their inhibitory effects on the human SGC-7901 cells[J].JPharm Sci,2005,278(3):528-535.
[35]Nunomura S,Kitanak S,Ra C.3-O-(2,3-dimethylbutanoyl)-13-O-decanoylingenol from Euphorbia kansui suppresses IgE-mediatedmast cell activation[J].Biol Pharm Bull,2006,29(2):286-290.
[36]王秋静,于晓风,刘宏雁,等.复方甘遂制剂宫内给药终止动物中期妊娠及毒性实验[J].白求恩医科大学学报[J],1994,20(5):461-463.
[37]Matsmnoto T,Cyoun JC,Yamada H.Stimulatary effects of ingenols from Euphorbia kansui on the expression ofmacrophage Fc recepter[J].Planta Med,1992,58(3):255-258. [38]修彦凤,曹艳华,张永太.甘遂的药理作用研究进展[J].上海中医杂志,2008,42(4):79-81.
[39]韩向阳.甘遂的毒性研究 [J].医学研究通讯,1980,(5):8.
[40]任树林,张楠楠,刘竹兰,等.甘遂炮制前后整体化学成分变化的研究 [J].中药材,2007,30(6):639-641.
[41]束晓云,丁安伟,张丽,等.内标法研究甘遂及其炮制品的指纹图谱 [J].广东药学院学报,2007,23(6):638-640.
[42]修彦凤,吴弢,王海颖,等.HPLC-ELSD指纹谱法研究甘遂炮制前后成分差异 [J].中成药,2009,31(2):249-252.
[43]张丽,束晓云,唐于平,等.醋甘遂饮片炮制工艺研究[J].中国中药杂志,2009,34(6):681-683.
[44]程显隆,肖新月,李广华,等.甘遂中大戟二烯醇及其同分异构体表大戟二烯醇的含量测定 [J].药物分析杂志,2009,29(9):4-7.
国家科技支撑计划项目(2006BAI14B01)——常见与重要药品安全标准研究
*肖新月,Tel:(010)67095432,E-mail:xiaoxy@nicpbp.org.cn
2010-01-14)
