大肠杆菌为模板制备Au@TiO2催化剂及其CO氧化反应活性
2010-11-06刘玉良由翠荣张香芹索掌怀
刘玉良 由翠荣 李 杨 何 涛 张香芹 索掌怀
(烟台大学化学生物理工学院,山东烟台 264005)
大肠杆菌为模板制备Au@TiO2催化剂及其CO氧化反应活性
刘玉良 由翠荣 李 杨 何 涛 张香芹 索掌怀*
(烟台大学化学生物理工学院,山东烟台 264005)
许多微生物对金属离子有较强的吸附还原能力.本文利用大肠杆菌(DH5α)对金属离子较强的吸附与还原能力制备了Au@DH5α,再利用大肠杆菌的水分来水解钛酸四丁酯,得到Au@DH5α-Ti(OH)4样品,焙烧去除大肠杆菌后得到氧化钛包裹的纳米金粒子催化剂Au@TiO2.以N2吸附,X射线衍射(XRD),紫外-可见漫反射光谱(UV-Vis DRS),热重-差热分析(TG-DTA),透射电镜(TEM)对所得材料进行表征.结果表明:该催化剂具有与大肠杆菌类似的杆状结构,以大肠杆菌为生物模板生成的氧化钛孔道结构在一定程度上抑制了金粒子的聚集长大.随菌体用量的增加,金粒子减小,等离子共振吸收发生紫移,催化剂有较大的比表面积,但催化剂中积炭量也会增加.将该催化剂用于CO氧化反应,发现当菌体用量为100或150 mL时,制得的金催化剂可在80℃下将CO完全氧化为CO2.
二氧化钛;大肠杆菌;模板剂;金催化剂;CO氧化
自上世纪八十年代Hutchings[1]和Haruta等[2]发现金催化剂具有高催化活性以来,金催化剂的研究受到密切关注,目前已取得很大进展[3].但金催化剂很少用于工业应用.原因之一是由于金粒子的聚集长大及表面碳酸盐物种的积累而导致金催化剂易于失活.如何有效阻止金粒子的聚集,提高金催化剂的稳定性已成为目前亟待解决的问题[4-5].
近年来,金属纳米粒子与DNA、蛋白质、壳聚糖等生物大分子的相互作用及其自组装研究引起人们的密切关注.Baron等[6]评述了以DNA、蛋白质等生物分子为模板合成Au、Ag纳米粒子和纳米线的研究进展.这种材料既可以通过生物分子的识别和催化功能来改善金属纳米粒子的电学、光学和催化性能,也可以通过改性金属纳米粒子来改善生物分子的某些性能.Horovitz等[7]发现柠檬酸钠还原的金纳米粒子与大麦糊粉层细胞提取的蛋白质之间存在静电作用.杨芳等[8]研究了藻蓝蛋白对Au3+离子的原位还原和纳米Au0形成的动态过程,发现藻蓝蛋白的紫外特征吸收峰强度随Au3+离子浓度的增加和放置时间的延长而降低,其荧光发射峰和荧光激发峰也呈现衰减趋势,提出藻蓝蛋白中的半胱氨酸、胱氨酸和色氨酸可将Au3+还原为Au0.金明善等[9]研究了金纳米粒子和R-藻红蛋白的相互作用,发现R-藻红蛋白对金纳米粒子有良好的稳定作用.Huang等[10]发现壳聚糖能保护金纳米粒子.刘克增等[11]制备了金@壳聚糖复合材料,发现该材料对葡萄糖空气氧化制葡萄糖酸具有良好的催化性能.
另一方面,微生物与金属纳米粒子的研究也日益增多.Gericke等[12]详细评述了各种微生物在制备金纳米粒子方面的研究进展,认为可以通过调变微生物的生长参数(如培养时间、pH值、温度等)达到对金纳米粒子形貌和尺寸的控制.某些菌体如枯草芽孢杆菌[13]、酵母菌[14]、真菌[15]等能够聚集并还原金离子,已用于金纳米粒子和纳米线的合成.研究表明[16],细胞中的羟基和氨基可作为Au3+的结合位,而醛基可作为电子供体将Au3+还原成Au0.Kuo等[17]利用大肠杆菌对金离子的还原作用制备了金@大肠杆菌复合材料,发现这种材料具有很强的生物相容性,可望应用于光热治疗癌细胞方面.傅锦坤等[18]用细菌将Au/α-Fe2O3上的Au3+还原成Au0,焙烧后获得的催化剂与浸渍法制备的催化剂相比有较高的CO氧化反应活性.可以看出,目前的研究主要集中于微生物对金属离子的吸附与还原作用以及金属纳米粒子的制备,而将其用于催化领域的报道较少.
鞭毛是细菌表面的运动器官,由单一的鞭毛蛋白组装形成螺线管状结构,鞭毛的长短和数量可以通过改变细菌的培养条件来调控.最近,Kumara等[19]首次实现了Au、Ag、Cu等金属纳米颗粒在细菌鞭毛表面的组装.利用细菌鞭毛为模板制备二氧化钛等无机氧化物纳米管也已获成功[20].但尚未见利用此法制备金催化剂的研究.大肠杆菌为革兰氏阴性短杆菌,为杆状结构,具有抵抗力强、易培养等优点.Nomura等[21-22]以大肠杆菌为生物模板合成了氧化硅的空心纳米管.本文以大肠杆菌为模板,利用其易于吸附并还原金属离子的性能,将金纳米粒子吸附在大肠杆菌内壁上;然后再利用其外部鞭毛上的水分来水解钛酸四丁酯,在一定温度脱去大肠杆菌后,即可将金粒子固定在TiO2载体孔道内,在一定程度上抑制金粒子的长大,获得高活性的金催化剂.
1 实验部分
1.1 样品制备
将配好的LB培养基(北京天恩泽基因科技有限公司)置于D-1型自动蒸汽灭菌锅(北京发恩科贸有限公司)中在121℃灭菌20 min.冷却后,在无菌条件下接入DH5α型菌种,于37℃培养大肠杆菌至光学密度(OD600nm)大约为2.经4000 r·min-1离心、洗涤后,将一定用量的下层菌体置于浓度为10 mg· mL-1的氯金酸溶液(以稀NaOH溶液调节其pH值为6)中浸渍2 h.超速离心后,得到Au@DH5α.
将Au@DH5α样品分散在无水乙醇(分析纯,≥99.7%,天津市北方天医化学试剂厂)中,搅拌下滴加钛酸四丁酯(化学纯,≥98.0%,国药集团化学试剂有限公司).利用大肠杆菌外部鞭毛表面的水分使其水解为氢氧化钛,样品经静置、洗氯,得到Au@DH5α-Ti(OH)4样品.最后,在300℃下焙烧除去大肠杆菌模板,得到氧化钛包裹的纳米金催化剂,记为Au@TiO2.本实验也采用等体积浸渍法[23]制备了商品TiO2(CAS#1317-80-2,美国什特雷姆化工公司)负载金催化剂,焙烧温度也为300℃,记为Au/TiO2.在所得金催化剂中,金的理论负载量均为1%(质量分数,w).
1.2 样品表征
Au@TiO2催化剂的物相测试在XRD-6100 X射线衍射仪(日本岛津公司)上进行.Cu Kα射线源,管电压40 kV,管电流30 mA,扫描范围20°-80°.
Au@DH5α、Au@DH5α-Ti(OH)4及Au@TiO2的透射电镜测试在JEM-1400型透射电镜(日本JEOL)上进行,仪器加速电压80 kV.先将样品悬浮在无水乙醇中,并经超声分散,滴加在碳网上的样品置于仪器样品室内进行观察并拍照.
利用TU-1901紫外-可见分光光度计(北京普析通用仪器有限公司)对样品进行紫外-可见漫反射光谱分析.扫描范围200-800 nm,扫描间隔5 nm.
采用N2吸附法在NOVA 3000e型自动吸附仪(美国康塔公司)上测定样品的比表面积、孔容和平均孔径.样品在测试前于393 K真空脱气3 h,吸附温度77 K.样品的比表面积根据吸附曲线采用BET法计算,孔容和孔径分布根据脱附曲线采用BJH法计算.
利用STA-409 PC同步热分析仪(德国耐驰公司)测定在脱除大肠杆菌制备金催化剂过程中所产生的积炭量.实验条件:样品用量5-10 mg,流动空气气氛(30 mL·min-1),升温速率10 K·min-1,以铟校准.
利用IRIS intrepid II XSP型电感耦合等离子体(ICP)发射光谱仪(美国热电公司)测定金的实际负载量.将样品溶于热王水,待溶液冷却用去离子水稀释后进行测试.
1.3 金催化剂的活性
Au@TiO2催化剂的活性评价在小型固定床连续流动反应器中进行.反应管为硬质玻璃管,内径5 mm.催化剂用量0.5 mL(20-40目),原料气组成为3%CO+97%air,调节流速以维持气体流量30 mL· min-1.CO、空气及CO2浓度采用GC-950气相色谱仪(上海海欣色谱仪器有限公司)在线分析,13X填充柱,热导检测器检测.催化剂的活性以CO转化率表示.
2 结果与讨论
2.1 样品的比表面积、孔容和平均孔径
表1给出了样品的比表面和孔结构数据.可以看出,商用TiO2比表面积只有7.8 m2·g-1,负载金以后,样品的比表面积、孔容和平均孔径均无变化.与Au/TiO2相比,以大肠杆菌为模板制得的Au@TiO2其表面积和孔容均有较大提高,且随大肠杆菌量的增加而增大,但其平均孔径没有变化.当菌量为200 mL时,其比表面积可达78.3 m2·g-1,孔容0.09 cm3· g-1.大的比表面积和孔容有利于反应物分子在催化剂内部的扩散和接触,提高反应活性.
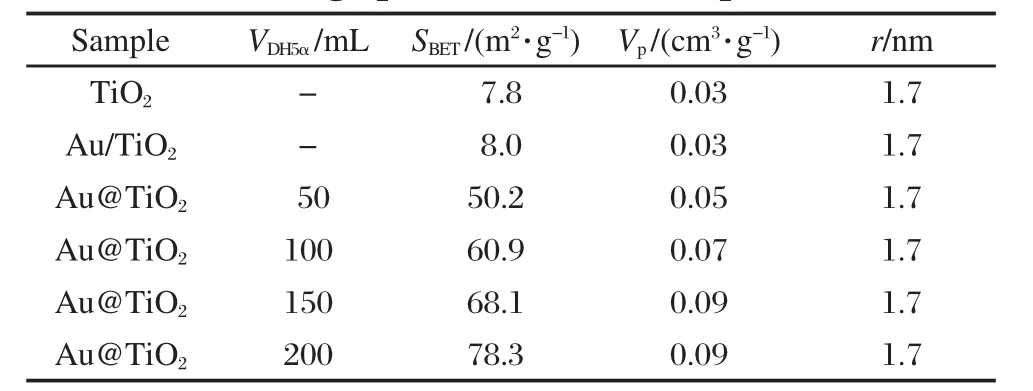
表1 样品的比表面积、孔容和平均孔径Table 1 Surface area,pore volume,and average pore size of the samples
2.2 Au@TiO2催化剂金的实际担载量及其积炭的测定
表2为催化剂中金实际担载量及其积炭的测定结果.可以看出,金的实际负载量和积炭均随菌体用量的增加而提高.由于单个菌体吸附金离子能力是一定的,当大肠杆菌用量较小时,由于菌量低,大肠杆菌吸附金离子的能力有限,制备的金催化剂中金的实际负载量偏低,所以金的实际负载量随菌体用量增加而提高.在300℃焙烧脱除大肠杆菌的过程中,由于细菌碳化产生一定积炭,菌体用量越大,产生的积炭越多.提高焙烧温度可减少积炭,但焙烧温度过高会引起金粒子聚集,对提高活性不利.
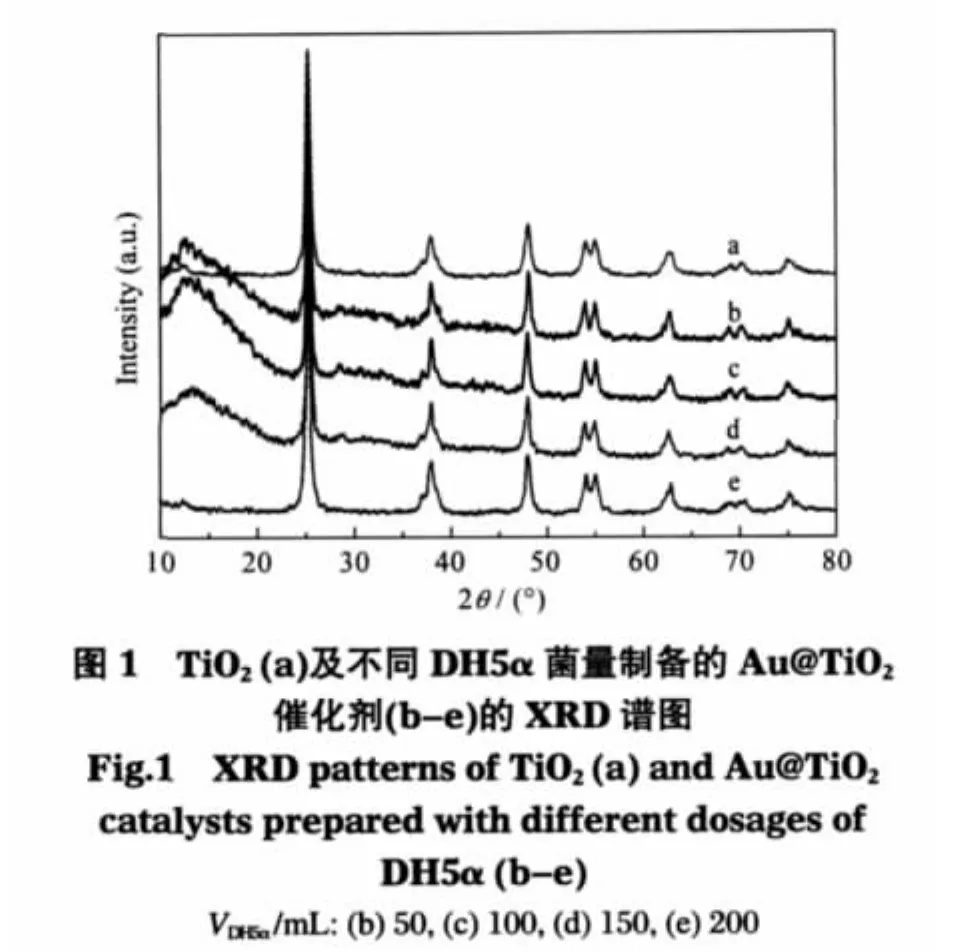
2.3 Au@TiO2催化剂的XRD谱图及紫外-可见漫反射光谱
图1为商品TiO2及由不同菌量制备的Au@TiO2催化剂的XRD谱图.可以看出,所有衍射峰均为锐钛矿型TiO2的特征衍射峰.负载金以后,由于具有最大衍射强度的Au(111)和TiO2的特征衍射峰重叠,因此很难判断是否存在金的特征衍射峰.但从金催化剂的紫外-可见漫反射光谱及TEM照片可以看出,该催化剂存在尺寸较小的金纳米粒子.
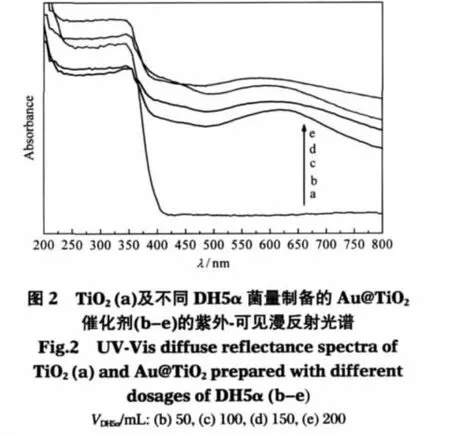
图2为不同菌体用量制备的Au@TiO2催化剂的紫外-可见漫反射光谱.由图可见,单独的TiO2吸光性能很差,在可见光区没有明显的吸收.负载金以后,吸光性能得到明显提高,在600 nm附近出现一个明显的吸收峰,这是由于金纳米粒子的等离子共振吸收所致[24].随着大肠杆菌菌量的增加,金的等离子共振吸收峰发生紫移,表明金粒子减小[7,25].当金含量一定时,增加大肠杆菌用量可使单个菌体吸附金粒子的数目减少,能有效阻止金粒子的粘连和聚集,在一定程度上抑制了焙烧过程中金粒子的聚集长大.

表2 不同DH5α菌量制备的Au@TiO2催化剂金实际负载量(wAu,质量分数)及其积炭量(Ccoke)Table 2 Actual Au loading(wAu,mass fraction)and the coke content(Ccoke)of Au@TiO2catalysts prepared with different dosages of DH5α
2.4 Au@TiO2催化剂的TEM表征
图3 为大肠杆菌菌量为100 mL时,Au@DH5α、Au@DH5α-Ti(OH)4及Au@TiO2样品的TEM照片.从图3(A)可以看出,在大肠杆菌表面有少量的金纳米粒子,粒径大约为20 nm,表明大肠杆菌能够还原金离子,这与Kuo等[17]报道的结果类似.图3(B)为钛酸四丁酯在大肠杆菌表面水解之后所得样品的TEM照片.可以看到,大肠杆菌表面覆盖了一薄层透明的Ti(OH)4.图3(C1)和3(C2)分别是300℃焙烧脱除大肠杆菌后所得Au@TiO2样品在不同放大倍数下的TEM照片.由图可以看出,Au@TiO2维持了大肠杆菌的杆状形态,并且有大量的金纳米粒子镶嵌于TiO2表面.大部分金粒子居于TiO2管内,呈球形,平均粒径10 nm左右;但也有少部分金粒子存在于TiO2管外,呈立方形,平均粒径大约20-30 nm.TiO2管外的金粒子明显比管内的金粒子大,说明以大肠杆菌为模板生成的TiO2管状结构在一定程度上抑制了金粒子的聚集长大.这有利于提高催化剂的活性和稳定性.
2.5 Au@TiO2催化剂对CO氧化的催化活性
图4给出不同菌量条件下制备的Au@TiO2催化剂对CO氧化反应的催化活性.可以看出,菌量对所得金催化剂的CO氧化活性具有很大影响.适当的菌量有助于催化活性的提高,当菌量为100或150 mL时,催化剂的活性最高,可在80℃下将CO完全氧化,与常规的浸渍法相比具有更高的活性.菌量过多或过少均不利于催化活性的提高.当菌量过少时,细菌吸附金离子的能力有限,产生的活性中心数目较少,金实际负载量的测定也证明了这一点.而菌量过多,在焙烧后的催化剂孔道内产生了过多的积炭,覆盖催化剂的部分活性中心,也将导致其活性下降.
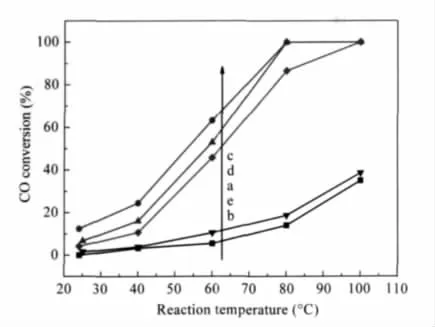
图4 不同DH5α菌量制备的Au@TiO2催化剂的CO氧化反应活性Fig.4 Catalytic activity of Au@TiO2prepared with different dosages of DH5α for CO oxidationVDH5α/mL:(a)0,(b)50,(c)100,(d)150,(e)200
对负载型金催化剂,目前多采用沉积-沉淀法和浸渍法制备.沉积-沉淀法能制备金粒子尺寸小,催化活性高的负载型纳米金催化剂,但受制备条件影响较大.Moreau等[26]分析了沉积-沉淀法制备Au/ TiO2催化剂的影响因素,发现至少包括氯金酸的浓度,TiO2载体的晶型,沉淀剂的性质,温度,pH值,沉积时间,洗涤方法,焙烧条件等十余种因素均能显著影响所得催化剂的活性和稳定性.此外,沉积-沉淀法要求载体等电点在6-9之间,这不适用于SiO2, MgO及活性炭等载体,且金实际负载率也较低.对浸渍法制备金催化剂,不受载体本性及形状的限制,但需采用碱性的金溶液做前驱液,而氨水洗涤以除去表面氯离子也很关键[23,27].另外,由于多数载体表面与金粒子之间的相互作用较弱,在沉积-沉淀或者浸渍过程中很难避免金粒子的聚集,因此在金催化剂的制备和储存过程中都无法控制颗粒的不断长大.将金属粒子组装到介孔材料的孔道中,从而阻断颗粒之间的聚集被认为是切实可行的方法[28].然而,如何将金属颗粒装入较小的纳米孔道中仍存在很大困难.
本文利用大肠杆菌易于吸附并还原金属离子的性能,将金纳米粒子吸附在大肠杆菌内壁上,获得大肠杆菌稳定的纳米金粒子.大肠杆菌与金粒子间较强的相互作用能够从根本上避免制备过程中金颗粒的团聚问题[19].然后,利用大肠杆菌鞭毛上的水分通过化学沉淀法来水解钛酸四丁酯,低温脱水后在鞭毛表面形成氧化物壳层.在一定温度下焙烧去除大肠杆菌模板后,即可将金粒子固定在TiO2载体孔道内,获得内壁镶嵌金纳米粒子的氧化物纳米管材料[20].沉积在金粒子表面的载体材料以及热处理使得金颗粒不仅仅分散在载体的内表面,而且能够比较牢固地镶嵌于载体壳层的内壁上,这在一定程度上抑制金粒子的长大,获得高活性的金催化剂.
本文结果证明以大肠杆菌为模板制备的纳米金催化剂,金粒子尺寸较易控制,能阻止金粒子的聚集,催化活性高.此方法无需象制备纳米金溶胶那样,另加稳定剂和还原剂[9,11].但正如本文结果所显示的,大肠杆菌的用量直接决定金离子的吸附与还原,并对金粒子的尺寸及其催化性能产生很大影响.同时,金溶液pH值也应控制在一定范围内,以保证大肠杆菌的性质不受金溶液pH值的影响.焙烧温度的控制很关键.温度过低,因大肠杆菌燃烧不完全而产生的积炭比较严重,从而堵塞金活性位,导致催化活性降低;而温度过高,虽然能有效除去大肠杆菌及其积炭,但又会促进金粒子的聚集,也不利于提高活性.只要控制制备条件,优化其制备过程,可望获得高活性、高稳定性的纳米金催化剂.
3 结 论
利用微生物对金离子的吸附还原性能,以大肠杆菌为模板,通过控制大肠杆菌菌体用量,可获得具有良好CO氧化反应活性的Au@TiO2催化剂.该法制备的催化剂有较大的比表面积,可达78.3 m2·g-1.该催化剂维持了大肠杆菌的杆状结构,以大肠杆菌为模板生成的孔道结构在一定程度上抑制了金粒子在焙烧过程中的聚集长大,为制备高活性和高稳定性的金催化剂提供了一种新的方法.
致谢: 感谢滨州学院(烟台校区)电镜实验室刘文波老师在TEM测试方面所给予的大力帮助.
1 Hutchings,G.J.J.Catal.,1985,96(1):292
2 Haruta,M.;Kobayashi,T.;Sano,H.;Yamada,N.Chem.Lett., 1987,16:405
3 Bond,G.C.;Thompson,D.T.Gold Bull.,2000,33(2):41
4 Corti,C.W.;Holliday,R.J.;Thompson,D.T.Top.Catal.,2007, 44(1-2):331
5 Corti,C.W.;Holliday,R.J.;Thompson,D.T.Appl.Catal.A, 2005,291(1-2):253
6 Baron,R.;Willner,B.;Willner,I.Chem.Commun.,2007,(4):323
7 Horovitz,O.;Tomoaia,G.;Mocanu,A.;Yupsanis,T.;Tomoaia-Cotisel,M.Gold Bull.,2007,40(3):213
8 Yang,F.;Guo,Z.J.;Bai,Y.;Huang,Z.;Zheng,W.J. Photographic Sci.Photochem.,2006,24(2):118 [杨 芳,郭振江,白 燕,黄 峙,郑文杰.感光科学与光化学,2006,24(2): 118]
9 Jin,M.S.;Yuan,H.Q.;Jing,J.R.;Suo,Z.H.;Sun,L.Chem.J. Chin.Univ.,2009,30(6):1183 [金明善,原慧卿,荆济荣,索掌怀,孙 力.高等学校化学学报,2009,30(6):1183]
10 Huang,H.Z.;Yuan,Q.;Yang,X.R.J.Colloid Interface Sci., 2005,282(1):26
11 Liu,K.Z.;Shi,L.L.;Jin,M.S.;Suo,Z.H.J.Mol.Catal.(China), 2009,23(5):436 [刘克增,石玲玲,金明善,索掌怀.分子催化, 2009,23(5):436]
12 Gericke,M.;Pinches,A.Gold Bull.,2006,39(1):22
13 Chen,X.C.;Hu,S.P.;Shen,C.F.;Dou,C.M.;Shi,J.Y.;Chen,Y. X.Bioresour.Technol.,2009,100(1):330
14 Agnihotri,M.;Joshi,S.;Kumar,A.R.;Zinjarde,S.;Kulkarni,S. Mater.Lett.,2009,63(15):1231
15 Sugunan,A.;Melin,P.;Schnurer,J.;Hilborn,J.G.;Joydeep,D. Adv.Mater.,2007,19(1):77
16 Liu,Y.Y.;Fu,J.K.;Hu,R.Z.;Yao,B.X.;Weng,S.Z.Acta Microbiol.Sin.,1999,39(3):260 [刘月英,傅锦坤,胡荣宗,姚炳新,翁绳周.微生物学报,1999,39(3):260]
17 Kuo,W.S.;Wu,C.M.;Yang,Z.S.;Chen,S.Y.;Chen,C.Y.; Huang,C.C.;Li,W.M.;Sun,C.K.;Yeh,C.S.Chem.Commun., 2008,(37):4430
18 Fu,J.K.;Liu,Y.Y.;Hu,R.Z.;Zegn,J.L.;Xu,P.P.;Lin,Z.Y.; Yao,B.X.;Weng,S.Z.Acta Phys.-Chim.Sin.,1998,14(9):769 [傅锦坤,刘月英,胡荣宗,曾金龙,许翩翩,林种玉,姚炳新,翁绳周.物理化学学报,1998,14(9):769]
19 Kumara,M.T.;Tripp,B.C.;Muralidharan,S.Chem.Mater., 2007,19(8):2056
20 Kumara,M.T.;Muralidharan,S.;Tripp,B.C.J.Nanosci. Nanotechnol.,2007,7(7):2260
21 Nomura,T.;Morimoto,Y.;Tokumoto,H.;Konishi,Y.Mater. Lett.,2008,62(21-22):3727
22 Nomura,T.;Morimoto,Y.;Ishikawa,M.;Tokumoto,H.;Konishi, Y.Adv.Powder Technol.,2010,21(1):8
23 Suo,Z.H.;Weng,Y.G.;Jin,M.S.;Lü,A.H.;Xu,J.G.;An,L.D. Chin.J.Catal.,2005,26(11):1022 [索掌怀,翁永根,金明善,吕爱花,徐金光,安立敦.催化学报,2005,26(11):1022]
24 Zanella,R.;Giorgio,S.;Shin,C.H.;Henry,C.R.;Louis,C. J.Catal.,2004,222(2):357
25 Link,S.;El-Sayed,M.A.J.Phys.Chem.B,1999,103(21):4212
26 Moreau,F.;Bond,G.C.;Taylor,A.O.J.Catal.,2005,231(1): 105
27 Delannoy,L.;El Hassan,N.;Musi,A.;Le To,N.N.;Krafft,J.M.; Louis,C.J.Phys.Chem.B,2006,110(45):22471
28 Bore,M.T.;Mokhonoana,M.P.;Ward,T.L.;Coville,N.J.; Datye,A.K.Microporous Mesoporous Mat.,2006,95(1-3):118
Preparation of Au@TiO2Catalyst Using Escherichia Coil as the Template and Its Oxidation Reaction Activity toward CO
LIU Yu-Liang YOU Cui-Rong LI Yang HE Tao ZHANG Xiang-Qin SUO Zhang-Huai*
(Chemistry and Biology College,Yantai University,Yantai 264005,Shandong Province,P.R.China)
Many microorganisms can adsorb metal ions strongly and even reduce them to their metal states.We studied the adsorption of gold nanoparticles on Escherichia coil(DH5α)to form Au@DH5α.Titanium tetrabutoxide was added to Au@DH5α to prepare Au@DH5α-Ti(OH)4by hydrolysis.The DH5α template was removed by calcination in air to obtain the Au@TiO2catalyst.These materials were characterized by N2adsorption,X-ray diffraction(XRD), UV-Vis diffuse reflectance spectroscopy(UV-Vis DRS),thermogravimetry-differential thermal analysis(TG-DTA), and transmission electron microscopy(TEM).The results show that the gold catalyst maintains a rod-like structure similar to DH5α and the porous structure of the titanium oxide prepared using DH5α as a biological template can prevent the aggregation of gold nanoparticles to some extent.With higher amounts of DH5α dosage,smaller gold nanoparticles were obtained and the surface plasmon absorption of gold nanoparticles shifted toward shorter wavelengths.The obtained gold catalyst has a larger surface area than the catalyst prepared by the impregnation method.However,this increases the coke content of the catalyst.Catalytic activity was evaluated by the CO oxidation reaction.We found that with a DH5α dosage of 100 or 150 mL,the obtained gold catalyst can convert CO to CO2completely at 80℃.
Titanium oxide; Escherichia coil;Template agent;Gold catalyst;CO oxidation
O643.3
Received:May 17,2010;Revised:June 21,2010;Published on Web:July 12,2010.
*Corresponding author.Email:zhsuo@ytu.edu.cn;Tel:+86-535-6902514.
The project was supported by the National Natural Science Foundation of China(20473070,20973148).
国家自然科学基金(20473070,20973148)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica
