纳米阻燃氢氧化镁/聚氧化乙烯复合聚合物电解质
2010-11-06李亚娟刘素琴黄可龙周运鸿
李亚娟 詹 晖 刘素琴 黄可龙 周运鸿
(1中南大学化学化工学院,长沙 410083;2武汉大学化学与分子科学学院,武汉 430072)
纳米阻燃氢氧化镁/聚氧化乙烯复合聚合物电解质
李亚娟1,*詹 晖2刘素琴1黄可龙1周运鸿2
(1中南大学化学化工学院,长沙 410083;2武汉大学化学与分子科学学院,武汉 430072)
合成了纳米氢氧化镁作为聚氧化乙烯(PEO)基聚合物电解质的增塑剂和阻燃剂,并对其进行X射线衍射(XRD)、透射电子显微镜(TEM)和热重(TG)分析研究.制得的氢氧化镁为片状六方晶体,尺寸在50-80 nm之间,纳米氢氧化镁在340℃时开始热分解.对纳米氢氧化镁/PEO复合聚合物电解质的电化学研究结果显示:纳米氢氧化镁/PEO复合聚合物电解质的离子电导率随着添加纳米氢氧化镁的质量分数的增加先增大后减小,其在5%-10%之间时,复合聚合物电解质的离子电导率达到最大值.纳米氢氧化镁的添加使复合聚合物电解质的阳极氧化电位有一定程度的提高,纳米氢氧化镁具有改善PEO阳极抗氧化能力的作用.
锂离子电池;纳米氢氧化镁;阻燃;聚氧乙烯;聚合物电解质
目前,已经商品化的锂离子电池基本上采用有机液态电解液.而有机液态电解液沸点低,易燃烧,这就限制了锂离子电池的发展.采用不挥发的聚合物固体电解质是解决这一问题的有效途径之一.聚氧化乙烯(PEO)具有独特的分子结构和空间结构,它既能提供足够高的给电子基团密度,又具有柔性聚醚链段,因此,能够以笼囚效应有效地溶解阳离子[1],是目前研究得最广泛深入的锂离子聚合物固体电解质体系.
锂离子在PEO基聚合物电解质中的迁移过程可以认为是锂离子与氧官能团的配位与解离过程.在电场作用下,随着高弹态中分子链段的热运动,迁移离子与氧基团不断发生配位-解离.通过局部松弛和PEO的链段运动进行快速迁移.该运动主要发生在无定形相中,电导率比在晶相中高2-3个数量级[1].对于PEO聚合物电解质而言,由于锂离子的迁移主要是在聚合物的非晶区进行,而PEO易结晶,因此其室温或低于室温时的电导率比较低,大都小于10-6S·cm-1,限制了纯PEO聚合物电解质的应用.为抑制PEO结晶以提高聚合物电解质的离子电导率,目前采用的方法主要有:(1)通过与其他聚合物[2-5]或无机物[6-17]共混,以破坏PEO分子链排列的规整性,获得非晶结构,提高离子电导率;(2)通过形成无规共聚物[18]、嵌段共聚物[19]、梳形共聚物[20-22]、超枝化和星形聚合物[23-25]以及交联[26],以破坏PEO的结晶,提高离子电导率.
PEO与无机颗粒特别是纳米级粉末进行复合是改善PEO基聚合物电解质性能最有效、最简单的方法.许多高比表面的颗粒如SiO2[10]、TiO2[11]、MgO[12]、Al2O3[13]、铁电材料BaTiO3和SrTiO3[14]、LiAlO2[15]、导电的碳黑[16]和AlBr3[17]等被作为填料加入聚合物基体中,制得的复合聚合物电解质(CPE)的机械性能和电化学性能方面都有明显提高.对于此类复合材料机械性能的提高,可用无机粉状材料填充高分子材料增强理论来解释.无机粉末粒子和聚合物分子链通过范德华力相互作用,形成一种三维网络结构,当聚合物分子链受到应力作用时,可以通过网络交联点将应力分散到其他分子链上,这样即使其中一根分子链断裂,其它链可以照样起作用,而不至于危及整体.加入无机填料后,CPE的电导率升高是因为:一方面填料与聚合物相互作用,尤其是纳米级的微粒能分散于聚合物分子之间,影响聚合物电解质在室温下的相组成,增大了体系的无定形相含量,提高了分子链段的蠕动能力[27];另一方面,填料作为Lewis酸与锂盐负离子X-及PEO中的O等Lewis碱发生反应,减少Li+-X-离子对,增大了自由载流子的数目,而且也减弱了O-Li+相互作用,使锂离子更容易传输,从而增大了离子电导率.
另外不论是物理改性还是化学改性PEO基聚合物电解质的主要成分还是聚醚链锻,通过理论计算PEO的氧指数(LOI)在17.5%左右.一般认为LOI≥27%的物质为阻燃性物质.据此可知PEO属于易燃物,所以提高其阻燃性也是至关重要的.因此填充的无机纳米颗粒如果具有阻燃性能,复合聚合物电解质的电化学性能和安全性能都会有很大的提高.
氢氧化镁(Mg(OH)2)属于添加型无机阻燃剂,它的热分解温度高,初始分解温度为340℃,到490℃时分解完全[28].受热分解产生水,同时吸收大量热.吸热总量为44.8 kJ·mol-1.它还能促进聚合物的成炭作用,形成保护层.与同类无机阻燃剂相比,在使高分子材料获得优良的阻燃效果之外,还能够抑制烟雾和卤化氢等毒性气体的生成.氢氧化镁在生产、使用和废弃物产生的过程中均无有害物质排放,是一种环境友好的绿色阻燃剂.本文制取了纳米级氢氧化镁,将纳米级氢氧化镁与PEO复合制取聚合物电解质.
1 实验部分
1.1 纳米氢氧化镁的制备
采用沉淀法制备氢氧化镁.分别称取适量的Mg(NO3)2·6H2O(分析纯,上海试剂厂)和十二烷基磺酸钠(Aldrich)置于烧杯中,加入二次水,将烧杯于90℃水浴中搅拌使其溶解.另称取适量LiOH·H2O(分析纯,上海试剂厂)溶于水中,将LiOH溶液缓慢加入到上面的Mg(NO3)2溶液中,加入的同时迅速搅拌.保持混合物在90℃水浴中继续搅拌1 h.将产物抽滤后置于真空干燥箱内80℃烘干.
1.2 复合聚合物电解质膜的制备
采用溶液浇注法制备复合聚合物电解质膜.称取所需量的LiN(CF3SO2)2(LiTFSI)(Aldrich)和纳米Mg(OH)2,加入一定量的甲醇(分析纯,上海试剂厂)中,磁力搅拌4 h分散均匀.按PEO中乙氧基与锂盐的物质的量之比为20∶1来称取PEO(MW=4×106, Aldrich),并加入到上述混合液中,继续磁力搅拌24 h.待物料混合均匀后,将其倒入聚四氟乙烯平底圆盘中.常温下,于通风橱中缓慢挥发溶剂,溶剂挥发完毕便得到复合聚合物电解质薄膜,然后将电解质薄膜转移到真空干燥箱中,在70℃真空干燥48 h.将干燥好的膜放入充满氩气的手套箱内保存备用.
1.3 离子电导率的测定
电导率的测定使用的仪器是荷兰ECO CHEMIE公司生产的AUTOLAB PGSTAT12型电化学工作站.在充满氩气的手套箱中,将一定厚度的聚合物电解质膜夹入两个面积为0.8 cm2的不锈钢阻塞电极之间,并密封.测量其交流阻抗谱.通过阻抗谱图拟合求出电解质膜的本体电阻R.根据公式σ=L/(R·S)计算电解质膜电导率.式中σ为聚合物电解质膜的电导率;L为电解质膜厚度;R为聚合物电解质膜的本体电阻;S为电解质膜面积.测试不同温度下电解质膜的电导率时,将待测体系在指定温度下恒温3 h以达到充分的热平衡.频率范围1-105Hz,电压振幅为5 mV.
1.4 电化学稳定窗口的测定
电解质的电化学稳定窗口是表征电解质的重要参数之一,由于锂离子电池使用具有高氧化电位的正极材料(一般大于4 V),因此电解质必须具有宽的电化学稳定窗口.电化学稳定窗口测定采用的是上海辰华仪器公司生产的CHI600型电化学工作站.采用线性扫描法测量电化学稳定窗口,铂电极为工作电极,锂片为对电极和参比电极,电流突然增大的点所对应的电位即认为是聚合物电解质的电化学稳定窗口电位.扫描速率为1 mV·s-1.
1.5 性质表征
X射线衍射(XRD)测试采用的是日本岛津公司生产的XRD6000型X射线粉末衍射仪,采用Cu靶Kα,加速电压为30 kV,电流为30 mA,扫描速率为4 (°)·min-1,扫描范围10°-80°;采用JEM-2010型透射电子显微镜(TEM)(日本)对制得的氢氧化镁形貌进行观察.热重(TG)分析采用北京光学仪器厂生产的WCT-1A型微机差热天平.温度范围是:室温-800℃,升温速率10℃·min-1.
2 结果与讨论
2.1 改性氢氧化镁的制备与表征

图1 氢氧化镁的透射电镜照片Fig.1 TEM image of Mg(OH)2

图2氢氧化镁的XRD图谱Fig.2 XRD pattern of Mg(OH)2
图1 是直接沉淀法合成的氢氧化镁的透射电镜照片,由图1可看出,制得的氢氧化镁具有片状六方形结构,并且尺寸在50-80 nm之间.图中氢氧化镁周围有尺寸只有几个纳米的小颗粒,可能是少量残留在样品中的十二烷基磺酸锂.图2是氢氧化镁XRD图谱,其主峰完全符合六方Mg(OH)2晶体结构.谱图中2θ角为18.6°、32.8°、38.0°、50.8°、58.6°、62.1°、68.2°、68.8°和72.0°时分别出现的是(001)、(100)、(101)、(102)、(110)、(111)、(103)、(200)和(201)衍射峰.但(103)和(200)基本重合,说明部分氢氧化镁片状六方形结构不够完整,这从图1中也可以观察到部分氢氧化镁晶体不是规则的六方形.
图3是氢氧化镁的热重曲线,在100℃以内约5%的失重主要来源于产物中物理吸附的水份的蒸发.340-390℃温度区间的失重是氢氧化镁的热分解失水过程.从热重曲线还可以看出,在200-250℃温度区间有个微弱的失重,主要来源于产物中残留的少量的十二烷基磺酸锂的分解.
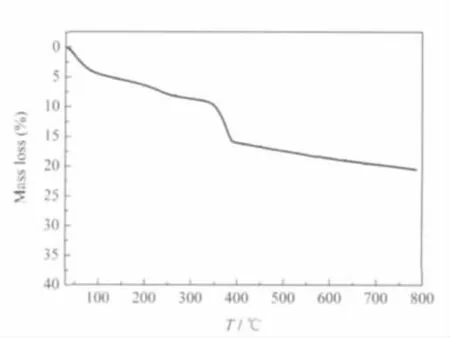
图3 氢氧化镁的热重曲线Fig.3 Thermogravimetric curve of Mg(OH)2

图4 不同温度下复合聚合物电解质离子电导率随氢氧化镁质量分数(w)的变化曲线Fig.4 Ionic conductivity of composite polymer electrolyte as a function of hydroxide magnesium mass fraction(w)at different temperatures
2.2 氢氧化镁/PEO复合聚合物电解质的电化学性能
图4 是复合聚合物电解质PEO20LiTFSI+氢氧化镁的电导率随氢氧化镁添加量的变化曲线,由图可知不论是在25℃还是60℃,复合聚合物电解质的离子电导率随氢氧化镁添加量的增加先增大后减小,在5%-10%之间达到最大值,这是因为改性氢氧化镁的加入抑制PEO的结晶,使聚合物向易于离子传输的非晶态结构转变.纳米氢氧化镁添加量为15%时复合聚合物电解质的离子电导率虽然开始降低,但仍然高于没添加纳米氢氧化镁的纯PEO聚合物电解质的离子电导率.而纳米氢氧化镁添加量达到30%时,复合聚合物电解质的离子电导率低于纯PEO聚合物电解质的离子电导率.这说明纳米氢氧化镁的添加量过多反而会阻碍PEO分子的链段运动,从而导致离子电导率降低.从图4还可看出,随着温度的升高相同组成的复合聚合物电解质的离子电导率先快速升高,60℃之后离子电导率升高趋缓.这主要是PEO分子在60℃开始熔融,低于60℃时,随着温度提高,无定型相增加,故离子电导率增加.而高于60℃时,温度增加,无定型相的含量增加不明显,故离子电导率增加趋缓.

图5 复合聚合物电解质在25℃时的阳极氧化曲线Fig.5 Anodic decomposition curves of the CPEs at 25℃

图6 复合聚合物电解质在80℃时的阳极氧化曲线Fig.6 Anodic decomposition curves of the CPEs at 80℃
图5 和图6分别是复合聚合物电解质在25和80℃时的阳极氧化曲线.由图5和图6可以很清楚地看出,不论在25℃还是在80℃,纯PEO聚合物电解质的阳极抗氧化电位约在4.5 V,而添加了纳米氢氧化镁的复合聚合物电解质的阳极抗氧化电位有一定提高.这说明纳米氢氧化镁对提高PEO聚合物电解质的电化学稳定性有很好的作用.研究者普遍认为无机粉末的加入,吸收了聚合物电解质中的杂质、氧气和残余水份,使这些活性小分子不能参与电极反应,从而使得聚合物电解质的阳极抗氧化能力得到提高[14].
3 结 论
纳米氢氧化镁/PEO复合聚合物电解质中,随着纳米氢氧化镁添加量的增加,复合聚合物固体电解质的离子电导率先增加后减小,添加量在5%-10%之间,复合聚合物电解质的离子电导率达到最大值,添加量大于15%后,复合聚合物电解质的离子电导率低于未添加纳米氢氧化镁的纯PEO聚合物电解质的离子电导率.同时,纳米氢氧化镁可提高PEO聚合物电解质的阳极抗氧化能力,对提高聚合物电解质的电化学稳定性有很好的作用.这些研究结果表明,纳米氢氧化镁/PEO复合聚合物电解质相比纯PEO聚合物电解质的综合性能有很大提高.存在的主要问题是氢氧化镁在PEO中的分散性有待改善.合成更小颗粒的氢氧化镁,并通过在氢氧化镁颗粒表面接上一定的有机基团,是改善氢氧化镁颗粒在PEO中的分散性的重要方法,这也是我们以后关于纳米氢氧化镁/PEO复合聚合物电解质研究工作的重要内容.
1 Armand,M.Solid State Ionics,1994,69:309
2 Glasse,M.D.;Idris,R.;Latham,R.J.;Linford,R.G.;Schlindwein, W.S.Solid State Ionics,2002,147:289
3 Park,Y.W.;Lee,D.S.J.Non-Cryst.Solids,2005,351:144
4 Itoh,T.;Hirata,N.;Wen,Z.Y.;Kubo,M.;Yamamoto,O.J.Power Sources,2001,97-98:637
5 Yu,X.Y.;Xiao,M.;Wang,S.J.;Zhao,Q.Q.;Meng,Y.Z.J.Appl. Polymer Sci.,2010,115:2718
6 Li,X.L.;Guo,J.;Wu,Q.;Cheng,Y.;Long,Y.C.;Jiang,Z.Y. Acta Phys.-Chim.Sin.,2005,21:397 [李雪莉,郭 娟,吴 强,程 岩,龙英才,江志裕.物理化学学报,2005,21:397]
7 Sumathipala,H.H.;Hassoun,J.;Panero,S.;Scrosati,B.Ionics, 2007,13:281
8 Wang,L.S.;Yang,W.S.;Li,X.W.;Evans,D.G.Electrochem. Solid-State Lett.,2010,13:A7
9 Rossi,N.A.A.;West,R.Polym.Int.,2009,58:267
10 Walls,H.J.;Zhou,J.;Yerian,J.A.;Fedkiw,P.S.;Khan,S.A.; Stowe,M.K.;Baker,G.L.J.Power Sources,2000,89:156
11 Scrosati,B.;Croce,F.;Persi,L.J.Electrochem.Soc.,2000,147 (5):1718
12 Kumar,B.;Scanlon,L.;Marsh,R.;Mason,R.;Higgins,R.; Baldwin,R.Electrochim.Acta,2001,46:1515
13 Croce,F.;Curini,R.;Martinelli,A.;Persi,L.;Ronci,F.;Scrosati, B.;Caminiti,R.J.Phys.Chem.B,1999,103:10632
14 Sun,H.Y.;Takeda,Y.;Imanishi,N.;Yamamoto,O.;Sohn,H.J. J.Electrochem.Soc.,2000,147(7):2462
15 Appetecchi,G.B.;Dautzenberg,G.;Scrosati,B.J.Electrochem. Soc.,1996,143(1):6
16 Appetecchi,G.B.;Passerini,S.Electrochim.Acta,2000,45:2139
17 Borkowska,R.;Reda,A.;Zalewska,A.;Wieczorek,W. Electrochim.Acta,2001,46:1737
18 Aihara,Y.;Kuratomi,J.;Bando,T.;Iguchi,T.;Yoshida,H.;Ono, T.;Kuwana,K.J.Power Sources,2003,114:96
19 Yoshizawa,M.;Mukai,T.;Ohtake,T.;Kanie,K.;Kato,T.;Ohno, H.Solid State Ionics,2002,154-155:779
20 Zhang,Z.C.;Sherlock,D.;West,R.;West,R.;Amine,K.;Lyons, L.J.Macromolecules,2003,36:9176
21 Kang,Y.K.;Lee,J.;Suh,D.H.;Lee,C.J.Power Sources,2005, 146:391
22 Liang,Y.H.;Wang,C.C.;Chen,C.Y.Eur.Polym.J.,2008,44: 2376
23 Hong,L.;Cui,Y.J.;Wang,X.L.;Tang,X.Z.J.Polym.Sci.Pol. Phys.,2003,41:120
24 Yang,X.H.;Sun,X.Y.;Shao,J.J.;Liu,Y.H.;Wang,X.L. J.Polym.Sci.Pol.Phys.,2004,42:4195
25 Bai,Y.;Pan,C.H.;Wu,F.;Wu,C.;Ye,L.;Feng,Z.G.Chem.J. Chin.Univ.,2007,28:1796 [白 莹,潘春花,吴 锋,吴 川,叶 霖,冯增国.高等学校化学学报,2007,28:1796]
26 Saito,M.;Ikuta,H.;Uchimoto,Y.;Wakihara,M.;Yokoyama,S.; Yabe,T.;Yamamoto,M.J.Phys.Chem.B,2003,107:11608
27 Croce,F.;Appetecchi,G.B.;Persi,L.;Scrosati,B.Nature,1998, 394:456.
28 Jia,X.W.Flame retarding nano-materials.Beijing:Chemical Industry Press,2005 [贾修伟.纳米阻燃材料.北京:化学工业出版社,2005]
Nanosized Flame Retarded Hydroxide Magnesium/Poly(ethylene-oxide) Composite Polymer Electrolyte
LI Ya-Juan1,*ZHAN Hui2LIU Su-Qin1HUANG Ke-Long1ZHOU Yun-Hong2
(1College of Chemistry and Chemical Engineering,Central South University,Changsha 410083,P.R.China;2College of Chemistry and Molecular Sciences,Wuhan University,Wuhan 430072,P.R.China)
We prepared nanosized hydroxide magnesium(Mg(OH)2)as a plasticizer and a flame-retarding additive for a poly(ethylene-oxide)(PEO)based polymer electrolyte.We characterized the prepared compound using transition electron microscopy(TEM),X-ray diffraction(XRD),and thermogravimetry(TG).The prepared hydroxide magnesium particles are hexagonal crystals with sizes of 50-80 nm.The decomposition of the prepared nanosized hydroxide magnesium started at 340℃.Electrochemical measurements shows that the ionic conductivity of the Mg(OH)2/PEO composite polymer electrolytes(CPEs)increases initially and then decreases with an increase in hydroxide magnesium content.It reaches a maximum when the hydroxide magnesium mass fraction is between 5%and 10%.The anodic decomposition potential of the CPEs increases to a certain extent as the hydroxide magnesium content increases. Hydroxide magnesium has a positive influence on the electrochemical stability of PEO.
Lithium ion battery; Nanosized hydroxide magnesium;Flame-retarding;Poly(ethylene-oxide); Polymer electrolyte
O646
Received:January 15,2010;Revised:May 13,2010;Published on Web:June 23,2010.
*Corresponding author.Email:yajuanlee@163.com;Tel/Fax:+86-731-88879850.
The project was supported by the National Science Foundation for Post-doctoral Scientists of China(20080440989)and Specialized Research Fund for the Doctoral Program of Higher Education of China(20090162120011).
中国博士后基金(20080440989)和高等学校博士学科点专项科研基金(20090162120011)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica
