离子液体中米曲霉果糖基转移酶催化合成蔗果三糖的研究
2010-11-02毛多斌韩亚伟
毛多斌,王 雪,2,韩亚伟
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002; 2.深圳波顿香料有限公司,广东深圳 518051)
离子液体中米曲霉果糖基转移酶催化合成蔗果三糖的研究
毛多斌1,王 雪1,2,韩亚伟1
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002; 2.深圳波顿香料有限公司,广东深圳 518051)
对来自于米曲霉的果糖基转移酶在离子液体中催化蔗糖反应生成蔗果三糖的过程进行了研究。考察了盐平衡、底物蔗糖和酶量的比率、温度、时间、pH、离子液体和酶量的比率对催化得率的影响,其中离子液体的水活度采用盐的高水合物和低水合物组成的水合盐进行控制。结果表明,最优的催化反应条件为:反应温度 40℃,pH6.2,底物浓度60%,反应时间 24h。关于离子液体与酶的重复利用方面,离子液体性质和酶的催化活力有待于进一步研究。
米曲霉,蔗果三糖,果糖基转移酶,离子液体
1 材料与方法
1.1 实验材料
米曲霉 (Aspergillus oryzae) 源于本实验室;蔗糖(纯度 >99.9%) 分析纯,购于 Sigma公司;蔗果三糖标样 (纯度 >96%) 购于 Sigma公司;离子液体 1-丁基 -3-甲基-咪唑六氟磷酸盐 ([BM IM] [PF6])、1-丁基-3-甲基-咪唑双三氟甲黄酰亚胺盐([BM IM][Tf2N])、1,3-二甲基咪唑硫酸盐([MM IM][MeSO4])、1-丁基-3-甲基-咪唑双氰铵盐([BM IM][DCN]) 分别购于 Sigma公司和上海成捷化学试剂公司;柠檬酸-磷酸缓冲液。
1.2 实验方法
1.2.1 菌体培养 将米曲霉菌体接种到种子培养基[4](查氏培养基:NaNO32g、K2HPO41g、KCl 0.5g、MgSO40.5g、FeSO40.01g、蔗糖 30g、蒸馏水 1000mL, 121.5℃、0.1MPa灭菌 20min)中,28℃的生化培养箱里培养 48h。再用接种环挑取长势良好的单菌落,在超净工作台里接种到液体培养基 (小麦麸皮培养基:200g小麦麸皮煮沸 30min的滤出液,定容至 1L,自然pH;121.5℃、0.1MPa灭菌 20min)中,28℃的生化培养箱里培养,转速为 170r/min,培养时间 48h。
将各菌悬液冰浴 30min,在 4℃条件下, 10000r/min离心 20min,收集上清,即为粗酶液,保存在-20℃条件下备用。
1.2.2 超滤 粗酶上清粗略计算为 120mL,孔径为30kD的超滤膜装好于超滤杯中,无气泡,用无菌水清洗几次,冰浴条件下,打开抽滤泵,用液氮保护超滤,超滤时间约 4h,超滤后体积剩余为 10mL,切记最后关掉抽滤泵,以免倒吸。
将超滤后粗酶保存在-20℃条件下备用。清洗超滤膜及超滤杯,泡在 5%甲醛溶液中,和超滤杯保存在 4℃条件备用。
1.2.3 酶含量测定 用考马斯亮蓝结合法 (Bradford法)[4]测蛋白标准曲线,标准曲线如图 1。

图1 蛋白质浓度标准曲线
从图 1可以得出酶蛋白的浓度,并经超滤前后酶活性对比实验得出,超滤后高于超滤前的反应活性,且酶易于保存,所以以下采用的均为超滤后的酶液。
1.2.4 反应体系条件建立 分别取离子液体[BM IM][PF6]、[BM IM][Tf2N]、[BM IM][DCN]、[MM IM][MeSO4]各 500μL,再各加入 1000μL超滤后的酶液加入到 10mL反应容器中,4℃条件下平衡约 5h[5-8]。
做与平衡对比实验:条件同上,未加盐的条件下,依次分别加离子液体、酶及蔗糖后未预平衡直接反应。
各加入该反应容器中约 60%蔗糖,40℃条件,恒温水浴摇床反应 24h后[9],100℃煮沸 10min灭酶活终止反应,将反应体系溶液稀释 200倍保存在-20℃备用。
1.2.5 测定方法
1.2.5.1 标准样品的制备 分别称取 10mg的果糖、葡萄糖、蔗糖、蔗果三糖溶于双蒸水并定容至 10mL,制成四种糖的混合溶液(终浓度均为 1.0mg/mL)。
1.2.5.2 样品处理方法 酶反应后的反应液离心除去沉淀蛋白质等,用双蒸水稀释上清液到相应浓度(以下样品均稀释 200倍),再将稀释液用微孔滤膜过滤后供 HPLC分析用[10-11]。
1.2.5.3 高效液相色谱方法 检测仪器为:高效液相色谱仪和蒸发光散射检测仪;HPLC条件:色谱柱为D-sugar柱 (0.5×25cm),流动相为乙腈-水 (80∶20),流速 1.0mL/min,进样量 15μL,柱温 30℃,管温80℃,分析时间 25min,对照品为蔗果三糖 (GF2)、葡萄糖和果糖标准品。
2 结果及讨论
2.1 标样

图2 标准糖液HPLC图谱
2.2 盐平衡条件下酶的催化
水含量是影响酶活力的关键因素,绝对无水或过少量的水都不足以使酶分子形成其活性构象,也就没有催化活性[12]。我们用预平衡的方法控制初始水活度。我们配制了不同浓度及 pH的缓冲液,从图可以看出,在使用盐的饱和水溶液来预平衡时,当用pH6.2磷酸-柠檬酸缓冲液控制初始水活度时获得了较高的产率。这可能是适当水分子的存在降低了酶分子内部强极性基团间的静电相互作用,使酶分子具有足够的柔性,能够处于催化作用所必需的构象状态。
盐预平衡与未平衡对比结果如图 3、图 4。

图3 粗酶反应未平衡
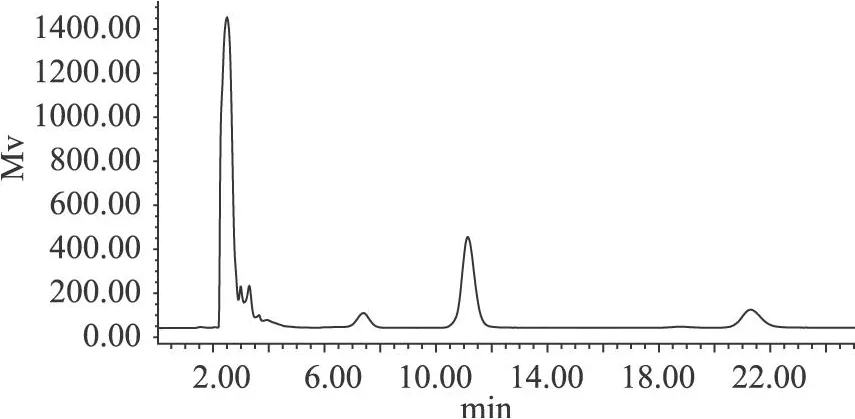
图4 盐平衡5h后的反应
由图 3、图 4比较得出,盐平衡后反应中有较多产物蔗果三糖生成,说明盐平衡后对反应更有利。结果表明,盐平衡 5h后的反应体系中有较多的目的产物生成,有利于反应的酶活性提高,说明在反应之前要预平衡 5h后最佳。
2.3 选择最佳离子液体及条件优化
根据现有文献报道[13-15]的离子液体,结合我们的实验情况,选择了以下几种离子液体,[MM IM] [MeSO4]、[BM IM][PF6]、[BM IM][Tf2N]、[BM IM] [DCN]中在同样条件下反应,作 HPLC结果反应如图5~图8。

图 5 在[BM IM][PF6]中反应
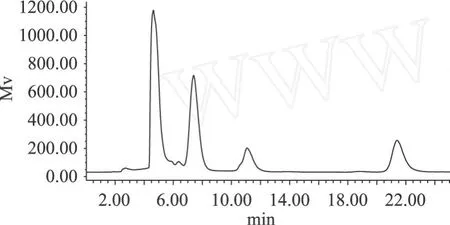
图 6 在[MM IM][MeSO4]中反应

图 7 在[BM IM][Tf2N]中反应

图8 在[BM IM][DCN]中反应
由图 5~图 8可以看出,同样反应条件下,在[BM IM][PF6]中反应,有较多产物蔗果三糖生成,酶在反应中活性较高,且产物中杂质少。在[MM IM] [MeSO4]和[BM IM][Tf2N]中反应,生成目的产物较少,需进一步优化适宜条件,而在 [BM IM][DCN]中反应,无目的产物生成。
结果表明,500μL[BM IM][PF6]和 1000μL酶液,250μL[MM IM][MeSO4]和 750μL酶液反应体系中有较多目的产物生成,而通过这两者的对比以及以上四者的对比结果发现,在[BM IM][PF6]中反应最佳,效果较好,目的产物生成较多。β-果糖基转移酶催化反应的最适反应温度为 40℃,在小于 45℃范围,该酶活力保持很好。果糖基转移酶的最适反应pH为 5.0~6.0的偏酸环境,在 pH为 5.5~7.5时,果糖基转移酶活力保持较好,反应时间为 6~24h,水浴摇床反应条件下为宜。
当反应系统中缓冲液 pH6.2时,β-果糖基转移酶催化蔗糖的反应产率较高;当底物蔗糖含量为60%,浓度为 3.591g/L酶液 1mL,离子液体[BM IM] [PF6]为 0.5mL,40℃反应经过 6h,反应产物较多,反应 24h后产品没有太大变化,但葡萄糖含量增加,通过研究获得了较好的反应条件:pH6.2,温度为 40℃,蔗糖含量为 60%,离子液体和酶液的物质量比为0.5∶1,反应 6h。同时通过对 24h不同时间梯度条件下反应的考察,发现离子液体体积和酶的催化活力都没有明显减少,酶和离子液体都显示了良好的反应性能。
2.4 离子液体中反应的优越性
离子液体作为酶催化反应的溶剂使用方式有三种:第一,和水一起作混合溶剂;第二,单纯作溶剂;第三,和其他非水溶剂组成两项体系。利用离子液体可以解决一些水和有机溶剂不能解决的问题。例如,不同阴阳离子的离子液体,物理性质不一样,可以增加酶和一些反应底物(如碳水化合物等)的溶解度,解决某些物质在有机溶剂中不能充分溶解的问题;通过酶在离子液体中的反应动力学控制,可以使一些反应具有更高的选择性;某些在一般有机溶剂中没有活性或活性较低的酶 (如水解酶),其在离子液体中反应较好地保持了其活性[16]。
水相反应和离子液体中反应作对比如图 9。

图9 水相反应和疏水性离子液体[BM IM][PF6]中反应的对比
疏水性离子液体与亲水性离子液体反应作对比如图10。

图 10 疏水性离子液体[BM IM][PF6]与亲水性离子液体[MM IM][MeSO4]反应作对比
由图 9可以看出,疏水性离子液体反应体系中有较多目的产物蔗果三糖生成,结果表明,酶在离子液体中反应要比在水相中反应活性高,说明在疏水性离子液体中有利于提高果糖基转移酶的转移活性。而由图 10可以进一步看出,酶在疏水性离子液体中反应要比亲水性离子液体中反应活性高,表明:在疏水性离子液体中,更有利于提高果糖基转移酶的转移活性,有利于目的产物生成。
总之,在疏水性离子液体中更有利于酶活性提高,对反应更有利。
2.5 离子液体及酶的重复利用
离子液体的优点之一在于它的蒸汽压低、挥发少而对环境友好,且可以回收并进行反复利用。由于离子液体的价格昂贵,限制了其广泛应用。有效回收并反复使用离子液体的方法是降低成本的关键。初步考察了水/[BM IM][PF6]体系中[BM IM] [PF6]的重复使用性能,但实际过程中发现,由于离子液体[BM IM][PF6]具有很高的黏度,很难通过过滤来达到与固定化酶的分离。可以预见,如果进一步改进离子液体的回收方法,可以更好地实现离子液体的循环使用。因此在不分离酶的情况下,多批次的间歇反应能成为一种反复利用离子液体和酶的手段[17]。
由于反应后采用了多次萃取来回收离子液体,效果不佳,且回收条件不成熟,关于离子液体与酶的回收利用有待于做进一步研究。
3 结论
通过研究发现米曲霉果糖基转移酶在离子液体中能有效催化蔗糖反应生成蔗果三糖,连接 1→2糖苷键,可通过在离子液体中控制水含量的方法调节反应,而结果显示出在[BM IM][PF6]中反应最佳,效果较好,目的产物生成较多,β-果糖基转移酶最佳反应条件为:pH6.2,温度为 40℃,蔗糖含量为 60%,离子液体和酶液的物质量比为 0.5∶1,反应 6h。
同时对离子液体的循环使用进行了初步研究,今后将进一步研究离子液体的回收方法,以提高其循环使用性能。由于离子液体有无毒、不挥发和易分离等“绿色溶剂”的特点,因此水/离子液体两相体系中米曲霉果糖基转移酶可催化 1→2糖苷键连接,并进一步对于合成蔗糖酯将展示出了良好的工业化应用前景[17]。
[1]CharlesM Gordon.New developments in catalysis using ionic liquids[J].Applied CatalysisA:General,2001,222:101-117.
[2]W ilkes J S,ZaworokoM J.Air andWater Stable 1-Ethyl-3-methylimidazolium Based Ionic Liquids[J].Journal ofthe Chemical Society Communication,1992:965-967.
[3]STAPL ETON KW,GUENTSCH E,HOSK INSONM K,et al. On the suitability of kεturbulence modeling for aerosol deposition in the mouth and throat:A comparison with experiment[J]. Journal ofAerosol Science,2000,31:739-749.
[4]Jiakun Su.Purification ofβ-Fructosyltransferase andβ-Fructofuransidase from Aspergillus Oryzaea GX0011 and Their Application in Production of Fructooligosaccharides[D].Guangxi University,2006.
[5]M H Katsoura,A C Polydera,L Tsironis.Use of ionic liquids asmedia for the biocatalytic preparation of flavonoid derivatives with antioxidant potency[J].Journal of Biotechnology,2006,123:491-503.
[6]Pedro Lozano,Teresa De Diego,Daniel Carrié.Synthesis of glycidyl esterscatalyzed by lipases in ionic liquidsand supercritical carbon dioxide[J].Journal ofMolecular CatalysisA:Chemical,2004,113-119.
[7]Holger Pfruender,Ross Jones,Dirk Weuster-Botz.Water immiscible ionic liquids as solvents for whole cell biocatalysis [J].Journal ofBiotechnology,2006:182-190.
[8]Marrit Eckstein,Martin Sesing,UdoKragl.At low water activity α-chymotrypsin is more active in an ionic liquid than in nonionic organic solvents[J].Biotechnology Letters,2002,24:867-872.
[9]Franka Ganske,Uwe T Bornscheuer.Opt imization of lipasecatalyzed glucose fatty acid ester synthesis in a two-phase system containing ionic liquids and t-BuOH[J].Journal of Molecular CatalysisB:Enzymatic,2005,36:40-42.
[10]Gaosong Jiang,Thava Vasanthan.MALD I-MS and HPLC Quantification of Oligosaccharides of Lichenase-Hydrolyzed Water-Solubleâ-Glucan from Ten Barley Varieties[J].J Agric Food Chem,2000,48:3305-3310.
[11]Pedro Lozano,Teresa De Diego,Daniel Carrié.Enzymatic ester synthesis in ionic liquids[J].Journal ofMolecular Catalysis B:Enzymatic,2003,21:9-13.
[12]Cinzia Chiappe,Lisa Neri,Daniela Pieraccini.Application of hydrophilic ionic liquids as co-solvents in chloroperoxidase catalyzed oxidations[J].Tetrahedron Letters,2006,47:5089 -5093.
[13]Mahn-Joo K im,Min Young Choi,Jae Kwan Lee.Enzymatic selective acylation of glycosides in ionic liquids:significantly enhanced reactivity and regioselectivity[J].Journal of Molecular CatalysisB:Enzymatic,2003,26:115-118.
[14]Yu-Gang Shi,Yun Fang,Yue-Ping Ren.Effect of ionic liquid[BM IM][PF6]on asymmetric reduction of ethyl 2-oxo-4 -phenylbutyrate by Saccharomyces cerevisiae[J].J IndMicrobiol Biotechnol,2008,35:1419-1424.
[15]M Mori,R Gomez Garcia,M P Belleville.A new way to conduct enzymatic synthesis in an active membrane using ionic liquids as catalyst support[J].Catalysis Today,2005,104:313-317.
[16]张帆,倪晔,等 .水/离子液体两相体系中出芽短梗霉催化 4-氯-乙酰乙酸乙酯不对称还原合成 (S)-4-氯-3-羟基-丁酸乙酯[J].催化学报,2008,29(6)577-582.
[17]Hua Zhao.Effect of ions and other compatible solutes on enzyme activity,and its implication for biocatalysis using ionic liquids[J].JournalofMolecular CatalysisB:Enzymatic,2005,37:16-25.
GF2(l-Kestose)synthesis by fructosyltransferase from Aspergillus oryzaecatalyzed in ionic liquid
MAO Duo-bin1,WANG Xue1,2,HAN Ya-wei1
(1.Food and Biological Engineering Institute,Zhengzhou University ofLight Industry,Zhengzhou 450002,China; 2.Shenzhen Boton Flavours&Fragrances Co.,Ltd.,Shenzhen,518051,China))
Fruc tosyltransfe rase from Asp e rg illus oryzae transfe rca tion of GF2(l-Kes tose)w ith suc rose in ionic liquid was inves tiga ted.Effec ts of sa lt ba lance,the ra tio of suc rose to enzym e,temp e ra ture,t im e,pH,the ra tio of ionic liquid to enzym e on the reac tion we re exam ined.The wa te r ac tivity in ionic liquid was controlled by sa lt hyd ra te p a irs.The results showed tha t the op t im um yie ld was ob ta ined a t40℃,pH6.2,the subs tra te concentra tion was 60%,reac tion t im e was24hours.The s tudy on the reuse of ionic liquid and enzym e,the p rop e rties of ionic liquids and ac tivities of the enzym e we re wa iting for inves tiga ted.
Asp e rg illus oryzae;GF2(l-Kes tose);fruc tosyltransfe rase;ionic liquid
TS202.3
B
1002-0306(2010)02-0300-04
早在 1914年[1]就发现了第一个离子液体——硝基乙胺,但其后此领域的研究进展缓慢,直到 1992[2]年,W ilkes领导的研究小组合成了低熔点、抗水解、稳定性强的 1-乙基-3-甲基咪唑四氟硼酸盐离子液体 ([em im][BF4])后,离子液体的研究才得以迅速发展,随后开发出了一系列的离子液体体系。离子液体作为一种新型的对环境友好的绿色溶剂,具有蒸汽压低、热稳定性高,可以针对不同物化性质要求设计合成等优点,已替代有机溶剂作为许多种化学反应的介质[3]。离子液体的独特结构,可以使酶悬浮在离子液体中从而大大降低酶的失活率,提高了酶热稳定性、操作稳定性、立体选择性和对映体选择性。离子液体中酶催化反应的机理虽不甚明确,但是可以通过离子液体中酶催化反应的一些特殊性质得出一些初步的合理解释,从而有利于离子液体作为酶催化反应介质进一步研究。近些年来对离子液体中果糖基转移酶的催化反应研究还未见报道。本研究就以蔗糖为底物,对果糖基转移酶在离子液体中催化合成蔗果三糖的反应进行了探讨。
2009-03-17
毛多斌(1962-),男,教授,研究方向:烟草化学与香精香料。
国家自然科学基金项目(20676127)资助;郑州轻工业学院重大预演基金(xyyjj02)。
