响应面法优化海藻酸钠-淀粉固定化蒜氨酸酶
2010-11-02相姝楠甘芝霖胡雪芳李淑燕陈芹芹倪元颖
曹 阳,相姝楠,甘芝霖,刘 萍,胡雪芳,李淑燕,陈芹芹,姜 莎,倪元颖
(中国农业大学食品科学与营养工程学院,农业部果蔬加工重点开放实验室,果蔬加工教育部工程研究中心,北京100083)
响应面法优化海藻酸钠-淀粉固定化蒜氨酸酶
曹 阳,相姝楠,甘芝霖,刘 萍,胡雪芳,李淑燕,陈芹芹,姜 莎,倪元颖*
(中国农业大学食品科学与营养工程学院,农业部果蔬加工重点开放实验室,果蔬加工教育部工程研究中心,北京100083)
探讨了海藻酸钠-淀粉固定化蒜氨酸酶技术,对影响固定化酶酶活回收率和硬度的因素进行了研究,并利用响应面法对固定化酶工艺进行优化。结果表明,固定化酶的酶活回收率和硬度受刀豆球蛋白A浓度、海藻酸钠浓度和氯化钙浓度的影响较为显著,所得到优化条件为:刀豆球蛋白浓度1.02mg/mL,海藻酸钠浓度2.25%,氯化钙浓度2.22%,由此得到的固定化酶的酶活回收率可达78.15%,硬度为2076.69g。
海藻酸钠,淀粉,刀豆球蛋白A,蒜氨酸酶,固定化
1 材料与方法
1.1 材料与仪器
新鲜、无病虫害、充分成熟的紫皮洋葱 市售,4℃储存备用;海藻酸钠、淀粉 北京奥博星生物技术有限责任公司;刀豆球蛋白A sigma公司;底物实验室自制[10];其它试剂 均为分析纯。
食物调理机 德国BROWN公司;RE-52A型旋转蒸发仪、SHZ-!型循环水真空泵 上海亚荣生化仪器厂;PHS-3C型精密pH计 上海雷磁仪器厂;Hitachi Himac CR22g高速冷冻离心机 日本日立株式会社;S22-2磁力搅拌器 上海司乐仪器有限公司;1mL注射器 常州悦康医疗器材有限公司;DK-98-1型电热恒温水浴锅 上海精宏精密实验设备有限公司;TA-XT2i物性测试仪 英国 Stable Micro System公司;UV757CRT紫外可见分光光度计普析通用。
1.2 实验方法
1.2.1 蒜氨酸酶粗酶液的提取 称取1kg新鲜的去皮洋葱鳞茎,在4℃冰柜中预冷4h。取出后将每个洋葱切成4块,与2L Tris-HCl缓冲液混合,用高速组织捣碎机破碎,之后用6层纱布过滤,滤液于冷冻离心机中离心去除残渣。取上清液,首先加入最终饱和浓度为30%的硫酸铵沉淀除去杂蛋白,离心后取上清液再加入终浓度为65%的硫酸铵盐析,离心后得到的白色沉淀即为蒜氨酸酶。再用缓冲液将其溶解,之后进行高速冷冻离心,过滤除去沉淀及杂质,将得到的酶液装入截流分子量为8000~12000的透析袋除盐,得到蒜氨酸酶粗提液,此过程均在0~4℃下完成[11]。
1.2.2 蒜氨酸酶的固定化 称取一定量的刀豆球蛋白A,加入到10mL经1.2.1制得的酶液,再加入一定量的海藻酸钠和淀粉,充分搅拌均匀。用1mL注射器吸取上述溶胶,逐滴滴入一定浓度的氯化钙溶液中,使之成为大小均一的球状凝胶珠,再将形成的凝胶珠置于该氯化钙溶液中于4℃的冰箱中硬化6h。然后将抽滤所得的硬化凝胶珠,用缓冲液洗涤以除去残留的蛋白和氯化钙,得到直径2.0mm左右的球状固定化蒜氨酸酶,于4℃的冰箱中备用。
1.2.3 单因素实验 通过预实验可知,添加淀粉可以减小凝胶珠的溶胀,并可增加凝胶珠的硬度。而淀粉的添加量对酶活回收率并无显著性影响,因而本实验将淀粉的浓度固定在2.25%(w/v)。
1.2.3.1 刀豆球蛋白A浓度对酶活回收率和硬度的影响 在其它条件恒定(2%海藻酸钠、2%氯化钙)时,按照1.2.2中的方法用0.6、0.8、1.0、1.2、1.4mg/mL的刀豆球蛋白A制成固定化酶,测定固定化酶的酶活回收率和硬度。
1.2.3.2 海藻酸钠浓度对酶活回收率和硬度的影响
在其它条件恒定(1.0mg/mL刀豆球蛋白A、2%氯化钙)时,按照1.2.2中的方法用1%、1.5%、2%、 2.5%、3%(w/v)的海藻酸钠制成固定化酶,测定固定化酶的酶活回收率和硬度。
1.2.3.3 氯化钙浓度对酶活回收率和硬度的影响在其它条件恒定(1.0mg/mL刀豆球蛋白A、2%海藻酸钠)时,按照1.2.2中的方法将溶胶滴入1%、2%、3%、4%、5%(w/v)的氯化钙溶液中制成固定化酶,测定固定化酶的酶活回收率和硬度。
1.2.4 优化实验设计 依据Design Expert软件,采用Central Composite Design建立数学模型,以海藻酸钠浓度X1、刀豆球蛋白A浓度X2和氯化钙浓度X3三个因子为自变量,按方程xi=(Xi-Xo)/△X对自变量进行编码。其中,xi为自变量的编码值,Xi为自变量的真实值,Xo为实验中心点处自变量的真实值,△X为自变量的变化步长。以酶活回收率和硬度为响应值,建立回归方程模型。
1.2.5 分析方法
1.2.5.1 丙酮酸钠标准曲线的制作 准确称取110mg丙酮酸钠,溶解后定容于100mL容量瓶,制成0.01mol/L丙酮酸钠溶液。取5只100mL容量瓶分别加入0.2、0.4、0.6、0.8、1.0mL丙酮酸钠,用蒸馏水定容。分别从各容量瓶中吸取4mL丙酮酸钠溶液加入5只试管中,然后各管分别加入1mL、0.005mol/L的2,4-二硝基苯肼溶液,于25℃下反应5min;再加入5mL、1.0mol/L的NaOH溶液,于25℃下反应10min,最后在420nm处测定各管吸光度值(空白以蒸馏水代替丙酮酸溶液),依据各吸光度值及对应的丙酮酸含量绘制标准曲线。

图1 丙酮酸钠标准曲线
其标准曲线回归方程为:y=0.0031+0.01257x,R2=0.9996。其中:y-吸光度,x-酶活力(U)。
1.2.5.2 酶活测定方法 酶活力定义:35℃条件下,每分钟产生1"g丙酮酸定义为一个酶活单位(U)。
游离酶活力的测定按文献[12]中的方法改进后进行,即向试管中加入500"L底物,再加入500"L酶液,35℃反应后加入1mL、10%三氯乙酸以终止反应,再加入0.5mL的2,4-二硝基苯肼反应5min,之后加入 2.5mL 1.0mol/L氢氧化钠反应 10min,于420nm波长处进行比色测定吸光值。
固定化酶活力的测定以一定量的固定化酶代替游离自由酶,按游离酶活力测定方法测定。
1.2.5.3 酶活力回收率计算
酶活回收率(%)=固定化酶总活力/用于固定化的酶的总活力×100%
1.2.5.4 固定化酶硬度的测定 随机取5粒固定化酶,采用物性测试仪测定其硬度。主要参数设定为:SM SP/36R圆柱型探头;测试前、中、后速度分别为5.0、2.0、5.0mm/s;测定形变限 80%;记录速率200pps;力量感元20g。固定化酶硬度以应力-应变(时间)曲线最大峰值(g)表示。

表2 响应面分析实验设计及结果
2 结果与讨论
2.1 单因素实验结果
2.1.1 刀豆球蛋白A浓度对酶活回收率和硬度的影响 图2结果表明,当刀豆蛋白A浓度为1.0mg/mL时,所得固定化酶的酶活回收率最高,达到72.29%。当刀豆球蛋白A浓度小于1.0mg/mL时,随着刀豆球蛋白A的浓度增高,酶活回收率逐渐增高;当刀豆球蛋白A浓度大于1.0mg/mL时,随着刀豆球蛋白A的浓度增高,酶活回收率逐渐下降。由多重比较发现,各点之间的酶活回收率差异显著。随着刀豆球蛋白A浓度的改变,固定化酶硬度之间的差异不显著。
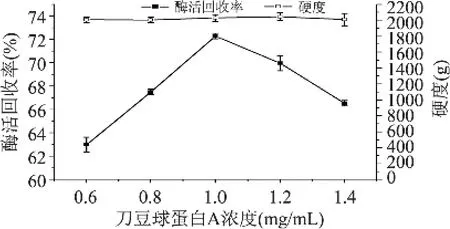
图2 刀豆球蛋白A浓度对酶活回收率和硬度的影响
2.1.2 海藻酸钠浓度对酶活回收率和硬度的影响图3结果表明,当海藻酸钠浓度小于2.5%时,酶活回收率随着海藻酸钠的浓度增大而增大,而当海藻酸钠浓度大于2.5%时,酶活回收率由于凝胶珠过于致密等原因而呈现下降的趋势。由多重比较发现,酶活回收率在海藻酸钠浓度为2.0%与2.5%时不存在显著性差异,其余均存在显著性差异。海藻酸钠浓度在1%~3%范围内,随着海藻酸钠浓度升高,固定化酶珠硬度呈现逐渐上升趋势,且由多重比较发现各点之间均存在显著性差异。
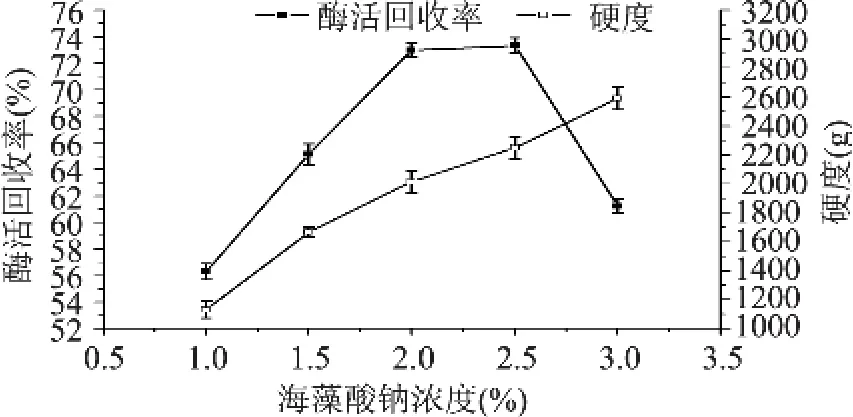
图3 海藻酸钠浓度对酶活回收率和硬度的影响
2.1.3 氯化钙浓度对酶活回收率和硬度的影响 图4结果表明,当氯化钠浓度为2%时,所得固定化酶的酶活回收率最高,达到72.37%。当氯化钠浓度小于2%时,随着氯化钠浓度增高酶活回收率增高;当氯化钠浓度大于2%时,随着氯化钠浓度增高酶活回收率逐渐下降。氯化钙浓度在1%~5%范围内,随着氯化钙浓度的升高,固定化酶的硬度逐渐增大。
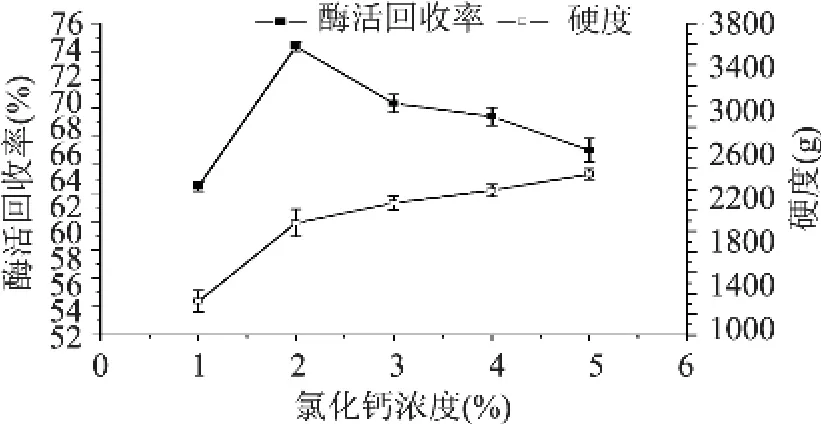
图4 氯化钙浓度对酶活回收率和硬度的影响
2.2 响应面法优化固定化酶工艺
2.2.1 响应面法因素与水平的选择 根据单因素实验结果,采用三因素五水平的响应面法,实验因子编码及水平见表1。
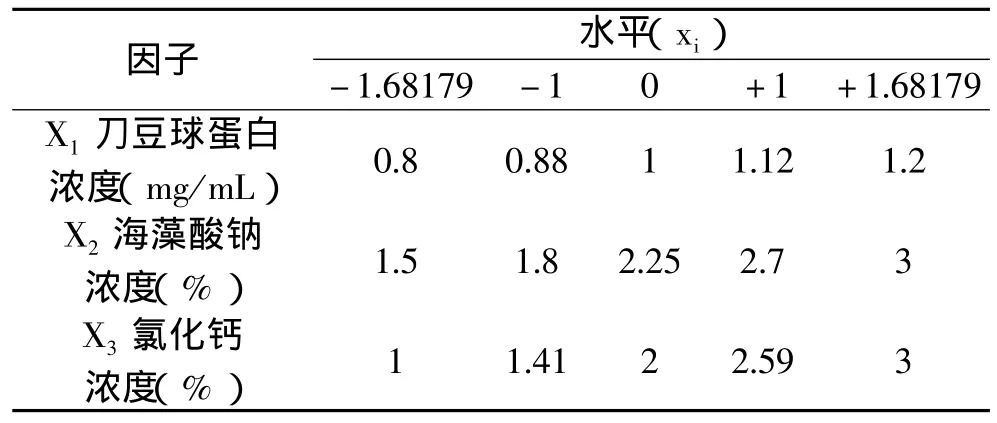
表1 响应面三因素五水平实验设计
2.2.2 响应面法实验设计及结果 表2中给出了固定化酶的酶活回收率和硬度的实验结果。
按照Design Expert软件中的Central Composite Design模型,对实验设计各组的酶活回收率进行回归分析,得回归方程为:

式中:Y1为固定化酶的酶活回收率;x1、x2、x3分别为上述3个自变量的编码值。
对模型进行方差分析,见表3。本实验所选模型的F值是54.40(<0.0001),表明不同处理间差异极显著。失拟项P=0.4812>0.05,失拟项差异不显著,表明该方程对实验拟合程度好,实验误差小。该模型相关系数是0.9839,校正决定系数是0.9658,说明该模型能解释96.58%响应值变化,仅有3.42%的变异不能用此模型解释;它和校正决定系数接近,表明此模型是合适的。对模型进行模型系数显著性检验,见表4。回归模型的常数项极显著,一次项x1、 x2、x3极显著,二次项极显著,交互项x2x3显著,其余不显著。依据三个一次项回归系数绝对值的大小可知,因素的主效应关系为:氯化钙浓度>刀豆球蛋白浓度>海藻酸钠浓度。
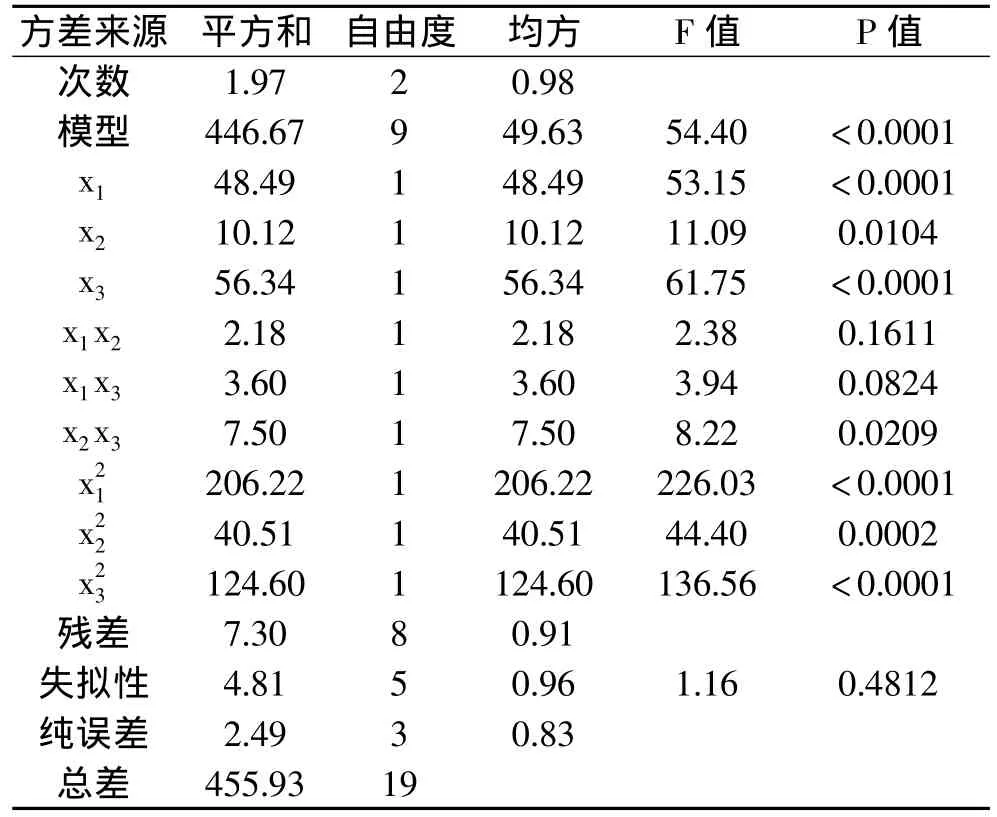
表3 回归模型方差分析表
按照Design Expert软件中的Central Composite Design模型,对实验设计各组的硬度进行回归分析。结果表明,线性模型较二次回归模型更适宜于描述各自变量对实验结果的影响规律,经优化所得的线性回归方程为:
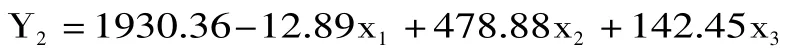
式中:Y2为固定化酶的硬度;x1、x2、x3分别为上述3个自变量的编码值。
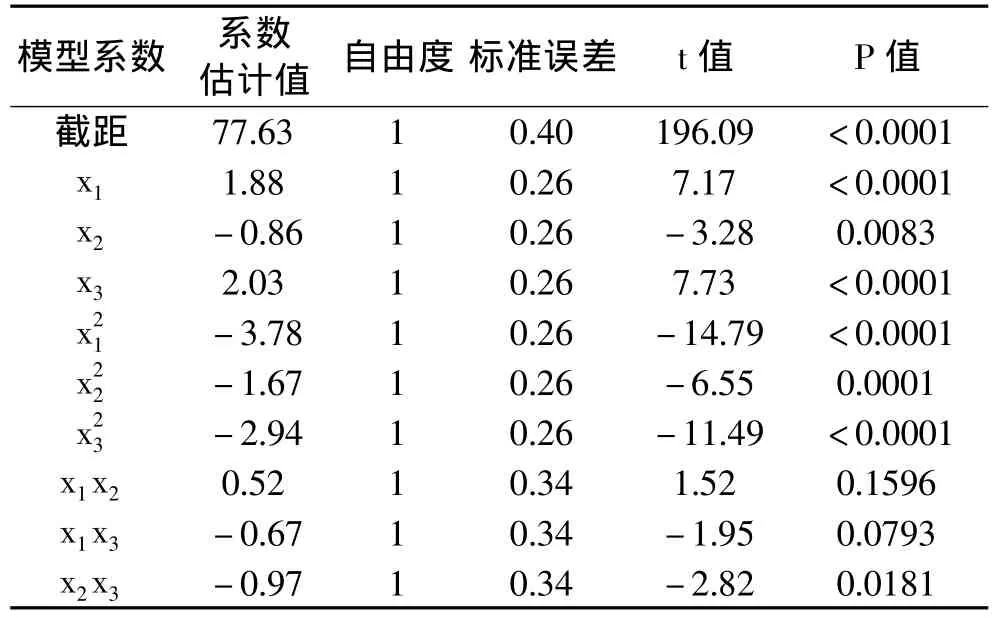
表4 回归方程模型系数的显著性检验
该模型相关系数是0.9328;校正决定系数是0.9185,说明该模型能解释91.85%响应值变化,仅有8.15%的变异不能用此模型解释;说明此模型能够充分描述各实验因素对实验指标的影响规律。依据三个一次项回归系数绝对值的大小可知因素的主效应关系为:海藻酸钠浓度>氯化钙浓度>刀豆球蛋白浓度。
2.2.3 响应面法分析与优化
2.2.3.1 酶活回收率的分析 根据模型的回归方程,固定一个因素在编码值0的水平,分析另外两个因素对酶活回收的影响,Design Expert软件生成3个三维响应面(图5~图7)。
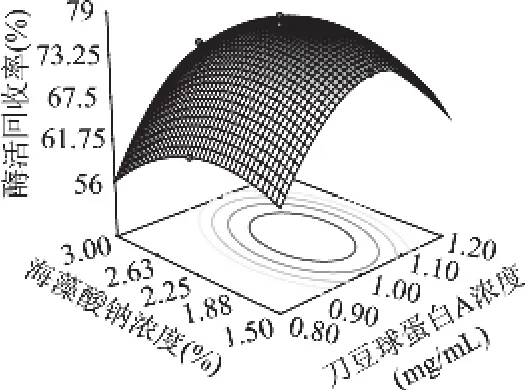
图5 海藻酸钠浓度和刀豆球蛋白A浓度的响应面

图6 氯化钙浓度和刀豆球蛋白A浓度的响应面

图7 氯化钙浓度和海藻酸钠浓度的响应面
从图5可以看出,氯化钙浓度在2%时,海藻酸钠浓度和刀豆球蛋白浓度对酶活回收率的影响。当海藻酸钠浓度不变时,随着刀豆球蛋白浓度的升高,酶活回收率先升高后降低;当刀豆球蛋白浓度不变时,随着海藻酸钠浓度的升高,酶活回收率呈现同样的变化趋势。酶活回收率的变化速率显示刀豆球蛋白浓度的主效应大于海藻酸钠浓度,与统计结果相符。从图6可以看出,海藻酸钠浓度在2.25%时,氯化钙浓度和刀豆球蛋白浓度对酶活回收率的影响。当氯化钙浓度不变时,随着刀豆球蛋白浓度的升高,酶活回收率先升高后降低。酶活回收率的变化速率显示氯化钙浓度的主效应大于刀豆球蛋白浓度,与统计结果相符。从图7可以看出,刀豆球蛋白浓度在1mg/mL时,氯化钙浓度和海藻酸钠浓度对酶活回收率的影响。酶活回收率的变化速率显示氯化钙浓度的主效应大于海藻酸钠浓度,与统计结果相符。等高线的形状反映交互效应的强弱大小,椭圆形表示两因素交互作用显著[13]。比较图5~图7等高线可知,氯化钙浓度和海藻酸钠浓度的交互作用最为显著。
2.2.3.2 硬度的分析 根据模型的回归方程,固定两个因素在编码值0的水平,分析另外一个因素对硬度的影响,Design Expert软件生成3个线性图(图8~图10)。
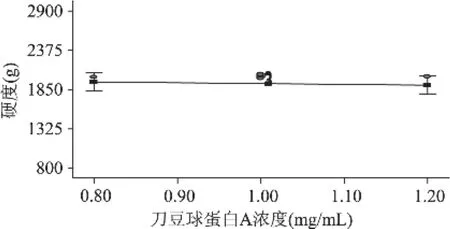
图8 刀豆球蛋白A浓度对硬度的影响
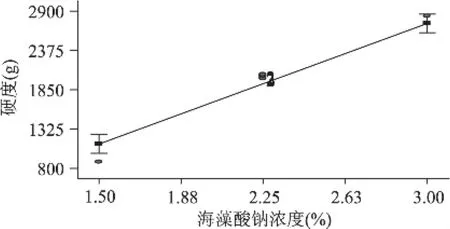
图9 海藻酸钠浓度对硬度的影响

图10 氯化钙浓度对硬度的影响
从图8可以看出,氯化钙浓度在2%、海藻酸钠浓度在2.25%时,刀豆球蛋白浓度对酶活回收率的影响。随着刀豆球蛋白浓度的升高,硬度变化趋势不明显。从图9可以看出,氯化钙浓度在2%、刀豆球蛋白浓度在1mg/mL时,海藻酸钠浓度对硬度的影响。随着刀豆球蛋白浓度的升高,硬度逐渐上升。从图10可以看出,刀豆球蛋白浓度在1mg/mL、海藻酸钠浓度在2.25%时,氯化钙浓度对硬度的影响。随着氯化钙浓度的升高,硬度逐渐上升。从三个图形的变化速率可以看出,海藻酸钠浓度的主效应大于氯化钙浓度,氯化钙浓度的主效应大于刀豆球蛋白浓度,与统计结果相符。
2.2.3.3 优化 由于本实验的目的是获得较高的酶活回收率和较好的固定化酶硬度,因此优化结果选择在较高的酶活回收率基础上有较好的固定化酶硬度。用Design Expert软件进行优化,刀豆球蛋白A浓度、海藻酸钠浓度和氯化钙浓度都选择在本实验范围内;酶活回收率的目标选择最大,重要性选择+++++,最低值选择63.7071,最高值选择78.6058,权重选择1;硬度的目标选择最大,重要性选择+,最低值选择887.322,最高值选择2835.93,权重选择1。
优化的结果为:刀豆球蛋白浓度1.02mg/mL,海藻酸钠浓度2.25%,氯化钙浓度2.22%。在这个条件下获得的固定化蒜氨酸酶的酶活回收率为78.15%,同时固定化酶的硬度为2076.69g。
2.2.3.4 验证实验 对响应面法优化的结果进行验证,即在刀豆球蛋白浓度1.02mg/mL,海藻酸钠浓度2.25%,氯化钙浓度2.22%的条件下,对优化实验结果进行验证实验。在此条件下,固定化蒜氨酸酶的酶活回收率为78.23%,硬度为2089.86g,接近且都略高于Design Expert软件得到的预测值。由此证明实验模式合理,实验结果理想。
3 结论
3.1 本实验利用 Design Expert软件,采用 Central Composite Design建立酶活回收率回归模型为:Y1= 77.63+1.88x1-0.86x2+2.03x3+0.52x1x2-0.67x1x3-;硬度回归模型为:Y2=1930.36-12.89x1+478.88x2+142.45x3,两个方程拟合程度良好,实验误差小。
3.2 利用模型的响应面及其等高线对影响酶活回收率的关键因子及其相互作用进行探讨,同时对影响硬度的关键因子进行了探讨,优化出了较高的酶活回收率和较好的固定化酶硬度的条件为:刀豆球蛋白浓度1.02mg/mL,海藻酸钠浓度2.25%,氯化钙浓度2.22%,所得的固定化蒜氨酸酶的酶活回收率为78.15%,硬度为2076.69g。
3.3 以海藻酸钠-淀粉为载体固定蒜氨酸酶可以实现酶的反复利用,为蒜氨酸酶的工业化应用提供了理论依据。将来可对固定化蒜氨酸酶的酶学性质进一步研究,以获得固定化酶反应最适温度及最适pH等条件;也可对固定化酶与底物反应产生硫化合物的适宜条件进行探索,使反应朝着对人类有益的方向进行。
[1]Stoll A,Seebeck E.The enzymatic decomposition of alliinase and the properties of alliinase[J].Helvetica Chimica Acta,1949,32:197-205.
[2]Block E,Putman D,Sha D Y,et al.Allium chemistry: Synthesis of 1-[alk(en)yl sulfinyl]propyl alk(en)yl disulfides(cepaenes),antithrombotic flavorants from homogenates of onion(Allium cepa)[J].Journal of Agricultural and Food Chemistry,1997,45(11):4414-4422.
[3]陈陶声,居乃琥,陈石根.固定化酶理论与应用[M].北京:北京轻工业出版社,1987.
[4]Milka P,Krest I,Keusgen M.Immobilization of Alliinase on Porous Aluminum Oxide[J].Biotechnology and Bioengineering,2000,69(3):344-348.
[5]Keusgen M,Glodek J,Milka P,et al.Immobilization of Enzymes on PTFE Surfaces[ J] .Biotechnology and Bioengineering,2001,72(5):530-540.
[6]程龙军,郭得平.葱属类作物中的蒜氨酸酶[J].植物生理学通讯,2001,37(5):471-474.
[7]Cheirsilp B,Jeamjounkhaw P,H-Kittikun A.Optimizing an alginate immobilized lipase for monoacylglycerol production by the glycerolysis reaction[J].Journal of Molecular Catalysis B:Enzymatic,2009(on press).
[8]O’Riordan K,Andrews D,Buckle K,et al.Evaluation of microencapsulation of a bifidobacterium strain with starch as an approach to prolonging viability during storage[J].Journal of applied microbiology,2001,91:1059-1066.
[9] Lanthong P,Nuisin R,Kiatkamjornwong S.Graft copolymerization,characterization,and degradation of cassava starch-g-acrylamide/itaconic acid superabsorbents[J]. Carbohydrate Polymers,2006,66(2):229-245.
[10]Wang H,Li J,Wang Z,et al.Modified Method for Rapid Quantitation of S-Alk(en)yl-L-cysteine Sulfoxide in Yellow onions(Allium cepa L.)[J].Agricultural and Food Chenistry,2007,55(14):5429-5435.
[11]张雪.洋葱中蒜氨酸酶的分离纯化及其酶学性质研究[D].北京:中国农业大学,2007.
[12]Uddin M M,MacTavish H S.Controlled atmosphere and regular storage-induced changes in S-alk(en)yl-L-cysteine sulfoxides and alliinase activity in onion bulbs(Allium cepa L.cv. Hysam)[J].Postharvest Biology and Technology,2003,28(2):239-245.
[13]杜瑞卿,庞发虎,禇雪英,等.响应面分析法优化山茱萸多糖提取工艺参数[J].计算机与应用化学,2008,25(1):99-103.
Optimization of the conditions of the alliinase’s immobilization in sodium alginate-starch by response surface methodology
CAO Yang,XIANG Shu-nan,GAN Zhi-lin,LIU Ping,HU Xue-fang,LI Shu-yan,CHEN Qin-qin,JIANG Sha,NI Yuan-ying*
(College of Food Science and Nutritional Engineering,China Agricultural University Engineering Research Centre for Fruits and Vegetables Processing,Ministry of Education Key Laboratory of Fruits and Vegetables Processing,Ministry of Agriculture,Beijing 100083,China)
The technology of alliinase’s immobilization in sodium alginate-starch was discussed.Some factors affecting the enzyme recovery and hardness of immobilized alliinase were investigated,and the process of immobilization was optimized using response surface methodology.The result showed that the enzyme recovery and hardness ofimmobilized alliinase were affected byconcanavalin A concentration,sodium alginate concentration and calcium chloride concentration.The optimum conditions were 1.02mg/mL concanavalin A,2.25% sodium alginate and 2.22%calcium chloride.Finally the enzyme recovery was 78.15%and hardness was 2076.69g.
sodium alginate;starch;concanavalin A;alliinase;immobilization
Q814.2
A
1002-0306(2010)07-0162-06
蒜氨酸酶,全称为S-烷基-L-半胱氨酸亚砜酶,又称蒜酶、烷基半胱氨酸亚砜酶、C-S酶等。1949年Stoll和Seebeck首次从大蒜中分离得到蒜氨酸酶[1]。洋葱中的有机硫化物具有抗菌消炎、抗过敏、抗血栓形成、抗癌和抑制糖尿病等保健功能[2]。当洋葱组织被破碎或受到机械损伤、细胞壁受到破坏时,无味、非挥发性的非蛋白含硫氨基酸前体物质S-烃基-L-半胱氨酸亚砜才与蒜氨酸酶接触形成这类化合物。蒜氨酸酶的应用受游离酶的稳定性差的限制,通常情况下固定化酶的稳定性有所提高,同时固定化酶容易实现酶和底物、产物的分离,并可在较长时间内进行反复分批反应和装柱连续反应[3]。目前有关固定化蒜氨酸酶方面的报道较少,仅有国外少数科学家对其进行了研究[4-5],国内未见报道。刀豆球蛋白A是从刀豆和豌豆等籽粒中提取而得的一种植物凝集素,为四聚体球蛋白,每个亚基含一个糖结合部位,能与葡萄糖、甘露糖结合。洋葱中的蒜氨酸酶是一种糖蛋白,其糖链上含有葡萄糖和甘露糖[6]。因而,刀豆球蛋白A能与蒜氨酸酶结合。由于刀豆球蛋白A是四聚体蛋白,因而它可与几个蒜氨酸酶分子同时结合,一方面新形成的物质比游离的蒜氨酸酶空间体积大,从而减少了蒜氨酸酶的泄露;另一方面使固定化酶结合的酶量增多,提高了固定化酶的蛋白偶联率。海藻酸盐温和的凝胶性能和无毒性,使它成为最广泛使用的固定化的材料之一[7]。淀粉是高分子量聚合物,可使固定化酶适应不利的外界条件[8-9],缓解海藻酸钠凝胶珠遇水溶胀。本文主要研究了刀豆球蛋白A浓度、海藻酸钠浓度和氯化钙浓度对酶活回收率和硬度的影响,应用响应面优化法确定固定化蒜氨酸酶的适宜工艺参数。
2009-07-24 *通讯联系人
曹阳(1985-),女,在读硕士生,主要从事天然产物提取及食品研发的研究。
国家自然科学基金资助项目(30871748)。
