二十二碳六烯酸海藻糖酯的分离纯化及鉴定
2010-11-02孙月娥夏文水
孙月娥,夏文水,陈 洁
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
二十二碳六烯酸海藻糖酯的分离纯化及鉴定
孙月娥,夏文水,陈 洁*
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
在叔丁醇中以二十二碳六烯酸(DHA)乙酯和海藻糖为原料,通过固定化脂肪酶催化合成DHA海藻糖酯,并对其分离纯化方法进行研究。确定DHA海藻糖酯的薄层层析(TLC)条件:展开剂为乙酸乙酯/甲醇/水(8.5/1/0.5,v/v/v),碘蒸气显色 10min;硅胶柱层析条件:正己烷/异丙醇/甲醇(5/4/1和 4/4/2,v/v/v)梯度洗脱,流速 1.3mL/min,1管/7min收集洗出液;用半制备高效液相色谱(HPLC)进一步纯化单酯收集液,经分析型 HPLC检测纯度后用核磁共振(NMR)方法进行结构鉴定,确定为DHA藻糖单酯。
二十二碳六烯酸(DHA),海藻糖酯,固定化脂肪酶,纯化,核磁共振(NMR)
1 材料与方法
1.1 材料与设备
硅胶(200~300目)、硅胶板 (G254) 青岛海洋化工;甲醇(色谱纯) 江苏汉邦科技有限公司;海藻糖 (食品级) 日本林原公司;DHA乙酯 (含量 >75%) 无锡市迅达海洋生物制品厂赠送;4Å分子筛、叔丁醇及其它有机溶剂 分析纯,中国医药集团上海试剂有限公司;固定化脂肪酶Novozym 435 诺维信公司。
Waters高效液相色谱-质谱联用仪、Waters半制备型高效液相色谱仪 美国Waters公司;LC20A分析型高效液相色谱仪 日本岛津公司;Seastar旋转蒸发器 无锡星海王生化设备有限公司;水浴恒温振荡器 上海精宏实验设备有限公司;BRUKER 500MHz核磁共振仪 德国Bruker公司。
1.2 实验方法
1.2.1 非水相酶法合成DHA海藻糖酯 在 250mL圆底烧瓶(包裹锡箔纸)中分别加入150mL预脱水的叔丁醇、1.5g海藻糖、4.24g DHA乙酯、1.5g固定化脂肪酶Novozym 435,充氮保护,在 50℃恒温水浴振荡器(150r/min)中避光反应 50h。
1.2.2 液质联用分析(HPLC-MS)
1.2.2.1 色谱条件 色谱柱,Y MC-Pack ODS-A, 4.6mm×250mm,5μm;流动相 A,超纯水 (0.3%甲酸);流动相 B,甲醇;流动相 C,正己烷;梯度洗脱程序:0~15min,A 20%~0%,B 80%~100%;15~30min, B 90%~100%,C 0%~10%。流速,1mL/min;检测波长,205nm;柱温,30℃;进样量 10μL。
1.2.2.2 质谱条件 (MS) Waters Platfor mZ MD 4000,电喷雾离子化源,正离子模式 ES+:毛细管电压 4.20kV,锥孔电压 36V,离子源温度 100℃,脱溶剂气温度 250℃,质量范围 (m/z)200~1400,光电倍增器电压 650V,Analyser真空度 2.6e-5mBar,气体流速4.3L/h。负离子模式 ES-:毛细管电压 4.23kV,锥孔电压 36V,离子源温度 100℃,脱溶剂气温度 250℃,质量范围 (m/z)200~1400,光电倍增器电压 650V, Analyser真空度 2.6e-5mBar,气体流速 4.3L/h。
1.2.3 硅胶柱层析分离纯化 将反应液过滤,除去固定化脂肪酶,减压浓缩,浓缩液上硅胶层析柱 (硅胶 200~300目,30mm×400mm),流动相为正己烷/异丙醇 /甲醇 =5/4/1、4/4/2(v/v/v)梯度洗脱,流速为 1.3mL/min,按 1管/7min分段收集洗出液,同时进行 TLC检验。将斑点相同者用分析型 HPLC进一步检测,合并杂质较少的收集管中的流出物,将其进行减压浓缩后,用半制备液相色谱进一步分离纯化。
1.2.4 薄层色谱(T LC)分析 将经过硅胶柱层析收集的粗分离液在硅胶薄层板上点样,展开剂为乙酸乙酯/甲醇/水 (8.5/1/0.5,v/v/v),展开 10min,碘蒸气显色。
1.2.5 半制备液相色谱纯化 色谱条件:Sunfire C18色谱柱(150mm×19mm i.d.,10μm),流动相甲醇∶水(v/v)=85∶15,流速 8.0mL/min,检测波长 205nm,进样量 500μL,柱温 30℃。
1.2.6 分析型 HPLC分析 岛津 LC-20A分析型HPLC色谱条件:Sunfire C18反相色谱柱 (150mm × 4.6mm i.d.,5μm),流动相为甲醇∶水 (v/v)=85∶15,二极管阵列检测器 (PDA),流速 1.0mL/min,上样量10μL,检测波长 205nm,柱温 30℃。
1.2.7 DHA海藻糖单酯结构鉴定 核磁共振(NMR):样品溶解于氘代甲醇中,用 BRUKER 500MHz核磁共振仪测定产物的13C NMR图谱。
2 结果与分析
2.1 DHA海藻糖酯的合成与 HPLC-MS分析
DHA乙酯与海藻糖进行酯交换反应的过程见图 1,由于海藻糖是分子结构对称的二糖,6-和 6′-位置的羟基较活跃,因此,有可能在 6-OH和 6′-OH上进行酯交换反应,生成相应的DHA海藻糖的单酯和二酯。
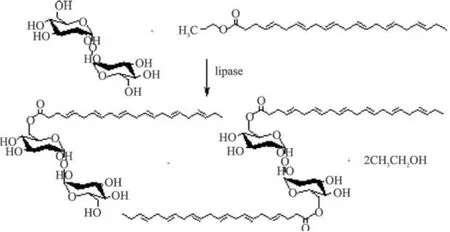
图1 DHA海藻糖酯的合成路线
实验中得到的合成反应液经过滤、梯度洗脱和在线柱后质谱鉴定,结果如图 2和图 3所示。图 2显示,合成反应液经过液相色谱仪后出现较多的峰,但是经在线质谱检测,发现只是在保留时间为 8.27min和 17.54min的组分为可能的目标产物。
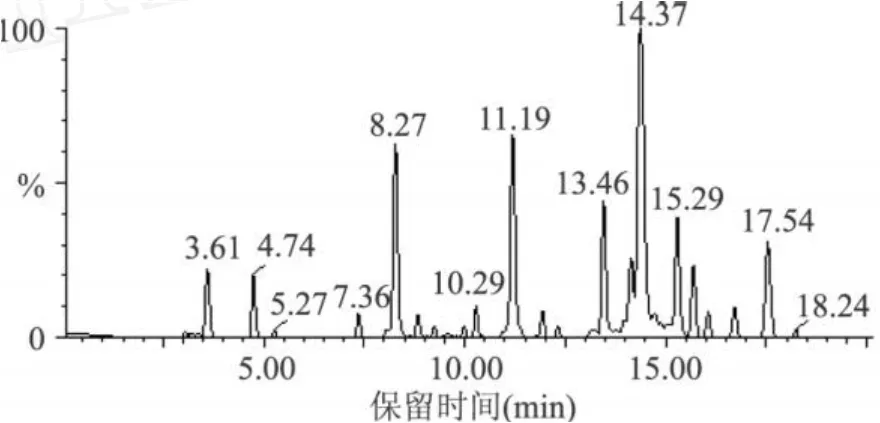
图2 DHA海藻糖酯反应液的色谱分离图
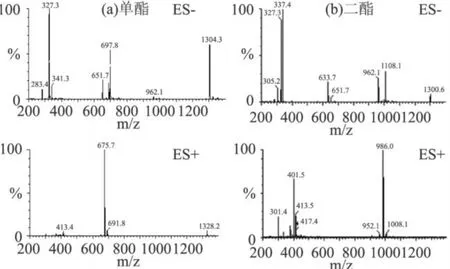
图3 DHA海藻糖酯的ESI-MS离子流谱
电喷雾电离是通过常压电离源,使待分析样品的分子质子化而生成单电荷离子[9-11]。图 3(a)为保留时间 8.27min的组分的MS图谱,DHA海藻糖单酯的相对分子质量为 652.35,ES-图谱上出现的 m/z值为 651.7的峰,是[M1-H]的质谱信号。其它 m/z值为 697.8、327.3、1304.3的峰分别为[M1+HCOO-]、[C22H31O2]-(DHA酸根)、[2M1-1]的质谱信号;而ES+图谱上出现的 m/z值为 675.7、691.8、1328.2的峰分别为[M1+Na]、[M1+K]、[2M1+Na]的质谱信号,因此证明了DHA海藻糖单酯的存在。图3(b)为保留时间 17.54min组分的MS图谱,DHA海藻糖二酯的相对分子质量为 962.58,ES-图谱上出现的 m/z值为 962.1、1008.1、327.3的峰分别为 [M2-H]、[M2+HCOO-]、掉下的 DHA酸根碎片的质谱信号,而ES+图谱上出现的 m/z值为 986.0的峰为[M2+Na]的质谱信号。因此,在酯交换反应过程中,固定化脂肪酶催化DHA乙酯和海藻糖酯交换反应生成的产物是DHA海藻糖单酯和二酯的混合物。由于在 C18反相色谱柱上极性大的组分先出峰,极性小的组分后出峰,DHA海藻糖单酯、DHA藻糖二酯的极性依次减弱,因此图2中DHA海藻糖单酯在DHA藻糖二酯前面出峰。
2.2 DHA海藻糖酯的硅胶柱层析分离及 TLC分析
由以上实验可知,合成反应液中含有DHA海藻糖单酯、DHA藻糖二酯以及其它杂质,将反应液经硅胶柱层析分离纯化,并用 T LC进行分析。图 4中1、2和 3分别是DHA海藻糖单酯、二酯和酶催化合成的反应液。DHA乙酯极性最弱,易随流动相迁移,因而出现在溶剂前沿;产物 DHA海藻糖二酯极性较弱,故 Rf值较大;单酯极性相对较大,故 Rf值较小,糖在该 TLC条件下不显色,由于单酯和二酯在硅胶板上分离效果较好,且均为一个点,可初步认定它们为纯物质。

图4 DHA海藻糖酯的TLC图谱
2.3 半制备型 HPLC纯化
为了得到纯度更高的DHA海藻糖单酯,将硅胶柱色谱分离纯化得到的 DHA海藻糖单酯收集液真空浓缩,除去溶剂后加入色谱甲醇溶解,经 0.45μm尼龙膜微滤后,用半制备型高效液相色谱进一步纯化。经过对流动相组成、洗脱速度和进样量等诸因素的优化,得出最佳色谱条件:流动相甲醇∶水 (v/v) =85∶15,流速 8.0mL/min,检测波长 205nm,进样量500μL,柱温 30℃。按上述半制备色谱条件洗脱,收集各峰,再经MS分析(结果略),最终确定保留时间18.0~21.0min的峰为单酯组分 (见图 5)。
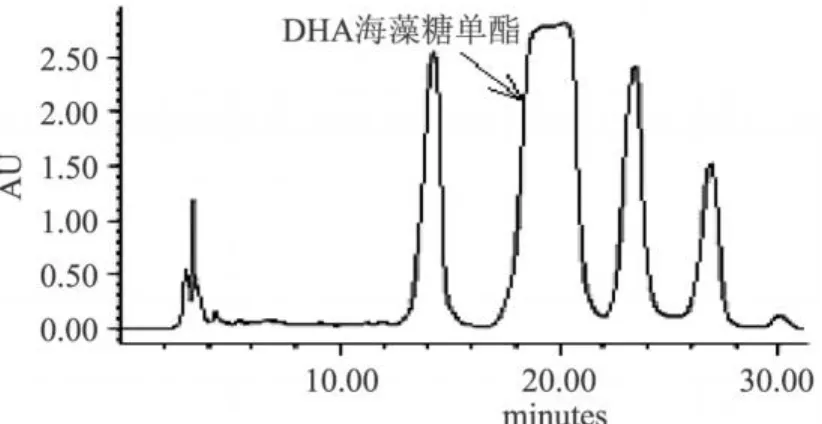
图5 样品的制备色谱分离图
2.4 DHA海藻糖单酯的鉴定
将半制备液相得到的纯品减压浓缩去除溶剂后,按 1.2.6中方法用分析型 HPLC进行纯度检测,图6中 t=7.024min处是DHA海藻糖单酯的洗脱峰,以面积归一化法测得产物纯度 >97%。
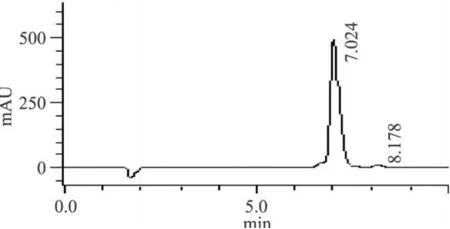
图6 DHA海藻糖单酯的高效液相色谱图
采用 NMR仪对纯品进行分子结构鉴定:1H NMR(500MHz,CD3OD)δ(μg/mL):5.36(12H,m), 5.08(1H,d,J=3.6Hz),5.06(1H,d,J=3.6Hz),4.35 (1H,d,J=11.9Hz),4.20(1H,dd,J=11.9,5.1Hz), 4.02(1H,m),3.80(4H,m),3.65(1H,dd,J=11.7, 5.1Hz),3.49(2H,m),3.34(2H,m),2.80(10H,m), 2.39(4H,s),2.07(2H,m),0.96(3H,t,J=7.0 Hz);13C NMR(500MHz,CD3OD)δ(μg/mL):95.542(C1), 73.476(C2),72.200(C3),71.699(C4),74.787(C5), 64.824(C6),95.406(C1′),73.512(C2′),72.228 (C3′),71.699(C4′),74.954(C5′),62.943(C6′), 174.993(C=O),133.09,130.55,129.745,129.745, 129.486,129.486,129.427,129.427,129.394,129.394, 129.217,128.474(all are-CH=CH-carbon),35.27, 26.859,26.859,26.802,26.728,26.728,24.04,21.776 (all are-CH2-carbon),14.941(CH3)。ESI-MS m/z 651.7[M-H]-,675.7[M+Na]+,691.8[M+K]+。结合MS分析结果,可确定该产品为 6-O-DHA海藻糖单酯。
3 结论
利用固定化脂肪酶在非水体系中对 DHA乙酯和海藻糖进行酯交换反应,经 HPLC/MS分析,合成的反应液中存在DHA海藻糖的单酯和二酯。将反应液进行减压浓缩,以薄层层析(T LC)作为辅助检测手段,用硅胶柱层析分离各个组分,分别得到 DHA海藻糖单酯和二酯粗品,利用半制备液相对其中的单酯样品进一步纯化,得到纯度大于 97%的纯品,经NMR鉴定,确认该物质为 6-O-DHA海藻糖单酯。
[1]Hung P,Kaku S,Yunoki S,et al.Dietary effect of EPA rich and DHA rich fish oils on the immune function of Sprague-Dawley rats[J].Biosci Biotechnol Biochem,1999,63(1):135-140.
[2]NordøyA,MarchioliR,Arnesen H,et al.N-3 polvunsaturated fatty acid and cardiovasoun diseases[J].Lipids,2001,36(S):S127-S129.
[3]Lim SY,Hoshiba J,Moriguchi T,et al.N-3 fatty acid deficiency induced by a modified artificial rearingmethod leads to poorer perfor mance in spatial learning tasks[J].Pediatr Res, 2005,58(4):741-748.
[4]Sturlan S,BaumgartnerM,Roth E,et al.Docosahexaenoic acid enhances aresenic trioxide-mediated apoptosis in arsenic trioxide resistant HL-60 cells[J].Blood,2003,101(12):4990-4997.
[5]BradleyM O,StindellC S,Anthony F H,et al.Tumor targeting by conjugation ofDHA to paclitaxel[J].J Control Release,2001, 74(1-3):233-236.
[6]Cotter,D A.Spores of the cellular slime mold Dictyostelium discoideum//Spores,Vol.V I(P Gerhardt,R N Costilow,H L Sadoff,eds).Washington:American SocMicrobiol,1975:61-72.
[7]Thevelein J M.Regulation of trehalose mobilization in fungi [J].Microbiol Rev,1984,48:42-59.
[8]Crowe J H,carpenter J f C L M.The role of vitrification in anhydrobiosis[J].Annu Rev Physiol,1998,60:73-103.
[9]董淮海,陶冠军,王林祥 .等高效液相色谱-电喷雾质谱联用法检测大豆异黄酮和皂苷[J].食品与生物技术,2002(4):415-419.
[10]Hsieh Y,Brisson J M,Wang G,et al.Simultaneous fast HPLC-MS/MS analysis ofdrug candidates and hydroxyl metabolites in plas ma[J].J Phar m Biomedical Anal,2003,33 (2):251-261.
[11]Ravanat J L,Duretz B,Guiller A,et al.Isotope dilution high performance liquid chromatography-electrospray tandem mass spectrometry assay for the measurement of 8-oxo-7,8-dihydro-2′-deoxyguanosine in biological samples.[J].J Chromatogr B, 1998,715:349-356.
Separation,purification and identification of docosahexaenoyl trehalose
SUN Yue-e,XI A W en-shui,CHEN Jie*
(State KeyLaboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Docosahexaenoyl treha lose(DHA)was synthes ized from docosahexaenoic ac id e thyl es te r and treha lose in te rt-butanol us ing imm ob ilized l ip ase as b ioca ta lys t.The p urifica tion and ana lys is m e thods we re inves tiga ted.The m ob ile p hase for the thin laye r chrom a tog rap hy(TLC)was e thyl ace ta te/m e thanol/wa te r(8.5/1/0.5,v/v/v)and iod ine was used for deve lopm ent.The s ilica ge l colum n chrom a tog rap hy cond itions we re as follows:g rad ient m ob ile p hases of hexane-isop rop anol-m e thanol5∶4∶1(v/v/v)and4∶4∶2(v/v/v)we re used in turn.The flow ra te was1.3mL/m in and the e luent of1tube/7m in was collec ted.The e luent of m ono-docosahexaenoyl treha lose was p urified w ith sem i-p rep a ra tive high p e rform ance liquid chrom a tog rap hy HPLC furthe r and then was identified by nuc lea rm agne tic resonance(NMR).
docosahexaenoic ac id(DHA);docosahexaenoyl treha lose; imm ob ilized lip ase;p urifica tion;NMR
TS201.2+3
A
1002-0306(2010)03-0200-04
非水相酶法催化酯交换反应是一个崭新的研究领域,与传统的化学合成法相比,酶催化合成具有反应条件温和、选择性高、副产物少等优点。大量研究证实,DHA为人体必需的多不饱和脂肪酸,具有抑制血小板凝聚、抗血栓、防治心脑血管疾病[1]、降低冠心病患者心肌梗塞死亡率[2]、促进智力发育等功能[3],此外,还具有抗肿瘤作用[4-5]。海藻糖是天然双糖中较稳定的二糖,无还原性,在食品中加热不发生美拉德反应。海藻糖作为一种天然二糖,它不仅具有其它低聚糖的特性,而且还具有独特的生物活性——对生物体和生物分子具有独特的非特异性保护作用[6]。研究表明,许多生物在胁迫环境 (如饥饿、高温、冷冻、干燥、高渗、辐射、有毒物质等)下表现出的抗逆耐受力与体内的海藻糖含量有直接的关系[7-8]。因此,通过酯交换反应把海藻糖和DHA结合成酯能同时发挥两种活性成分的生物学功能。本文主要研究了非水相脂肪酶催化合成DHA海藻糖酯的分离纯化方法和鉴定方法,即通过薄层层析、硅胶柱层析和半制备反相HPLC分离纯化目标产物,采用液相色谱-电喷雾离子阱质谱联用系统(LC-ESI-MS)及核磁共振技术对DHA海藻糖单酯进行鉴定。
2009-05-05 *通讯联系人
孙月娥(1973-),女,博士研究生,研究方向:食品脂质氧化。
国家自然科学基金课题(20401007)以及江苏省创新人才基金课题(BK2006503)支持。
