燕麦ACE抑制肽的分离纯化及其活性研究
2010-10-28王昌涛
王 双,王昌涛*,韩 扬
(1.北京工商大学 植物资源研究开发重点实验室,北京 100048;2.黑龙江中医药大学药学院,黑龙江 哈尔滨 150040)
燕麦ACE抑制肽的分离纯化及其活性研究
王 双1,2,王昌涛1,*,韩 扬1
(1.北京工商大学 植物资源研究开发重点实验室,北京 100048;2.黑龙江中医药大学药学院,黑龙江 哈尔滨 150040)
通过对3种大孔吸附树脂的比较,选择DA201-C树脂对燕麦ACE抑制肽进行纯化。纯化后的燕麦肽产物的ACE抑制率达到92.86%,利用HPLC测得纯化后燕麦ACE抑制肽的分子质量分布在240.10~1292.11D之间,这部分物质在整个纯化产物中占99.82%。采用SephadexG-15凝胶分离燕麦ACE抑制肽得到D峰,其IC50为0.103mg/mL,分子质量545D。采用大孔吸附树脂及凝胶层析法能够较好地分离纯化燕麦ACE抑制肽。
燕麦;ACE抑制肽;大孔吸附树脂;凝胶层析
燕麦是谷类食品中最好的全价营养食品之一,它富含蛋白质、矿物质、维生素及膳食纤维等现代食品营养素,具有多种保健功效[1]。ACE是血管紧张素转换酶,它在人体中广泛存在[2-3],具有收缩血管的作用,可引起血压升高,而食品蛋白来源的ACE抑制肽可以通过与ACE结合,从而起到降压作用[4-5]。到目前为止所有报道的ACE抑制肽多为2~15肽,其分子质量在200~1500D之间[6],关于燕麦ACE抑制肽的研究目前大多集中于提取工艺的优化,而分离纯化的相关报道较为少见且研究不够深入,同时缺少关于纯化产物活性的相关研究。本实验以燕麦为植物蛋白源,采用超声辅助酶法制备ACE活性肽,然后应用大孔吸附树脂及凝胶层析法对燕麦ACE抑制肽进行分离纯化,去除杂质,并测定纯化后产物的分子质量分布状态及纯化前后ACE抑制活性的变化,旨在为燕麦ACE抑制肽的研究与开发提供依据。
1 材料与方法
1.1 材料与试剂
燕麦麸皮 河北省张家口农科院燕麦研究所;Angiotensin converting enzyme(ACE)(活力 0.1U/mg)、N-hippuryl-his-leu hydrate(HHL) Sigma公司;碱性蛋白酶(3AU/g) 丹麦诺维信酶制剂公司;大孔吸附树脂(DA201-C) 江苏省江阴市有机化工厂;Amberlite(XAD1600)树脂、Amberlite(XAD7HP)树脂 北京慧德易公司;牛血清蛋白、VB12、氧化性谷胱甘肽 北京拜尔迪生物公司;乙腈(色谱纯)、三氟乙酸(色谱纯)Fisher公司;SephadexG-15 Fine Pharmacia公司。
1.2 仪器与设备
JXD-02型超声波电源(28、40、50、135kHz) 北京金星超声波设备技术有限公司;DCW-3506型低温恒温槽 宁波新芝生物科技股份有限公司;DSHZ-300型水浴恒温振荡器 江苏太仓市实验设备厂;紫外-可见分光光度计(T6新世纪) 北京普析通用仪器有限公司;ALPHA2-4/LSC型冷冻干燥机 德国Christ公司;KDN-2C型定氮仪 上海纤检仪器有限公司;柱层析系统(大孔树脂用层析柱(φ2.5cm×60cm)、DHL-A电脑恒流泵、DBS-100电脑全自动部分收集器) 上海沪西仪器厂有限公司;L-8900氨基酸分析仪 日本Hitachi公司;高效液相色谱仪 美国Waters科技有限公司;凝胶层析系统(层析柱φ 1.5cm×60cm、DHL-A电脑恒流泵、DBS-100电脑全自动部分收集器、IHID-2核酸蛋白检测仪记录仪) 上海沪西仪器厂有限公司。
1.3 方法
1.3.1 超声波辅助酶法制备燕麦ACE抑制肽
称取一定量燕麦麸皮(20~60目过筛,粒径在0.250~0.850mm间),按料水比1:10(g/mL)配制,放入塑料杯容器中,用1mol/L NaOH将燕麦麸皮液调pH11,利用超声波对燕麦麸皮液进行预处理28.4min[7](水浴温度55.05℃,超声波频率50kHz,超声波功率190.08W),测定pH值(测定值为8.2,与Alcalase酶反应的最适pH值基本一致),之后直接按酶与底物比(E/S)5%添加Alcalase酶,继续在水浴中反应2.25h[7],随后在85℃条件灭酶10min。之后在12000r/min离心5min,所得上清液(尽量除去离心液表面的油脂)进行抽滤,所得酶解液进行冷冻干燥,备用。
1.3.2 检测方法
固体蛋白含量的测定方法:采用凯氏定氮法测定固体蛋白含量;多肽含量的测定方法[8]:采用Folin-酚法测定多肽含量;ACE抑制活性体外检测方法[9-10]:马尿酸法测定ACE体外抑制活性;水分含量的测定方法:采用105℃质量恒定法(GB5497—85《粮食、油料检验水分测定法》);粗灰分含量测定方法:取10mg已经干燥后的样品于质量恒定的瓷坩埚中,然后于电炉上加热炭化,炭化完全后于马弗炉中550℃灼烧至残渣呈浅灰色具质量恒定为止,冷却后称量,计算;总糖含量的测定方法[11]:采用苯酚-硫酸法测定总糖含量。
1.3.3 大孔吸附树脂纯化燕麦ACE抑制肽[12]
1.3.3.1 树脂的选择

表1 3种大孔树脂的型号及物理参数Table 1 Model and physical parameters of 3 kinds of macroporous resins
分别对树脂的极性、比表面积和平均孔径进行考察,选择大孔吸附树脂DA201-C、Amberlite XAD1600、Amberlite XAD7HP进行静态吸附试验,比较这3种大孔吸附的纯化效果,3种大孔树脂的参数见表1。
1.3.3.2 树脂的活化及预处理
首先使用2BV无水乙醇浸泡树脂24h,使其充分溶胀,然后将树脂装柱,用8~10BV无水乙醇以3~4BV/h的流速通过树脂层,至流出液在波长220nm处吸光度小于0.1(以无水乙醇为空白对照),乙醇处理后,以6~8BV/h流速的去离子水置换出树脂中的乙醇,直至流出液无乙醇味即可投入使用。
1.3.3.3 静态吸附实验筛选树脂
于250mL具塞锥形瓶中加入10g预先处理过的树脂,再加入50mL 10mg/mL酶解产物溶液,调pH5,放入25℃恒温水浴摇床中振荡(150次/min)。于20、40、60、80、95、110、125、140、160、180、210、240min分别取样,采用Folin-酚法测定其多肽含量,分别计算3种大孔吸附树脂的吸附率。

1.3.3.4 动态吸附及解吸实验
柱条件:色谱柱φ2.5cm×60cm,床体积200mL,树脂DA201-C,上样量200mL,上样流速1.6mL/min,去离子水冲洗流速2mL/min,乙醇洗脱流速2mL/min,定时收集5min/管。
操作方法:以一定流速上样后,先用去离子水洗涤层析柱,将未吸附的酶解物去除,同时在上样及水洗过程中定时收集层析柱流下的液体(5min/管),分别测量每根试管的电导率,糖含量(苯酚-硫酸法)和肽的吸光度(波长220nm处),当水洗液的电导率与水几乎一致或不再变化时,再用一定体积分数的乙醇洗脱,收集洗脱液(5min/管),再合并收集洗脱峰液,浓缩去除乙醇,冷冻干燥,得到纯度较高的燕麦肽,检测其成分。

1.3.3.5 利用高效液相色谱仪测定纯化前后燕麦多肽分子质量分布
色谱条件:色谱柱TsK gel 2000 SWXL 300mm×7.8mm,流动相:乙腈-水-三氟乙酸=30:70:0.1(V/V),检测波长UV280nm,流速1mL/min,柱温30℃。样品制备:以流动相为溶剂配制质量浓度5mg/mL的样品溶液,再用微孔膜(0.45μm)过滤后供进样。标准样品:将牛血清蛋白(Mw67000)、VB12(Mw1335)、氧化型谷胱甘肽(Mw614)配成混标,每种物质含量均为5mg/mL。
标准曲线:将3种标准样品按5mg/mL配制,按照上述色谱条件制作标准曲线,结果见图1。

图1 波长280nm处3种标准样品的HPLC图谱Fig.1 HPLC profiles of three standard samples at 280 nm
根据凝胶渗透层析原理,分子质量大的物质先被洗脱下来,从图1中可以看到洗脱峰出现时所对应的洗脱时间分别为5.514、9.638、10.426min,以分子质量对数值对洗脱时间作图,采用最小二乘法,求出直线的回归方程:y=-0.4141x+7.1103(x代表洗脱时间,y代表分子质量对数),其回归系数R2=0.9999。
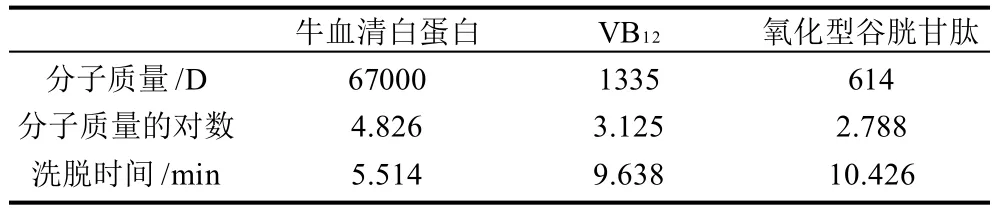
表2 标准物质的分子质量与洗脱时间Table 2 Molecular mass and elution time of standard samples
1.3.4 纯化前酶解液的预处理工艺
将按1.3.1节方法制备的酶解液冷却后,按E/S为1%添加β-葡聚糖酶,60℃水浴中反应30min,80℃下灭酶5min;待酶解液冷却后调pH4.5(糖化酶最适pH值),再按E/S为1%添加糖化酶,60℃水浴中继续反应3h,80℃下灭酶10min。之后在12000r/min条件下离心5min,所得上清液(尽量除去离心液表面上的油脂)进行抽滤。
1.3.5 凝胶层析纯化法[13-14]
1.3.5.1 凝胶层析法
采用葡聚糖凝胶SephadexG-15对纯化后燕麦ACE抑制肽进行分级分离,用蒸馏水作为洗脱剂进行洗脱,洗脱组分分管收集,3mL/管,分峰合并收集,浓缩后进行冷冻干燥,备用。凝胶柱条件:色谱柱φ 1.5cm×60cm,上样质量浓度50mg/mL,上样量3mL,上样流速:0.6mL/min,定时收集:5min/管。样品的测定:用紫外分光光度计在波长280nm处逐管测定吸光度A280nm。
1.3.5.2 ACE抑制肽对pH值的稳定性
配制pH2.0~10.0的系列缓冲液:pH3.5~5.5,采用0.1mol/L醋酸钠缓冲液;pH6.0~7.5 0.1mol/L磷酸盐缓冲液;pH8.0~10.0 0.1mol/L碳酸盐缓冲液。ACE抑制肽分别与不同pH值缓冲液混合,于4℃条件下处理12h后,再在pH8.3 0.1mol/L硼酸缓冲液(ACE抑制活性检测的最适pH值)中处理12h,再检测其ACE抑制活性,与原测值进行比较,得到相对活性,评估ACE抑制肽对pH值的稳定性。
1.3.5.3 ACE抑制肽对温度的稳定性
在最适pH值条件下,将ACE抑制肽在不同的温度下(25~95℃)保温30min后,迅速冷却,再检测其ACE抑制活性,与原测值进行比较,得到相对活性,评估ACE抑制肽在不同温度下的稳定性。
1.3.5.4 ACE抑制肽的体外消化实验[15-17]
分别称取5mg胃蛋白酶/胰蛋白酶溶于pH2.0 0.1mol/L KCl-HCl缓冲液/pH8.0 0.1mol/L磷酸缓冲液)中,定容至100mL,配制成0.05mg/mL胃蛋白酶/胰蛋白酶溶液。称取50mg(多肽含量)分离峰冻干粉溶于5mL 0.05mg/mL的胃蛋白酶/胰蛋白酶溶液中(E/S=1:200),于37℃水浴振荡反应3~4h。随后于100℃水浴中加热5min灭酶终止反应。调节反应液pH8.3(胰蛋白酶不调pH值),以12000r/min离心10min,上清液用于测定ACE抑制活性。
另取2mL经胃蛋白酶消化处理后的溶液,加入2mL 0.05mg/mL的胰蛋白酶溶液在37℃水浴振荡反应4h(E/S=1:200)。随后于100℃水浴中加热5min灭酶终止反应,以12000r/min离心10min,上清液用于测定ACE抑制活性。
2 结果与分析
2.1 树脂的筛选
2.1.1 大孔吸附树脂DA201-C、XAD1600和XAD7HP静态吸附实验
大孔吸附树脂DA201-C、XAD1600和XAD7HP在静态吸附过程中对燕麦酶解产物的吸附率随时间的变化规律见图2。
由图2可知,在静态吸附过程中,3种大孔吸附树脂在最初的60min左右吸附率的增加均十分迅速,其中大孔吸附树脂DA201-C在60min时吸附率达到64.6%,此后的增加趋于平缓,到95min时达到吸附饱和,吸附率为66.5%,此后吸附处于动态平衡,吸附率不再增加;大孔吸附树脂XAD1600在60min时吸附率达到39.8%,此后的增加趋于平缓,到140min时达到吸附饱和,吸附率为47.8%,此后吸附处于动态平衡,吸附率不再增加;大孔吸附树脂XAD7HP在40min时吸附率达到34.3%,此后的增加趋于平缓,到125min时达到吸附饱和,吸附率为35.7%,此后吸附处于动态平衡,吸附率不再增加。

图2 pH5时大孔吸附树脂DA201-C、XAD1600和XAD7HP静态吸附率随时间的变化Fig.2 Static absorption rate of macroporous resins DA201-C, XAD1600 and XAD7HP at pH 5 as the extension of time
对3种大孔吸附树脂的静态吸附性能进行比较,其最大吸附率及达到最大值的时间见表3。
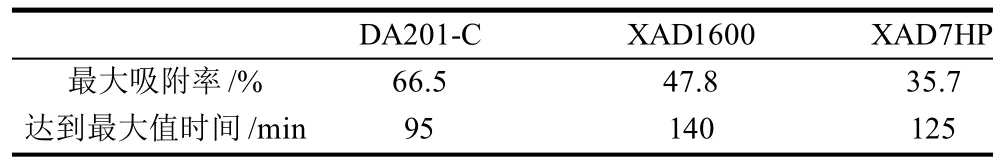
表3 3种树脂静态吸附实验最大吸附率Table 3 Maximum adsorption rates of three kinds of resins
由表3可知大孔吸附树脂DA201-C的最大吸附率最大,达到66.5%,依次是XAD1600 47.8%,最后是XAD7HP 35.7%,可见DA201-C吸附率远远高于XAD1600和XAD7HP。另外比较达到最大吸附率的时间可知,DA201-C在95min即达到最大值,吸附效率远远高于另外两种树脂,因此大孔吸附树脂DA201-C更适合燕麦ACE抑制肽的纯化。
2.1.2 酶解液的pH值对动态吸附率的影响
酶解产物中的肽在溶液中的伸展方式会随pH值的变化而不同,肽与大孔吸附树脂间是通过氢键或范德华力相互作用结合的,这也会受pH值影响,因此,上样时酶解液的pH值会对动态吸附率产生较大影响,从图3可以明显看出这一点。
从图3可以看出,在酶解液pH5时上样,树脂的吸附率最高,因此宜将酶解液调至pH5,进行动态吸附实验。
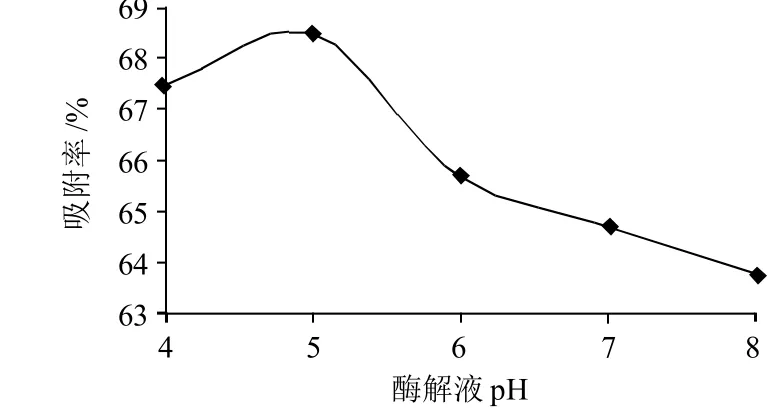
图3 酶解液的pH值对动态吸附率的影响Fig.3 Effect of hydrolysate pH on dynamic adsorption rate of macroporous resin
2.2 未进行预处理酶解液动态吸附及解吸实验
2.2.1 纯化前后酶解产物的成分及ACE抑制率的比较将纯化前后的酶解产物的冻干粉分别配制为多肽含量5mg/mL的水溶液,测定其蛋白质含量、多糖含量及无机盐等其他成分,并比较纯化前后酶解产物的ACE抑制率,结果见表4。
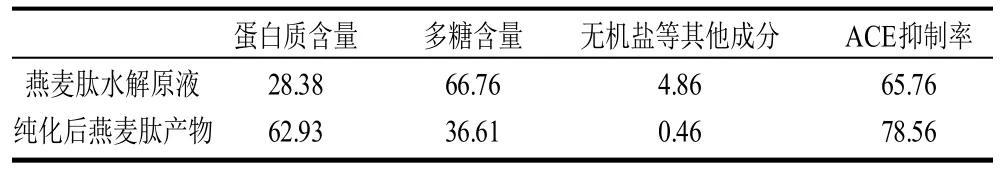
表4 纯化前后成分及ACE抑制率的比较Table 4 Comparison on compositions of ACE inhibitory peptide before and after purification %
从表4可以看出,通过大孔吸附树脂DA201-C的纯化可起到脱糖脱盐的效果,纯化前酶解产物中蛋白质含量仅为28.38%,但多糖含量高达66.76%;而纯化后多肽含量提高了一倍多,而糖含量下降了50%,说明DA201-C有较好的脱糖效果。另外看到纯化前后无机盐等杂质的含量有大幅下降,证明DA201-C也有较好的脱盐效果。虽然DA201-C有较好的纯化效果,但是还要看到,纯化后多糖成分仍占到产物含量的近40%,含有较多多糖成分的ACE抑制肽会为后续分离带来很大不便,因此应对纯化前燕麦肽酶解产物进行预处理,去除其中一部分多糖成分。
另外,纯化前后燕麦多肽的ACE抑制率有了较大提高,由于这主要和大孔吸附树脂DA201-C的纯化密切相关,纯化过程去掉了燕麦多肽中杂质的干扰,同时也证明纯度较高的燕麦多肽具有较好ACE抑制活性,为后续分离提供依据。
2.2.2 HPLC测定纯化后燕麦肽的分子质量分布
分子质量大小是检验ACE抑制肽的一个指标,应用高效液相色谱(HPLC)测定纯化后产物的分子质量分布状态,结果如图4所示。

图4 纯化后燕麦多肽的分子质量分布Fig.4 Molecular weight distribution of purified peptides from oat
从图4可以看出,纯化产物中主要包括3个组分峰,洗脱时间分别出现在9.373、10.114、11.463min,并根据标准曲线方程得出各峰的对应分子质量为1693.95、835.80、230.94D,根据峰面积计算可知这3种物质分别占到纯化产物中的30.82%、55.96%、13.20%,三者共占纯化产物的99.7%。但是ACE抑制肽一般分子质量为200~1500D,说明纯化产物的分子质量值偏大,不适合ACE抑制肽的后续分离。但是纯化产物的分子质量全部小于2000D,表明大孔吸附树脂DA201-C对小分子肽的吸附作用很好。
2.3 对纯化前酶解液进行预处理后动态吸附及解吸实验
2.3.1 对纯化前酶解液进行预处理
通过以上实验可以初步证明燕麦中的多糖成分与蛋白成分可能是结合在一起的,形成了类似糖蛋白的结构,从而导致纯化后产物中仍有一定的多糖,故考虑可以对纯化前酶解液进行预处理,将结合的多糖成分酶解,酶解液中游离的多糖成分不会被大孔吸附树脂吸附,可能会进一步改善纯化效果,因此在蛋白酶处理后利用β-葡聚糖酶和糖化酶酶解燕麦酶解液中的多糖成分。
2.3.2 纯化前后酶解产物的成分及ACE抑制率的比较
将纯化前后的酶解产物的冻干粉分别配制为多肽含量5mg/mL的水溶液,测定其蛋白质含量、多糖含量及无机盐等其他成分,并比较纯化前后酶解产物的ACE 抑制率,结果见表5。
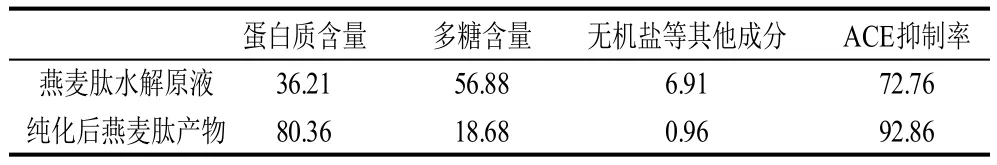
表5 纯化前后成分及ACE抑制率的比较Table 5 Comparison of ACE inhibitory rates of peptide before and after purification %
从表5可以看出,经过对燕麦酶解液的糖化酶处理,使纯化效果得到很大改善,其燕麦多肽蛋白含量高达80.36%,多糖成分下降至18.68%,无机盐等成分下降至0.96%。与表4结果相比,其酶解原液的蛋白质含量有的提高,多糖含量有所降低,这是由于酶解原液中加入β-葡聚糖酶和糖化酶,而酶属于蛋白质;另外经过β-葡聚糖酶和糖化酶的酶解,酶解原液糖含量下降。实验证明经过β-葡聚糖酶和糖化酶的处理,纯化效果有显著提高,并进一步证明燕麦中蛋白质和多糖可能是以一种结合物形式存在的。
另外,纯化后燕麦多肽的ACE抑制率比燕麦肽水解原液提高很多,这说明了去除多糖等杂质后,ACE抑制肽的浓度大大提高,故其ACE抑制功效体现更加明显,表明纯化后的燕麦多肽是较好的ACE抑制肽源。
2.3.3 酶解原液的动态吸附及水洗过程
酶解原液上样后先用去离子水洗涤层析柱,同时在上样及水洗过程中定时收集层析柱流下的液体(5min/管),分别测量每根试管的电导率,糖含量和肽的吸光度(波长220nm处),整个上样过程变化如图5所示。
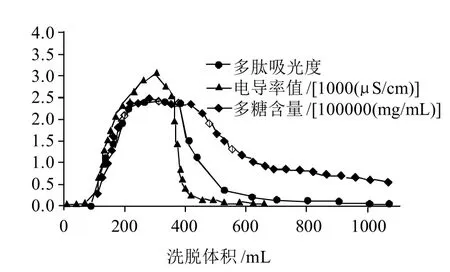
图5 酶解产物的动态吸附脱盐和脱糖曲线Fig.5 Dynamic adsorption curves of hydrolysates for desalination and the removal of sugar
从图5可以看出,当洗脱体积在0~100mL时,多肽吸光度非常低,说明此时为树脂吸附多肽阶段。此后,吸光度开始迅速上升,说明树脂吸附量已经饱和。而电导率值(反映盐含量)和糖含量在洗脱体积约为300mL处达到最大值。而未被吸附的肽的吸光度的出峰位置则较靠后且持续时间较长,在洗脱体积超过1000mL(5~6BV)后它们的变化都趋于平缓。
2.3.4 树脂解吸过程
应用75%和25%乙醇对燕麦多肽进行解吸,解吸方法见1.3.3.4节。洗脱过程中5min/管收集解吸液,随后测量解吸液在220nm条件下的吸光度,确定解吸液中多肽的出现时间,洗脱图谱见图6、7。

图6 75%乙醇洗脱图Fig.6 Elution profile of ACE inhibitory peptide by 75% ethanol elution

图7 25%乙醇洗脱图Fig.7 Elution profile of ACE inhibitory peptide by 25% ethanol elution
从图6、7可以看出,75%乙醇解吸时曲线无规律性,但洗脱剂消耗较小;而25%乙醇洗脱的数据有规律性,峰值出现明显,但洗脱剂消耗偏大,影响生产效率。计算解吸率可知,75%乙醇解吸率为75.46%,25%乙醇解吸率为70.52%,75%乙醇解吸率较高,可以减少酶解液损失,因此选择75%乙醇进行解吸。
2.3.5 纯化前后酶解产物氨基酸成分分析
将纯化前后的酶解产物的冻干粉进行氨基酸成分分析,比较纯化前后各种氨基酸的含量变化,分析其对ACE抑制率变化的影响,进一步验证纯化效果,结果见表6。

表6 纯化前后酶解产物的氨基酸成分比较Table 6 Amino acid compositions of hydrolysates before and after purification
从表6可以看出,纯化后燕麦ACE抑制肽的疏水性氨基酸、芳香族氨基酸和支链氨基酸残基含量均高于纯化前酶解产物,最重要的是脯氨酸的含量纯化后大幅上升,该氨基酸对ACE抑制活性的贡献很大,故从氨基酸含量的变化上证明了纯化后的酶解物有利于ACE抑制活性的提高。此外,纯化后ACE抑制肽的必需氨基酸含量高于纯化前产物,表明纯化过程使燕麦的营养价值得到了很大的提高。
2.3.6 HPLC测定纯化后燕麦ACE抑制肽的分子质量分布
应用高效液相色谱仪对1.3.4节方法制备的燕麦酶解液的纯化产物的分子质量分布状态应进行分析,结果见图8。
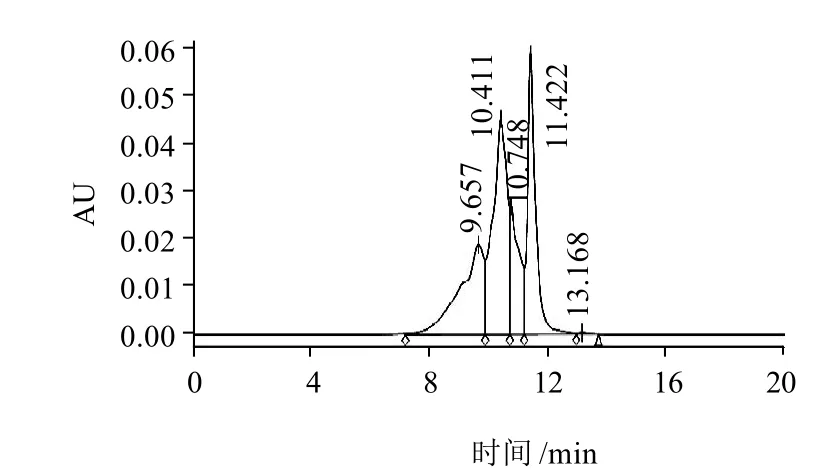
图8 纯化后燕麦ACE抑制肽的的分子质量分布Fig.8 Molecular mass distribution of purified ACE inhibitory peptides
如图8所示,纯化产物中主要包括4个组分峰,洗脱时间分别出现在9.657、10.411、10.748、11.422min,并根据标准曲线方程计算出各峰的对应分子质量为1292.11、629.65、456.67、240.10D,根据峰面积计算可知这4种物质分别占到纯化产物中的25.08%、35.38%、13.39%、25.96%,四者共占纯化产物的99.82%。综上所述,纯化后燕麦ACE抑制肽的分子质量分布在240.10~1292.11D之间,这部分物质在整个纯化产物中占99.82%,其中分子质量629.65D的组分在纯化产物中含量最高达到35.38%,以上结果表明,经过对多糖的酶解后,再利用大孔吸附树脂DA201-C纯化燕麦酶解产物,其纯化效果较好,分子质量范围在200~1500D之间,为后续分离纯化提供了较好的多肽源。
2.4 凝胶层析的研究
2.4.1 Sephadex G-15分离燕麦ACE抑制肽所得不同组分的ACE抑制活性
根据1.3.5.1节凝胶层析法混合肽被分成5个组分,各组分冷冻干燥后,称取一定量各组分峰冻干粉用蒸馏水配成多肽含量为0.5mg/mL溶液用于ACE抑制活性的测定,结果见图9。

图9 不同SephadexG-15分离组分的ACE抑制活性Fig.9 ACE inhibitory activities of different factions using SephadexG-15 separation
从图9可以看到,纯化后燕麦多肽产物经过葡聚糖凝胶SephadexG-15分离所得各组分A、B、C、D、E均具有ACE抑制活性,其ACE抑制活性分别为50.15%、56.98%、70.31%、86.42%、78.58%,其中D组分的ACE抑制活性最高,而A和B的ACE抑制活性较低,故制备收集D组分峰产物,其IC50为0.103mg/mL,其分子质量约为545D,作为后续实验材料。
2.4.2 D组分ACE抑制肽对pH值的稳定性
按照1.3.5.2节方法,检测D组分峰对pH值的稳定性,结果见图1 0。

图10 ACE抑制肽(D组分峰)在不同pH值中的稳定性Fig.10 Stability of ACE inhibitory peptide (fraction D) at different pH levels
从图10可以看出,ACE抑制活性受pH值影响并不大,D组分ACE抑制肽对pH值具有较好的稳定性,酸性条件下ACE抑制活性损失大于碱性条件,而中性pH值下ACE抑制活性最高。
2.4.3 D组分ACE抑制肽对温度的稳定性
按照1.3.5.3节方法,检测D组分峰的温度稳定性,结果见图11。
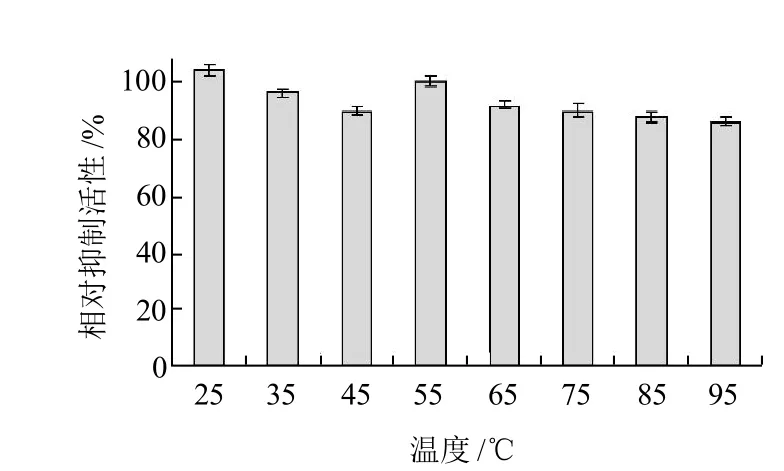
图11 ACE抑制肽(D组分峰)在不同温度下的稳定性Fig.11 Stability of ACE inhibitory peptide (fraction D) at different temperatures
从图11可以看出,经各种温度处理后,D组分峰的ACE抑制活性几乎没有损失,均保留了大于90%的ACE抑制活性,这说明D组分峰的ACE抑制活性在不同温度中具有优越的稳定性。
2.4.4 D组分ACE抑制肽的体外消化实验
按照1.3.5.4节和1.3.5.5节方法测定消化酶处理前和处理后水解物IC50值的变化以评价水解物的消化稳定性,结果见表7。

表7 消化酶处理对ACE抑制肽(D组分峰)的ACE抑制活性的影响Table 7 Effect of treatment with digestive enzyme on activity of ACE inhibitory peptide (fraction D)
从表7可以看出,D组分峰经过胃肠道消化酶处理后仍然具有很高的活性,说明其对消化酶的水解具有一定的抗性,并且经过消化酶水解后还能够释放出新的ACE抑制肽。由于胃蛋白酶加胰蛋白酶的处理方式与食物在体内消化过程类似,进而说明了燕麦来源的ACE抑制肽具有在胃肠道中吸收,然后进入血液循环的可能性,口服这种活性肽有可能在人体发挥较好的降血压作用。
3 结 论
应用大孔吸附树脂对燕麦ACE抑制肽进行分离纯化,并对纯化产物的分子质量分布状态及其活性进行研究。研究发现大孔吸附树脂DA201-C对燕麦ACE抑制肽的纯化效果较好,纯化前使用β-葡聚糖酶和糖化酶对酶解液进行预处理,可以提高纯化效果,纯化后产物的ACE抑制率高于纯化前产物,并且纯化后燕麦ACE抑制肽的疏水性氨基酸、芳香族氨基酸和支链氨基酸残基含量均高于纯化前酶解产物,纯化后ACE抑制肽的分子质量分布在240.10~1292.11D之间,全部小于1500D,可见其是较好的后续分离多肽源。通过利用葡聚糖凝胶SephadexG-15对纯化后燕麦多肽进行分离得到D组分,其IC50为0.103mg/mL,分子质量为545D,具有较强的ACE抑制活性、pH值稳定性和温度稳定性,且在体外对消化酶体现出一定的抗性,具有口服降压的可能,因此本实验为燕麦ACE抑制肽作为降压有效成分的研究提供了参考和依据。
[1] 黄艾祥, 肖蓉. 燕麦及其营养食品的研究开发[J]. 粮食与饲料工业,2000(9): 49-50.
[2] 吴建平, 丁霄霖. 食品蛋白质降血压肽的研究进展[J]. 中国粮油学报, 1998, 13(5): 10-14.
[3] 赵海珍, 陆兆新, 刘战民. 天然食品来源的血管紧张素转换酶抑制肽的研究进展[J]. 中国生化药物杂志, 2004, 25(5): 315-317.
[4] BYUN H G, KIM S K. Structure and activity of angiotensin I converting enzyme inhibitory peptides derived from Alaskan pollack skin[J]. Journal of Biochemistry and Molecular Biology, 2002, 35(2): 239-243.
[5] NAKAMURA Y, MASUDA O, TAKANO T. Decrease of tissue angiotensin I -converting enzyme activity upon feeding sour milk in spontaneous hypertensive rates[J]. Bioscience Biotechnology and Biochemistry,1996, 60(3): 488-489.
[6] MORIGIWA A, KITABATAKE A, FUJIMOTO Y, et al. Angiotensin converting enzyme-inhibitory triterpenes from G lucidum[J]. Chemical Pharmaceutical Bulletin, 1986, 34(7): 3025-3028.
[7] 韩扬, 何聪芬, 董银卯, 等. 响应面法优化超声波辅助酶法制备燕麦ACE抑制肽的工艺研究[J]. 食品科学, 2009, 30(22): 44-49.
[8] 余冰宾. 生物化学实验指导[M]. 北京: 清华大学出版社, 2004: 54-62; 133-136.
[9] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20: 1673-1648.
[10] WU J P, DING X L. Characterization of inhibition and stability of soyprotein-derived angiotensin Ⅰ-converting enzyme inhibitory peptides[J]. Food Research International, 2002, 35: 367-375.
[11] 李宝良, 李书剑. 香菇多糖苯酚试剂测定研究[J]. 中国卫生检验杂志, 2005, 15(11): 1329-1330.
[12] 何炳林, 黄强. 离子交换与吸附树脂[M]. 上海: 上海科技教育出版社, 1995.
[13] 金哲洙, 蔡英姬, 金京玲. 抗真菌蛋白质的分离纯化[J]. 中国生物制品学杂志, 2000, 13(l): 30-32.
[14] 王丰, 梅子青, 周秋丽, 等. 鹿茸多肽的分离纯化及药理活性[J]. 吉林大学学报: 理学版, 2003, 41(l): 111-114.
[15] LECLERC P L, GAUTHIER S F, BACHELARD H, et al. Antihypertensive activity of casein-enriched milk fermented by Lactobacillus helveticus[J]. RTICLE International Dairy Journal, 2002, 12(12): 995-1004.
[16] VERMEIRSSEN V, CAMP J V, VERTRAETE W. Optimisation and validation of an angiotensin-converting enzyme inhibition assay for the screening of bioactive peptides[J]. Journal of Biochemical and Biophysical Methods, 2002, 51: 75-87.
[17] PARROT S, DEGRAEVE P, CURIA C, et al. In vitro study on digestion of peptides in Emmental cheese: analytical evaluation and influence on angiotensinⅠconverting enzyme inhibitory peptides[J].Nahrung/Food, 2003, 47(2): 87-94.
Separation, Purification and Activity of ACE Inhibitory Peptides from Oat
WANG Shuang1,2,WANG Chang-tao1,*,HAN Yang1
(1. Beijing Technology and Business University, Beijing Key Laboratory of Plant Resources Research and Development, Beijing 100048, China;2. College of Pharmaceutical, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
Through comparing three kinds of macroporous resins, DA201-C resin was selected to purify ACE inhibitory peptides from oat. The ACE inhibition rate of purified peptide from oat was 92.86%. The molecular mass of HPLC-purified oat ACE inhibitory peptides was the range of 240.10-1292.11 D. SephadexG-15 gel was used to purify ACE inhibitory peptides to obtain a fraction D with IC50 of 0.103 mg/mL and molecular weight of 545 D. Results indicated that macroporous resin and gel filtration chromatography could better purify ACE inhibitory peptides from oat.
oat; ACE inhibitory peptide;macroporous resin; gel filtration chromatography
TS201.1
A
1002-6630(2010)24-0222-08
2010-08-26
北京市科技新星项目(2008B08)
王双(1985—),女,硕士研究生,研究方向为生药学。E-mail:wangs1985@126.com
王昌涛(1975—),男,副教授,博士,研究方向为生物化工。E-mail:wangct@th.btbu.edu
