光甘草定的制备及其对蘑菇酪氨酸酶的抑制作用
2010-10-28骆从艳慕春海王园姬李超鹏陈文
骆从艳,慕春海,王园姬,李超鹏,陈文
(石河子大学药学院/新疆特种植物药资源重点实验室,石河子832002)
光甘草定的制备及其对蘑菇酪氨酸酶的抑制作用
骆从艳,慕春海,王园姬,李超鹏,陈文
(石河子大学药学院/新疆特种植物药资源重点实验室,石河子832002)
分别选用单酚酶与二酚酶为底物,评价硅胶柱层析(CHCl3/MeOH梯度洗脱)分离得到的光甘草定对蘑菇酪氨酸酶活性的影响。结果表明:实验室所分离得到的光甘草定纯度为85%以上,其对蘑菇酪氨酸酶单酚酶和二酚酶的活性均有抑制作用,导致酶活力下降50%的抑制剂浓度(IC50)分别为1.28μmol/L和1.56μmol/L,且Lineweaver-Burk图显示,光甘草定对酪氨酸酶二酚酶活性的抑制作用表现为竞争型抑制。光甘草定发挥着显著的抑制酪氨酸酶活性,说明光甘草定可以通过抑制黑色素生成的限速酶-酪氨酸酶达到美白肌肤之功效。
光甘草定;酪氨酸酶;单酚酶;二酚酶;抑制机理
Abstract:In the present paper,monophenolase and diphenolase are chosen as substrate respectively.The inhibition of tyrosinase is investigated by glabridin which is isolated by the gel silica column chromatography(gradient elution by CHCl3/MeOH).The result was that the purity of glabridin was above 85%.It could inhibit both monophenolase activity and diphenolase activity of the enzyme,IC50 values were 1.28 and 1.56 μmol/L respectively,the kinetic analysis showed that the inhibition of glabridin on the diphenolase activity of the enzyme was reversible and belonged to competitive-type.Glabridin has noticeable inhibitory effects on the tyrosinase,and it has the potential to be further developed into effective skin whitening agent.
Key words:glabridin;tyrosinase;monophenolase;diphenolase;inhibition mechanism
酪氨酸酶(tyrosinase)是皮肤黑色素生物合成的关键酶,它有两个主要功能:作为单酚酶,羟基化单酚生成邻二酚;作为二酚酶,氧化邻二酚生成邻醌[1]。抑制酪氨酸酶活性,可改善皮肤中色素细胞的酪氨酸酶的代谢,阻止色素沉着的形成。天然产物化妆品的开发越来越受到国内外厂商的重视。甘草被称为“百草之王”,甘草中黄酮类化合物具有抗炎、抗溃疡、抗氧化等作用[2],光甘草定是光果甘草中的一种特有的异黄酮成分,目前国内外研究显示光甘草定在调血脂和降血压方面具有很明显的效果[3];除此之外,它在美容行业也受到越来越多的关注,Yokota等[4]的研究证明了光甘草定可以降低B16鼠黑素瘤细胞中 T1和 T3酪氨酸酶同工酶的活性,0.5%光甘草定可以抑制紫外线诱导的豚鼠皮肤色素和红斑的生成。在国内外研究中,尚无光甘草定对蘑菇酪氨酸酶活性影响的报道。
由于不同产地的光果甘草中光甘草定含量不同[5],本实验目的是检测新疆产光果甘草中光甘草定的含量,并对其进行分离。利用分离得到的光甘草定来评价其对酪氨酸酶活性的抑制作用,并探讨抑制机理,以期为皮肤美白剂及新疆光果甘草资源的深入开发提供有价值的参考。
1 材料与方法
1.1 材料
光甘草定对照品(购于成都普思生物科技有限公司,纯度为 99.07%);甲醇、乙腈(色谱级);酪氨酸酶(Worthington公司原装,1 930 U/mg);左旋多巴(L-DOPA)、L-酪氨酸(Novo公司);二甲基亚砜(DMSO)、磷酸二氢钠及磷酸氢二钠等均为国产分析纯;光甘草定(本实验室分离,纯度85%以上)
美国Waters 600高效液相色谱仪(Waters Delta 600泵,Waters 2996型DAD检测器);UV-2401型紫外分光光度计(日本岛津);电子恒温水浴锅(DZKW型,北京永光明医疗仪器厂);Sartorius(BP211D)十万分之一分析天平(北京赛多利斯仪器系统有限公司);PHS-3C型p H计(上海精密仪器有限公司)。
光果甘草(Glycyrrhiza glabraL.)的干燥根及根茎,采于新疆喀什巴楚地区,由新疆石河子大学药学院成玉怀高级实验师鉴定为光果甘草。
1.2 方法
1.2.1 光甘草定含量的测定及分离
色谱条件:采用 KromasilC18柱(4.6 mm×250 mm,5μm),流动相:乙腈-2%冰醋酸溶液(p H3)(53∶47),检测波长 :280 nm,流速 :1.0 mL/min,进样体积:10μL。
利用硅胶柱层析,洗脱液梯度分别为:CHCl3、CHCl3/MeOH(300∶1)、CHCl3/MeOH(100∶1)、CHCl3/MeOH(50∶1)、MeOH,硅胶薄层板跟踪点板。最后合并含有光甘草定的馏分,利用高效液相色谱仪检测纯度。
1.2.2 光甘草定对酪氨酸酶活力的影响及机理的探讨
1.2.2.1 标准曲线的建立
在不加入待测样品的情况下,先将1.0 mL 2.5 mmol/L的L-酪氨酸、0.7 mL 1.0 mmol/L的LDOPA(溶于磷酸盐缓冲溶液p H6.8)置于比色皿中,分别加入 0.4 mL、0.2 mL磷酸盐缓冲溶液(p H6.8)混匀,再加入0.1 mL 100U/mL酪氨酸酶水溶液,在475 nm下隔5 min测定1次吸光度,直至吸光度值不再增加,以时间为横坐标,吸光度值为纵坐标做1条酶活力的标准曲线。
1.2.2.2 单酚酶活力的测定
以2.5 mmol/LL-酪氨酸为底物[6]。先将1.0 mL 2.5 mmol/L的L-酪氨酸(溶于磷酸盐缓冲溶液pH 6.8)置于比色皿中,加入0.2 mL磷酸盐缓冲溶液(pH 6.8)混匀,在室温下放置10 min,加入0.15 mL不同浓度的待测样品,混匀后加入0.15 mL 100 U/mL酪氨酸酶水溶液,立即混匀室温培育25 min后测定OD475。
1.2.2.3 二酚酶活力的测定
以1.0 mmol/L L-DOPA为底物[7-8]。先将0.7 mL 1.0 mmol/L L-DOPA(溶于磷酸盐缓冲溶液pH6.8)置于比色皿中,加入0.1 mL磷酸盐缓冲溶液(pH6.8),在室温下放置5 min,加入0.1 mL不同浓度的待测样品,混匀后加入0.1 mL 100 U/mL酪氨酸酶水溶液,立即混匀室温培育25 min后测定OD475。
待测样品对酪氨酸酶的抑制率按下式计算:
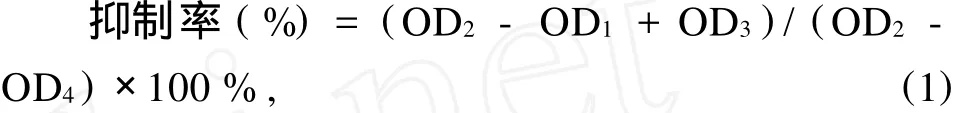
式(1)中:OD1是指含有底物、酪氨酸酶、待测样品的测活体系的吸光度值;OD2是指含有底物、酪氨酸酶,但不含样品的测活体系的吸光度值;OD3是指含有底物、样品,但不含酪氨酸酶的测活体系的吸光度值;OD4是指含有底物,但不含酪氨酸酶、样品的测活体系的吸光度值。
固定酶的浓度为100 U/mL,改变底物L-DOPA浓度,测定不同浓度光甘草定对酶活力的影响,以Lineweaver-Burk双倒数作图,判断抑制剂的抑制类型[7]。通过Lineweaver-Burk双倒数作图,比较酶催化反应的动力学参数,包括表观米氏常数(Km)和最大反应速度(V m)的变化,对酶的抑制作用机理进行判断。
数据用¯χ±S表示,采用Origin8.0软件作图。
2 结果
2.1 光甘草定含量的测定及分离
按“1.2.1”项下的洗脱条件检测,光甘草定得到良好的基线分离。经检测新疆产光果甘草原料药中光甘草定含量约为1.57‰。
按“1.2.1”项下的分离方法分离得到纯度为85%以上的光甘草定,其 HPLC液相图谱见图1。利用本实验室所分离得到的光甘草定进行酪氨酸酶活性影响实验。2.2 光甘草定对酪氨酸酶活力的影响及机理的探讨

图1 光甘草定对照品及样品HPLC液相图谱Fig.1 HPLC chromatograms of reference substance and sample of glabridin
2.2.1 酪氨酸酶的活力标准曲线
单酚酶和二酚酶的活力标准曲线如图2所示。
由图2可以看出,0~20 min内酶活性呈增长趋势,20~25 min酪氨酸酶活性基本稳定达到稳态,因此本实验选择在25 min时测定各个体系的OD值。
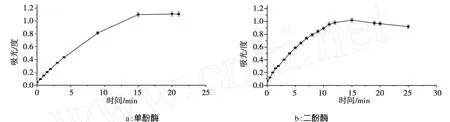
图2 单酚酶与二酚酶活力标准曲线Fig.2 Standard curve of monophenolase and diphenolase
2.2.2 光甘草定对蘑菇酪氨酸酶单酚酶和二酚酶活力的影响
以光甘草定为效应物,以L-Tyr和L-DOPA为底物测定蘑菇酪氨酸酶催化反应的进程曲线和酶活力曲线,如图3、图4所示。
结果表明,随着光甘草定浓度的增大,恒定态斜率下降,说明光甘草定对蘑菇酪氨酸酶的单酚酶活性有显著的抑制作用(图3)。另外,随着光甘草定的浓度增大,二酚酶稳定态活力显著下降(图4),测定 IC50分别为1.28μmol/L、1.56μmol/L。可见光甘草定对酪氨酸酶活性的抑制作用是降低酶的稳定态活力而影响酶的催化作用。
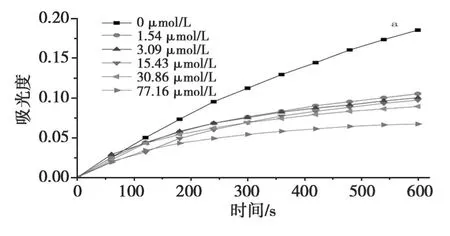
图3 光甘草定对酪氨酸酶单酚酶的抑制进程曲线Fig.3 Progress Curves for the inhibition of tyrosinase monophenolase by glabridin

图4 光甘草定对二酚酶稳态活力的影响Fig.4 The dependence of the steady-state rate)
2.2.3 光甘草定对酪氨酸酶二酚酶活性抑制机理的判断
以光甘草定为抑制剂,测定其对蘑菇酪氨酸酶二酚酶的抑制类型,结果见图5。其Lineweaver-Burk双倒数图均为相交于1/v轴的一组直线,不管抑制剂浓度如何,这组直线的纵截距不变,仍为1/vmax;但各直线的斜率 Kappm/vmax随抑制剂浓度的增加而增加,横截距则随抑制剂浓度的增加其负值增加。说明最大反应速度(vmax)不随抑制剂浓度变化,米氏常数(Km)随着抑制剂浓度增大而增加,符合竞争型抑制类型的特征。
通过图5可得到表现米氏常数(Km)和最大反应速度(vmax),以图5的直线斜率对光甘草定浓度作回归直线,见图5a。根据图5a,由直线在纵轴上的截距除以直线的斜率可以计算出竞争性抑制剂的抑制常数(K1)为33.17μmol/L。

图5 光甘草定Lineweaver-Burk双倒数曲线Fig.5 Lineweaver-Burk plots of glabridin(a:The relationship of the slope and concentration of glaridin)
3 讨论
1)抑制剂对单酚酶和二酚酶活性的作用不同可能是取决于两种酶活性所催化的底物分子结构的差异,大多数的竞争性抑制剂都与底物有着相似的结构或至少某部分结构相似[9]。光甘草定是光果甘草中一种特有成分,其结构中B环上2-OH、4-OH,与L-多巴、L-酪氨酸芳环结钩上的-OH相似(图6中加粗部分),从而易于与酶活中心结合而对酶产生抑制。目前,国内研究表明甘草素、异甘草素具有抑制酪氨酸酶的活性[10],其在结构上与光甘草定相比,都具有4-OH,但不具有2-OH,故推测光甘草定之所以具有如此显著的抑制酪氨酸酶活性的效果,主要是其2-OH所赋予。

图6 L-酪氨酸、L-DOPA与光甘草定的结构Fig.6 The structure of L-tyrosine、L-DOPA and glabridin
2)由图5可知,酶与底物结合的亲和常数1/Km随光甘草定浓度增大而减小,说明其抑制机理表现为竞争型效应。竞争性抑制剂只增加酶-底物结合的表观 Km(Kmapp),即抑制剂浓度增加,Kmapp就增加,而 vmax保持不变。说明光甘草定只与自由酶结合,与L-多巴竞争酶活位点,把一部分酪氨酸酶从黑色素合成的催化环中带走,降低酪氨酸酶在其中的浓度,阻止底物与酪氨酸酶的结合,从而抑制黑色素的合成。可以作为潜在的美白化妆品添加剂。
3)新疆光果甘草资源丰富,主要分布在库尔勒、阿克苏、博乐、石河子地区,储备量比较客观,有野生和人工栽培资源。但是新疆甘草开发研究水平较低,对脂溶性黄酮类成分的开发利用处于初级阶段,本文的研究结果为皮肤美白剂提供了有价值的参考,同时也为西北光果甘草资源的深入开发奠定了研究基础。
[1]Alvaro S F,JoséNeptuno R L,Francisco G C,et al.Tyrosinase:a comprehensive review of its mechanism[J].BBA-Protein Struct M,1995,1:1-11.
[2]Hayashi H,Hattori S,Inoue K,et al.Field Survey of Glycyrrhiza Plants in Central Asia,Chemical Characterization of G.glabra Collected in Uzbekistan[J].Chem Pharm Bull,2003,51(11):1338-1340.
[3]Gupta V K,Fatima A,Faridi U,et al.Antimicrobial potential of Glycyrrhiza glabra roots[J].Journal of Ethnopharmacology,2008,11(6):377-380.
[4]Yokota T,Nishio H,Kubota Y,et al.The inhibitory effect of glabridin from licorice extracts on melanogenesis and inflammation[J].Pigment Cell Research,1998,11(8):855-861.
[5]Shanker K,Fatima A,Negi A S,et al.RP-HPLC method for the quantitation of glabridin in Yashti-madhu(Glycyrrhiza glabra L.)[J].Chromatographia,2007,65(11):771-774.
[6]彭思远,刘 轩,柯红梅,等.木贼活性成分对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报,2008,47(2):115-117.
[7]龚盛昭,杨卓如,程 江.香草醛对酪氨酸酶活性的抑制[J].华南理工大学学报,2006,34(5):53-57.
[8]Zheng Z P,Cheng K W,Chao J F,et al.Tyrosinase inhibitors from paper mulberry(Broussonetia papyrifera)[J].Food Chemistry,2008,106:529-535.
[9]Sakanaka S,Tachibana Y,Okada Y.Preparation and antioxidant properties of extracts of Japanese persimmon leaf tea(kakinoha-cha)[J].Food Chemistry,2005,89:569-575.
[10]周 忠,王建国,王建新,等.油溶性美白剂对酪氨酸酶抑制性能的测试方法[J].用化学工业,2003,33(5):326-328.
The Isolation of Glabridin and Inhibitory Effect on Activity of Tyrosinase
LUO Congyan,MU Chunhai,WANG Yuanji,LI Chaopeng,CHEN Wen
(College of Pharmacy,Shihezi University/Key Laboratory of Xinjiang Phytomedicine Resources,Shihezi 832002,China)
R285.5
A
1007-7383(2010)04-0478-05
2009-10-17
新疆兵团重点科技攻关计划项目(2009GG47)
骆从艳(1985-),女,硕士生,专业方向为药物新制剂与新剂型。
陈文(1967-),男,教授,从事药物新制剂与新剂型的研究。
