新疆马铃薯疮痂病病原的鉴定
2010-10-28杜娟任娟赵思峰任毓忠
杜娟,任娟,赵思峰,任毓忠
(石河子大学绿洲农作物病害防控重点实验室,石河子832003)
新疆马铃薯疮痂病病原的鉴定
杜娟,任娟,赵思峰,任毓忠
(石河子大学绿洲农作物病害防控重点实验室,石河子832003)
为了确定2008年首次发生在新疆的马铃薯疮痂病的病原,以小薯片法和萝卜幼苗法测定分离物的致病性,对来自新疆伊犁地区表现明显疮痂症状的薯块进行了病原的分离。经对分离物形态特征、培养特性、生理生化反应的测定以及16S rDNA序列的分析比对。结果表明,引起新疆马铃薯疮痂病的病原为 Streptomyces acidiscabies和S.scabies;其中 S.acidiscabies是引起新疆马铃薯疮痂病的优势种,且其致病力明显强于S.scabies。
马铃薯疮痂病;16S rDNA序列;链霉菌;鉴定
Abstract:All isolates were obtained from scab potato tubers collected from Yili,Xinjiang.These isolates have pathogenicity to chips of potato and seedlings of radish.Pathogenic isolates were identified asStreptomyces acidiscabiesandS.scabiesbased on morphological,physiological,biochemical characterizations and 16S ribosomal DNA sequence analysis.Pathogenicity that ofS.acidiscabiesis higher than that ofS.scabies.The disease was first reported in Xinjiang.
Key words:potato scab;Streptomyces;16S rDNA sequence;identification
马铃薯是世界上仅次于水稻、小麦、玉米的第四大粮食作物,也是世界上最重要的非禾本科作物。马铃薯疮痂病(potato scab)在世界各地马铃薯种植区普遍发生[1],感染该病的薯块的表面形成痂状病斑,可造成薯块质量下降和商品质量的降低。由于该病发生初期对产量的影响不大,往往被人们忽视,从而致使该病有逐年加重的趋势。
引起马铃薯疮痂病的种类很多,目前国外报道引起马铃薯疮痂病的病原菌主要有 Streptomyces scabies、S.acidiscabies、S.aureof aciens,S.europaeiscabiei、S.luridiscabiei、S.niveiscabiei、S.puniciscabiei、S.reticuliscabiei、S.Stelliscabiei 和 S.turgidiscabies等[1-4],并且还不断有新的疮痂致病种被报道[5-6]。赵伟全等[7]对我国10个省区的马铃薯疮痂病菌进行了鉴定,结果表明病原菌为 Streptomyces scabies、S.acidiscabies及1个未知种。张萌等[8]对国内8个省区的马铃薯疮痂病菌采用16S rDNA遗传多样性分析,结果表明病原物种类有 S.scabies、S.galilaeus、S.bobili、S.turgidiscabies、S.acidiscabies、S.diastatochromogenes、S.setonii、S.enissocaesilis,其中 S.galilaeus、S.bobili和 S.enissocaesilis均为新发现的疮痂病病原。同时不同省份的疮痂病病原种类不同,这说明中国马铃薯疮痂病菌存在明显的遗传多样性,且分布较为复杂。目前,在新疆还未见相关马铃薯疮痂病病原鉴定和防治的报道。本研究首次在新疆伊犁地区分离到了6株马铃薯疮痂病菌,采用生理生化特性鉴定和16S rDNA序列分析对其进行鉴定,以求明确其具体种类,确定其与国内其他省份马铃薯疮痂病的关系和来源,从而为该病害的防治提供依据。
1 材料与方法
1.1 材料
病样来自于2008年6月新疆伊犁地区市场上出售的表面带有痂状病斑的马铃薯。
1.2 方法
1.2.1 病原的分离纯化
将病薯用蒸馏水洗净,用解剖刀切取约5 mm的病健交界处的薯块,于乙醇溶液(75%)中浸泡约30 s,用无菌水冲洗3遍,再将其置于研钵中加适量无菌水进行充分研磨,然后用接种环在燕麦琼脂培养基(OMA)(燕麦片30 g,煮沸30 min,加琼脂15 g后用水定容至1 L)上划线。经3次纯化培养后,选取6个菌株作为供试菌株。
1.2.2 致病性测定
1.2.2.1 菌悬液的制备
将纯化后的菌株在燕麦琼脂培养基平板上活化后,挑取单菌落接种于盛有培养基 ISP1的试管中,将其封好并作好标记,置于28℃、180 r/min摇床上震荡培养3 d,用无菌水稀释后制成1×106CFU/mL左右的菌悬液用于致病性测定。
1.2.2.2 测定方法
分离物致病性的测定分别参照小薯片法[9]和萝卜幼苗法[10]。
1)小薯片法:选择健康的感病马铃薯、甘薯、胡萝卜和萝卜(直径约4~5 cm),先用75%的乙醇溶液进行表面消毒,然后用无菌打孔器(直径1.5 cm)打取以上接种体的中心部分,将圆柱状的接种体切成厚2 mm左右的圆片,放在有无菌滤纸保湿的培养皿中,每皿4片;将在OMA培养基上生长7 d的待测菌株切取0.5 cm×0.5 cm大小的菌块,倒置接种于接种体上;于27℃的恒温箱中黑暗培养,7 d后观察结果,以接种体圆片的坏死大小作为致病性指标;
2)萝卜幼苗检测法。
将萝卜籽先用75%的乙醇溶液浸泡约10 min,用无菌水冲洗3遍,晾干,在以无菌滤纸保湿的培养皿中催芽16 h,选择萌发一致的籽粒放入装有200 mL 1%琼脂培养基的组培瓶,每瓶12粒;接种800 μL菌悬液,以未接菌的作为对照,于24℃光照培养箱中培养,6 d后取出测量幼苗长度。以接种幼苗长度的平均值与对照幼苗长度平均值的百分比作为菌株的抑制率,以此作为致病性指标。以上每种方法均3次重复。
1.2.3 病原菌生物学特性的测定
病原形态特征观察:用挑针轻轻挑下在水琼脂培养基上生长7 d的菌落,置于载玻片上,轻轻涂匀然后用结晶紫染色约1 min,在油镜下观察病菌孢子链和孢子的形态特征。
菌株的碳源利用、氮源利用、对淀粉的利用和硫化氢气体的产生等参照Lambert等[11-12]和 Miyajima等[13]的方法测定。其它鉴定指标的测定参照文献[14]进行。
1.2.4 16S rDNA序列扩增及同源性分析
菌株基因组DNA的提取参照文献[15]中的方法进行。采用链霉菌16S rDNA通用扩增引物,引物序列 pA:5′-AGA GTT TGA TCC TGG CTC AG-3′,p H:5′-AAG GAG GTG ATC CA G CCG CA-3′。
PCR反应体系为:10×buffer:5μL;0.2 mmol/L DNTP:4μL;1.5 mmol/L MgCl2:3μL;0.2 μmol/L pA 5μL;0.2μmol/L p H 5μL;1 U Taq DNA聚合酶:2μL,模板:1μL,然后用双蒸水补足50μL。PCR反应条件为:95℃预变性1 min,95℃变性30 s,55℃退火30 s,72℃延伸1 min 20 s,30个循环,最后72℃延伸6 min。通过1%琼脂糖凝胶电泳检测PCR产物。
将扩增出的16S rDNA片段交由上海生工生物工程技术服务有限公司完成测序。将所得序列校对后,在 NCBI的 GenBank中进行Blast比对,选取与各菌株相似性较高的链霉菌菌株的16S rDNA序列构建系统发育树,利用发育树对疮痂病菌进行分类,同时比较各测试菌株间的同源性。
2 结果与分析
2.1 致病性测定结果
结果见表1。
用小薯片法进行菌株致病性检测时,分别在马铃薯、甘薯、胡萝卜和萝卜上接种,7 d后,致病菌株均能在接种体上定殖生长,菌片与接种体粘连并使接种体产生褐色的坏死斑,且坏死程度重;而致病性弱的菌株虽然能在接种体上生长,但使接种体的坏死程度轻。在用萝卜幼苗法检测时,致病菌株能显著抑制幼苗的生长,抑制率为28.4%~70.8%。

表1 致病性测定结果Tab.1 The result of isolates pathogenicity
2.3 病原菌生物学特性的测定
通过对6个马铃薯疮痂病菌进行生物学特性的测定,发现不同病菌的培养性状差别较大(表2)。
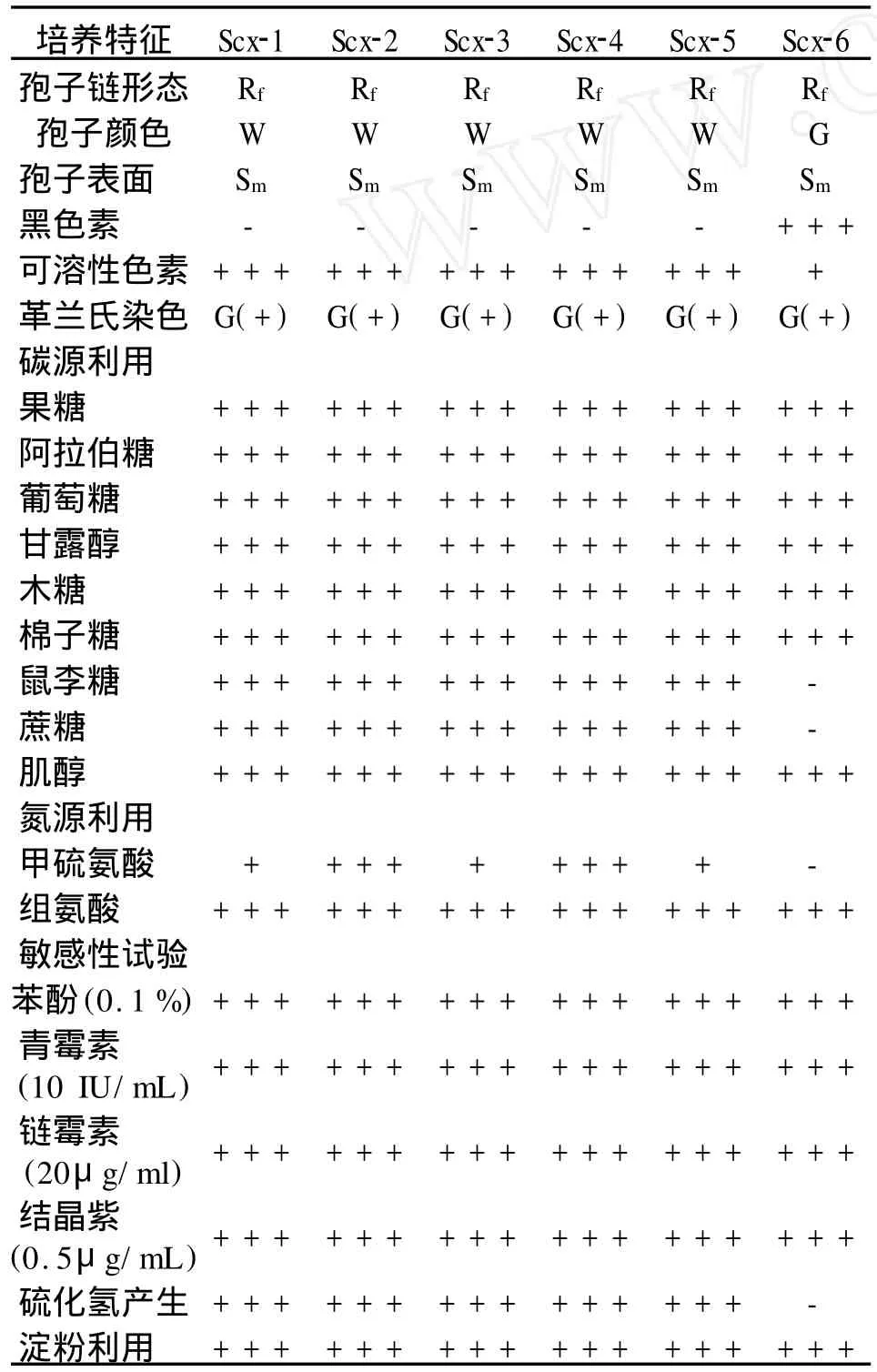
表2 马铃薯疮痂病菌的生物学特性Tab.2 Characteristics of potato scab strains and other Streptomyces species and strains
根据各菌株对 ISP(international streptomyces project)中的碳源(阿拉伯糖、棉子糖、甘露糖、木糖、果糖、鼠李糖等)的利用、对氮源的利用和硫化氢气体的产生等生物学特征可将本研究中的测试菌株分为 2 组(表 2)。
I组:孢子丝呈自由弯曲状,孢子白色、光滑,产生黄褐色可溶性色素,不产生黑色素;能以ISP中的所有糖类为单一碳源,能以甲硫氨酸、组氨酸为单一氮源,对青霉素(10 IU/mL)、链霉素(20μg/mL)、苯酚(0.1%)、结晶紫(0.5μg/mL)不敏感,产生硫化氢气体;该组菌株(Scx-1~Scx-5)的生物学特性与已报道的马铃薯疮痂病菌株S.acidiscabies基本相同。
II组:孢子丝呈自由弯曲状,孢子灰色、光滑,产生可溶性色素,可产生黑色素;不能以ISP中的鼠李糖和蔗糖为单一碳源,能以组氨酸为单一氮源,但不能以甲硫氨酸为单一氮源,对青霉素(10 IU/mL)、苯酚(0.1%)、链霉素(20μg/mL)、结晶紫(0.5μg/mL)不敏感,不产生硫化氢气体。该组菌株(Scx-6)与已报道的S.scabies菌株的生物学特性较为接近。
2.4 16S rDNA扩增及测序结果
以pA和p H为引物,对本研究中的所有菌株的基因组进行扩增,结果均能扩增出约1.5 kbp的16S rDNA片段。本研究选取 Scx-1、Scx-3、Scx-6三菌株的16S rDNA片段进行测序(图1),通过在NCBI GenBank中进行Blast比较,证明均为链霉菌的16S rDNA序列。
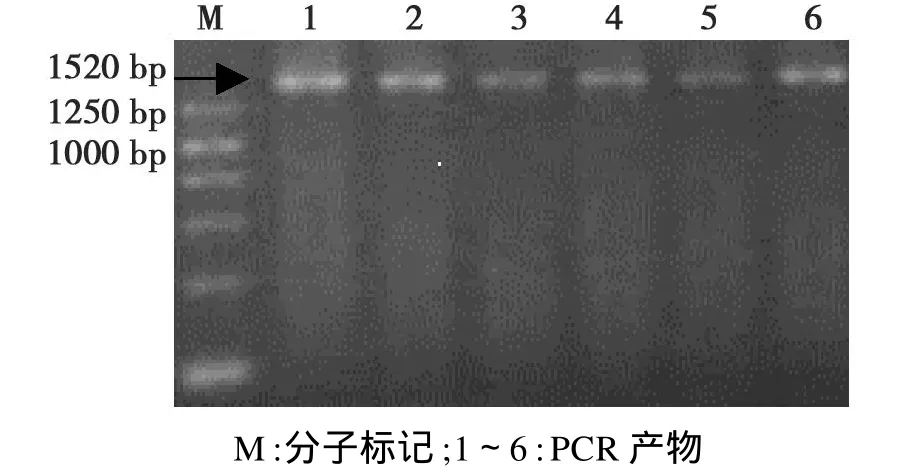
图1 16S rDNA片段扩增结果Fig.1 The results of PCR amplification for 16S rDNA sequences
2.5 基于16S rDNA序列构建系统发育树
选取在 GenBank中Blast比较时与各测序菌株相似性较高的菌株及链霉菌种的几个典型种菌株,利用DNAStar 5.0序列分析软件构建发育树(图2),对各菌株的16S rDNA序列进行同源性比较,发现菌株Scx-6与美国的菌株S.scabies(序列号:ATCC 49173)的同源性为100%,Scx-1和 Scx-3与 S.acidiscabies(序列号:ATCC 49003)的同源性为99.8%。

图2 链霉菌的16S rDNA序列构建的系统发育树Fig.2 Phylogenetic tree based on the 16S rDNA sequences ofStreptomyces
3 讨论
通过对供试菌株形态特征、培养特性、生理生化反应的观察和测定,同时结合16S rDNA序列分析,将引起新疆马铃薯疮痂病的病原鉴定为 S.acidiscabies和S.scabies,且 S.acidiscabies的致病力明显强于 S.scabies。但鉴定为 S.acidiscabies的Scx-5菌株致病力相对其它菌株较弱,可能是菌株本身遗传特性上存在差异,需进一步研究证实。
马铃薯疮痂病菌还可以侵染萝卜、甜菜等其它作物,本研究选用萝卜幼苗法和小薯片法对菌株进行致病性测定,结果发现,这2种方法检测时均能表现出抑制萝卜幼苗的生长和使小薯片产生坏死等症状,说明所有菌株均有致病能力。另外,本研究对菌株的生物学特性测定发现所有菌株对青霉素、苯酚、链霉素等均不敏感,与已报道的 S.scabies和 S.acidiscabies菌株的特性不太一致,这也是需要进一步探索的重点。在新疆可能还存在其他种类的马铃薯疮痂病菌类群,但是由于本研究所采集菌株的范围和数量有限。为了防止该病害在新疆马铃薯上的进一步扩展和蔓延,保证新疆马铃薯产物的可持续发展,有必要对新疆发生的马铃薯疮痂病进行全面的调查和病原鉴定工作。
[1]Loria R,Bukhalid R A,Fry B A,et al.Plant pathogenicity in the genusStreptomyces[J].Plant Disease,1997,81:836-846.
[2]Wanner L A.A survey of genetic variation inStreptomyces isolates causing potato common scab in the United States[J].Phytopathology,2006,96:1363-1371.
[3]Park D H,Yu YM,KimJ S,et al.Characterization ofStreptomycetescausing potato common scab in K orea[J].Plant Disease,2003,87:1290-1296.
[4]Kreuze J F,Suomalainen S,Paulin L,et al.Phylogenetic analysis of 16S rRNA genes and PCR analysis of the nec1 gene from Streptomycesspp.causing common scab,pitted scab,and netted scab in Finland[J].Phytopathology,1999,89:462-469.
[5]Groth I,Schütze B,Boettcher T.Kitasatospora putterlickiae sp.nov.,isolated from rhizosphere soil,transfer ofStreptomyces kif unensisto the genusKitasatosporaasKitasatospora kif unensiscomb.nov.,and emended description ofStreptomyces aureof aciensDuggar 1948[J].International Journal of Systematic and Evolutionary Microbiology,2003,53:2033-2040.
[6]Wanner L A.A new strain of Streptomyces causing common scab in potato[J].Plant Disease,2007,91(4):352-359.
[7]赵伟全,杨文香,李亚宁,等.中国马铃薯疮痂病菌的鉴定[J].中国农业科学,2006,39(2):313-318.
[8]张萌,赵伟全,于秀梅,等.中国马铃薯疮痂病病原菌16 S rDNA的遗传多样性分析[J].中国农业科学,2009,42(2):499-504.
[9]Loria R,Bukhalid R A,Creath R A,et al.Differential production of thaxtomins by pathogenicStreptomyces species in vitro[J].Phytopathology,1995,85:537-541.
[10]Leiner R H,Fry B A,Carling D E,et al.Probable involvement of thaxtomins A in pat hogenicityofStreptomyces scabieson seedlings[J].Phytopathology,1996,86:709-713.
[11]Lambert D H,Loria R.Streptomyces scabiessp.nov.,nom.rev[J].International Journal of Systematic Bacteriology,1989,39:387-392.
[12]Lambert D H,Loria R.Streptomyces acidiscabiessp.nov[J].International Journal of Systematic Bacteriology,1989,39:393-396.
[13]Miyajima K,Tannaka F,Takeuchi T,et al.Streptomyces turgidiscabiessp.nov[J].International Journal of Systematic Bacteriology,1998,48:495-502.
[14]中国科学院微生物研究所伯杰细菌鉴定手册翻译组.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984.
[15]Kieser T,Bibb M J,Buttner M J,et al.PracticalStreptomycesGenetics[M].Norwich:The John Innes Foundation,2000.
Identification of Pathogen on Potato Scab in Xinjiang
DU Juan,REN Juan,ZHAO Sifeng,REN Yuzhong
(The Key Laboratory of Prevention and Control for Oasis Crop Disease,Shihezi University,Shihezi 832003,China)
S435.32;TQ351.376
A
1007-7383(2010)04-0414-04
2009-08-29
杜娟(1979-),女,助理实验师,硕士生,从事植物植物病理学研究;e-mail:dujuanshzdx@126.com。
任毓忠(1970-),男,副教授,从事植物细菌病害及病害流行学研究;e-mail:ryzh㊦agr@shzu.edu.cn。
